不同剂量阿托伐他汀对急性脑缺血/再灌注损伤大鼠血管内皮功能的影响及其与自噬相关信号通路Ca2+/AMPK/mTOR的关系研究
2019-07-15李玉竹邹梅于周
李玉竹,邹梅,于周
过去20年,全球年龄标化脑卒中病死率所有下降,但脑卒中新发患者数量及其全球总负担巨大,且仍在增加。据统计,脑卒中居我国城市和农村居民致残和致死原因第一位,其中缺血性脑卒中约占70%[1]。缺血性脑卒中是由动脉粥样硬化引起颅内外血管闭塞或狭窄而导致脑供血不足,进而引发的脑组织坏死,因此其治疗重点为尽快恢复脑组织血供并抑制脑缺血/再灌注损伤[1-2]。既往研究表明,脑缺血灶中细胞大量死亡的同时可形成新生血管、诱导血管内皮细胞增殖,进而改善脑组织血供,恢复脑功能[3]。血管内皮功能与自噬密切相关,但自噬是柄“双刃剑”,正常情况下其可保护机体内皮细胞结构及功能完整,过度激活后又会使脑缺血/再灌注损伤加重。
阿托伐他汀是一种新型人工合成降脂药,可有效降低血清低密度脂蛋白胆固醇(LDL-C)及总胆固醇水平,阻止血栓形成及改善血管内皮功能,在预防急性心血管事件及延缓动脉粥样硬化进展方面具有重要作用[4-5],但其与自噬的关系研究报道较少。本研究旨在探讨不同剂量阿托伐他汀对急性脑缺血/再灌注损伤大鼠血管内皮功能的影响,并分析其与自噬相关信号通路Ca2+/AMPK/mTOR的关系,现报道如下。
1 材料与方法
1.1 实验动物 本实验于2017年6—12月完成。选取75只SPF级Wistar雄性大鼠,6周龄,体质量190~210 g,平均体质量(201.4±4.1)g,均购自北京维通利华实验动物技术有限公司,动物合格许可证号:SCXK(京)2018-23。大鼠分笼饲养,每笼5只,室温维持在22~26 ℃,相对湿度为55%~65%,昼夜循环,保持12 h光照、12 h黑暗,灌胃、添加饲料及换水等均有专人负责。常规饲养1周后开始实验。
1.2 主要药物、试剂及仪器
1.2.1 主要药物 阿托伐他汀钙片(大连辉瑞制药有限公司生产,生产批号:L29154);自制阿托伐他汀混悬液:将阿托伐他汀钙片研磨为粉,阿托伐他汀钙片与0.9%氯化钠溶液以1 mg:2 ml比例混合。
1.2.2 主要试剂 一氧化氮合酶(NOS)、一氧化氮(NO)试剂盒(南京建成生物工程研究所生产),DAB显色剂、SP试剂盒(北京中杉金桥生物技术有限公司生产),兔抗鼠血管内皮生长因子(VEGF)单克隆抗体(美国Santa Cruz Biotechnology公司生产),LC3-Ⅱ、Beclin-1、腺苷酸活化蛋白激酶(AMPK)及哺乳动物雷帕霉素靶蛋白(mTOR)多克隆抗体(美国Proteintech公司生产)。
1.2.3 主要仪器 病理组织漂烘仪(常州市中威电子仪器有限公司生产,型号:PHY-Ⅲ),转轮式切片机(德国莱卡公司生产,型号:莱卡-2016),包埋机(常州市中威电子仪器有限公司生产,型号:BMJ-Ⅲ),全自动封闭式组织脱水机(常州市中威电子仪器有限公司生产,型号:TSJ-Ⅱ),电热恒温鼓风干燥箱(美国KIMBLE公司生产,型号:DHG-9023A),数字显示隔水式电热恒温培养箱(美国KIMBLE公司生产,型号:PYX-DHS),漩涡混合器(美国KIMBLE公司生产,型号:XW-80A),离心机(美国KIMBLE公司生产,型号:TGL-168)。
1.3 分组及实验方法 采用随机数字表法将所有大鼠分为假手术组(A组)、模型制备组(B组)、阿托伐他汀低剂量组(C组)、阿托伐他汀中剂量组(D组)及阿托伐他汀高剂量组(D组),每组15只。B、C、D、E组大鼠制备急性脑缺血/再灌注损伤模型。模型制备前2周,C、D、E组大鼠分别给予阿托伐他汀5、10、20 mg/kg混悬液灌胃,A组和B组大鼠给予等剂量0.9%氯化钠溶液灌胃,均1次/d。
1.4 急性脑缺血/再灌注损伤模型制备 采用改良Zea-Longa线栓法[6]制备急性脑缺血/再灌注损伤模型,具体如下:腹腔注射2.4%水合氯醛0.8 ml/100 g麻醉大鼠,麻醉满意后固定大鼠背部,常规消毒后于颈部正中作一纵向切口,依次暴露右侧翼腭动脉、颈总动脉、颈内动脉及颈外动脉,将颈总动脉近心端与颈外动脉根部结扎,在颈内动脉起始部位打活结。动脉夹夹于颈内动脉近颅端,采用眼科剪在颈总动脉结扎位置远端剪一斜口,插入制备好的线栓,感觉到阻力后停止,备线结扎后固定线栓,缝合切口、消毒。以大鼠苏醒后出现右侧Horner征(眼球内陷,眼裂变小)及左侧以前肢为重的偏瘫为模型制备成功。A组大鼠于颈部正中作一纵向切口,依次暴露右侧翼腭动脉、颈总动脉、颈内动脉及颈外动脉。
1.5 观察指标
1.5.1 神经功能缺损评分 再灌注2、6、24、48、72 h时分别从5组随机选取3只大鼠,采用Zea-Longa评分法评估大鼠神经功能缺损评分,其中无神经功能缺损症状计0分,无法伸展对侧前爪计1分,行走时向偏瘫一侧转圈计2分,行走时向偏瘫一侧倾斜计3分,意识丧失、无法自发行走计4分[7]。
1.5.2 脑梗死体积 神经功能缺损评分结束后腹腔注射2.4%水合氯醛0.8 ml/100 g麻醉大鼠,断颈处死,取脑组织速冻10 min,在视神经交叉处向前作冠状切片,共4个脑片,厚度2 mm,放置在2%的TTC磷酸盐缓冲液中孵育30 min,采用10%福尔马林固定,其中梗死组织无着色、正常组织着深红色,数码相机正反面拍照,采用病理图像分析仪检测每片总面积与梗死面积,梗死体积/大脑总体积=(各片正反面梗死面积总和/2×片厚)/(各片正反面总面积总和/2×片厚)×100%。
1.5.3 脑组织病理形态 选取脑组织,缓冲液冲洗,10%甲醛固定后行酒精梯度脱水、透明,石蜡包埋后切片,厚度为4 mm,常规行HE染色,光镜下观察5组大鼠脑组织病理形态。
1.5.4 神经元凋亡率 采用TUNEL法检测5组大鼠再灌注72 h神经元凋亡率,具体如下:脑组织切片经梯度酒精脱蜡,再滴加不含DNase酶的蛋白酶K溶液20 mg/ml,37 ℃冰箱内放置20 min,采用PBS洗涤;加入新鲜配制的3%过氧化氢(H2O2)溶液于室温下孵育10 min,采用PBS洗涤;每个样品内滴加新鲜配制的生物素标记液50 ml,放置在暗盒内维持切片湿润,37 ℃环境下孵育60 min,采用PBS洗涤;配制DAB显色液和Streptavidin-HRP工作液,每个样品内滴加50 ml,放置在暗盒内维持切片湿润,孵育30 min,采用PBS洗涤;常规梯度酒精脱水后透明,封片。光镜下观察切片中棕褐色为凋亡神经元,高倍镜下每张切片计数8个不同视野并取平均值。
1.5.5 脑组织VEGF表达情况 采用免疫组化法检测5组大鼠再灌注2、24、72 h脑组织VEGF表达情况,具体如下:石蜡切片脱蜡后将内源性过氧化物酶灭活,热修复暴露抗原位点,置于孵育盒内,使用PBS溶液冲洗3次,3 min/次,加入山羊血清,孵育10 min,再加入一抗兔抗鼠VEGF单克隆抗体,4 ℃过夜。PBS溶液冲洗3次,5 min/次,滴入二抗在室温下孵育10 min,PBS溶液冲洗3次,3 min/次,滴入辣根酶标记的链酶卵白素,采用DAB显色剂显色,中性树胶封片。图像中棕黄色细胞为阳性细胞,采用Image-Pro Plus 6.0图像分析软件检测阳性细胞光密度。
1.5.6 脑组织NOS、NO含量 采用化学比色法检测5组大鼠再灌注2、24、72 h脑组织NOS、NO含量,具体如下:取脑组织1份,采用4 ℃预冷的0.9%氯化钠溶液冲洗脑组织血液,0.1 g匀浆,1 500×g离心10 min,取上清液,采用化学比色法检测5组大鼠脑组织NOS、NO含量,严格按照试剂盒说明书进行操作。
1.5.7 脑组织LC3-Ⅱ、Beclin-1、AMPK及mTOR蛋白表达情况 采用Western-blot法检测5组大鼠再灌注72 h脑组织LC3-Ⅱ、Beclin-1、AMPK及mTOR蛋白表达情况,具体如下:选取脑组织研磨,经组织裂解后上样电泳,起始电压80 V,溴酚蓝染料前缘进入到分离胶上缘后电压增加到100 V,溴酚蓝染料泳出分离胶下缘后电泳结束。采用半干电转移仪于PVDF膜内行蛋白质电转移,恒流30 mA,连续90 min。PVDF膜取出后采用5% TBST脱脂奶粉封闭,震荡60 min。封闭结束后采用TNS-T漂洗液洗膜3次,10 min/次,然后将膜转移到杂交袋内,加入适量漂洗液稀释抗体,封口后4 ℃孵育过夜;TBST漂洗液洗膜3次,10 min/次,在加入漂洗液稀释的辣根过氧化物酶标记二抗,震荡60 min。PVDF膜放置在电化学发光(ECL)显色液内震荡温育5 min,暗室下曝光、显影及定影。清水冲洗后晾干扫描,采用IPP软件分析扫描图像目标条带灰度值。目标蛋白相对表达量=目标蛋白条带灰度值/内参条带灰度值。
1.6 统计学方法 采用SPSS 19.0统计学软件进行数据分析,计量资料以(±s)表示,多组间比较采用单因素方差分析,两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 神经功能缺损评分 再灌注2、6、24、48、72 h,A组大鼠神经功能缺损评分均为0;B、C、D、E组大鼠神经功能缺损评分比较,差异有统计学意义(P<0.05);其中D组和E组大鼠神经功能缺损评分低于B组、C组,差异有统计学意义(P<0.05,见表1)。
2.2 梗死体积/大脑总体积 再灌注2、6、24、48、72 h,A组大鼠梗死体积/大脑总体积均为0;B、C、D、E组大鼠梗死体积/大脑总体积比较,差异有统计学意义(P<0.05);其中D组和E组大鼠梗死体积/大脑总体积低于B组、C组,差异有统计学意义(P<0.05,见表2)。
表1 B、C、D、E组大鼠再灌注2、6、24、48、72 h神经功能缺损评分比较(±s,分)Table 1 Comparison of neurological deficit score in groups B,C,D and E 2,6,24,48 and 72 hours after reperfusion
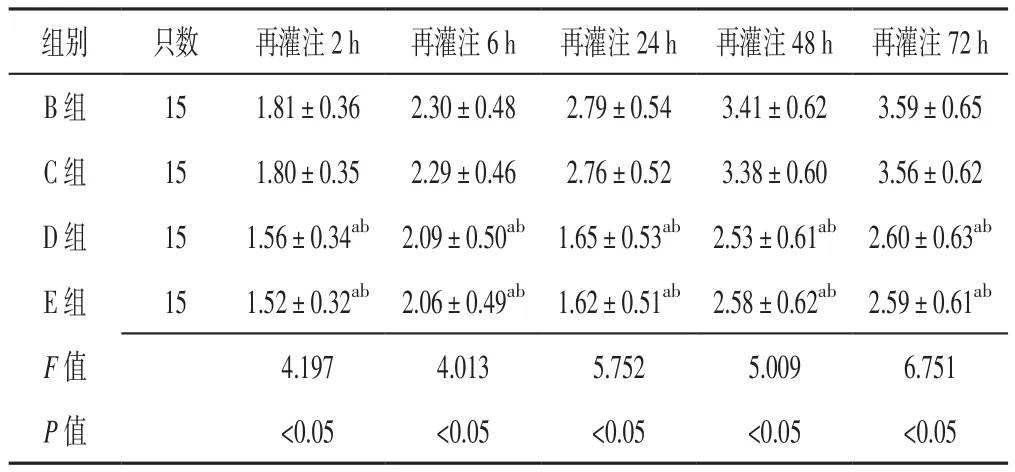
表1 B、C、D、E组大鼠再灌注2、6、24、48、72 h神经功能缺损评分比较(±s,分)Table 1 Comparison of neurological deficit score in groups B,C,D and E 2,6,24,48 and 72 hours after reperfusion
注:与B组比较,aP<0.05;与C组比较,bP<0.05
组别 只数 再灌注2 h 再灌注6 h 再灌注24 h 再灌注48 h 再灌注72 h B组 15 1.81±0.36 2.30±0.48 2.79±0.54 3.41±0.62 3.59±0.65 C组 15 1.80±0.35 2.29±0.46 2.76±0.52 3.38±0.60 3.56±0.62 D 组 15 1.56±0.34ab 2.09±0.50ab 1.65±0.53ab 2.53±0.61ab 2.60±0.63ab E组 15 1.52±0.32ab 2.06±0.49ab 1.62±0.51ab 2.58±0.62ab 2.59±0.61ab F值 4.197 4.013 5.752 5.009 6.751 P值 <0.05 <0.05 <0.05 <0.05 <0.05
表2 B、C、D、E组大鼠再灌注2、6、24、48、72 h梗死体积/大脑总体积比较(±s,%)Table 2 Comparison of infarction volume/total brain volume in groups B,C,D and E 2,6,24,48 and 72 hours after reperfusion

表2 B、C、D、E组大鼠再灌注2、6、24、48、72 h梗死体积/大脑总体积比较(±s,%)Table 2 Comparison of infarction volume/total brain volume in groups B,C,D and E 2,6,24,48 and 72 hours after reperfusion
注:与B组比较,aP<0.05;与C组比较,bP<0.05
组别 只数 再灌注2 h 再灌注6 h 再灌注24 h 再灌注48 h 再灌注72 h B 组 3 12.14±0.47 14.11±0.68 19.30±1.09 16.19±0.64 15.91±0.45 C 组 3 12.10±0.46 14.08±0.66 19.28±1.10 16.16±0.61 15.89±0.42 D 组 3 10.63±0.45ab 13.32±0.65ab 16.78±1.12ab 12.59±0.60ab 12.25±0.43ab E 组 3 10.59±0.44ab 13.29±0.61ab 16.71±1.08ab 12.53±0.62ab 12.22±0.41ab F值 4.802 4.163 6.052 6.971 8.683 P 值 <0.05 <0.05 <0.05 <0.05 <0.05
2.3 脑组织病理形态 A组大鼠脑组织内皮质区域神经元层次分明,神经元形态、结构及数量正常;B组大鼠缺血区域内脑组织坏死神经元较多,正常神经元减少,细胞为梭形,胞核出现皱缩、偏移,胞质较少,为空泡状,排列紊乱且周边明显水肿;C组大鼠脑组织病理形态与B组相似;D组和E组大鼠脑组织损伤较轻,周边水肿明显好转,坏死神经元数量较少,见图1。
2.4 神经元凋亡率 再灌注72 h,A组大鼠凋亡神经元数量极少;B组大鼠凋亡神经元散布在缺血半暗带区域内,且分布不均匀;C组大鼠凋亡神经元数量与B组相近;D组和E组大鼠凋亡神经元数量明显少于B组、C组,见图2。再灌注72 h,A组大鼠神经元凋亡率为(1.00±0.52)%,B组 为(42.18±0.49)%,C组 为(40.13±0.55)%,D组为(25.10±0.56)%,E组为(24.87±0.58)%。5组大鼠神经元凋亡率比较,差异有统计学意义(F=27.194,P<0.05);其中B、C、D、E组大鼠神经元凋亡率高于A组,D组和E组大鼠神经元凋亡率低于B组、C组,差异有统计学意义(P<0.05)。
2.5 脑组织VEGF相对表达量及NO、NOS含量 再灌注2、24、72 h,5组大鼠脑组织VEGF相对表达量及NO、NOS含量比较,差异有统计学意义(P<0.05);再灌注2 h,D组和E组大鼠脑组织VEGF相对表达量高于B组、C组,B组大鼠脑组织NO、NOS含量高于A组,差异有统计学意义(P<0.05);再灌注24、72 h,D组和E组大鼠脑组织VEGF相对表达量高于B组、C组,B、C、D、E组大鼠脑组织NO、NOS含量高于A组,D组和E组大鼠脑组织NO、NOS含量低于B组、C组,差异有统计学意义(P<0.05,见表3)。
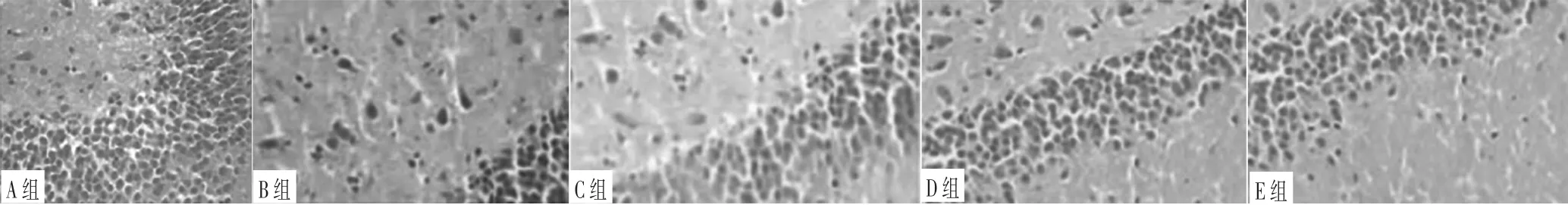
图1 5组大鼠脑组织病理学形态(HE染色,×400)Figure 1 Pathological morphology of brain tissue in the five groups

图2 5组大鼠神经元凋亡情况(TUNEL染色,×400)Figure 2 Neuronal apoptosis status in the five groups
表3 5组大鼠再灌注2、24、72 h脑组织VEGF相对表达量及NO、NOS含量比较(±s)Table 3 Comparison of relative expression quantity of VEGF,NO and NOS in brain tissue in the five groups 2,24 and 72 hours after reperfusion
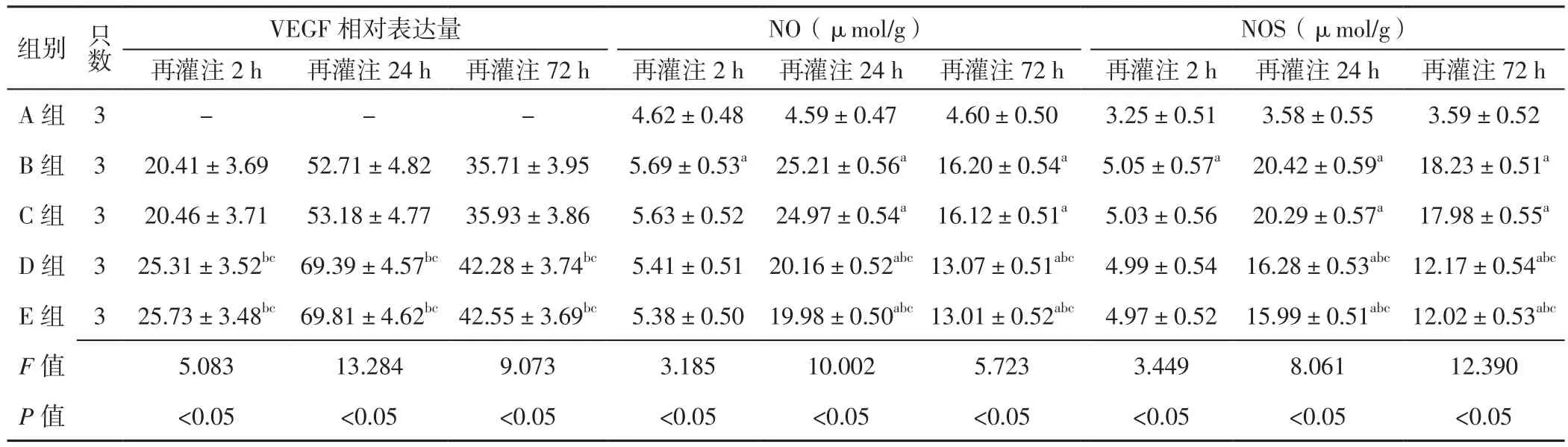
表3 5组大鼠再灌注2、24、72 h脑组织VEGF相对表达量及NO、NOS含量比较(±s)Table 3 Comparison of relative expression quantity of VEGF,NO and NOS in brain tissue in the five groups 2,24 and 72 hours after reperfusion
注:VEGF=血管内皮生长因子,NO=一氧化氮,NOS=一氧化氮合酶;与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05;“-”为无相关数据
组别 只数VEGF相对表达量 NO(μmol/g) NOS(μmol/g)再灌注2 h 再灌注24 h 再灌注72 h 再灌注2 h 再灌注24 h 再灌注72 h 再灌注2 h 再灌注24 h 再灌注72 h A 组 3 - - - 4.62±0.48 4.59±0.47 4.60±0.50 3.25±0.51 3.58±0.55 3.59±0.52 B 组 3 20.41±3.69 52.71±4.82 35.71±3.95 5.69±0.53a 25.21±0.56a 16.20±0.54a 5.05±0.57a 20.42±0.59a 18.23±0.51a C 组 3 20.46±3.71 53.18±4.77 35.93±3.86 5.63±0.52 24.97±0.54a 16.12±0.51a 5.03±0.56 20.29±0.57a 17.98±0.55a D 组 3 25.31±3.52bc 69.39±4.57bc42.28±3.74bc 5.41±0.51 20.16±0.52abc13.07±0.51abc 4.99±0.54 16.28±0.53abc12.17±0.54abc E 组 3 25.73±3.48bc 69.81±4.62bc42.55±3.69bc 5.38±0.50 19.98±0.50abc13.01±0.52abc 4.97±0.52 15.99±0.51abc12.02±0.53abc F值 5.083 13.284 9.073 3.185 10.002 5.723 3.449 8.061 12.390 P 值 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05 <0.05
2.6 脑组织LC3-Ⅱ、Beclin-1、mTOR、AMPK蛋白表达情况 再灌注72 h,5组大鼠脑组织LC3-Ⅱ、Beclin-1、mTOR、AMPK蛋白相对表达量比较,差异有统计学意义(P<0.05);其中B、C、D、E组大鼠脑组织LC3-Ⅱ、Beclin-1、mTOR、AMPK蛋白相对表达量高于A组,D组和E组大鼠脑组织LC3-Ⅱ、Beclin-1、mTOR、AMPK蛋白相对表达量低于B组、C组,差异有统计学意义(P<0.05,见表4)。
表4 5组大鼠再灌注72 h脑组织LC3-Ⅱ、Beclin-1、AMPK、mTOR蛋白相对表达量比较(±s)Table 4 Comparison of relative protein expression quantity of LC3-Ⅱ,Beclin-1,AMPK and mTOR in brain tissue in the five groups 72 hours after reperfusion

表4 5组大鼠再灌注72 h脑组织LC3-Ⅱ、Beclin-1、AMPK、mTOR蛋白相对表达量比较(±s)Table 4 Comparison of relative protein expression quantity of LC3-Ⅱ,Beclin-1,AMPK and mTOR in brain tissue in the five groups 72 hours after reperfusion
注:AMPK=腺苷酸活化蛋白激酶,mTOR=雷帕霉素靶蛋白;与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05
组别 只数 LC3-Ⅱ蛋白 Beclin-1蛋白 AMPK蛋白 mTOR蛋白A 组 3 0.06±0.02 0.05±0.03 0.20±0.05 0.21±0.06 B 组 3 0.24±0.04a 0.21±0.05a 0.61±0.07a 0.56±0.07a C 组 3 0.22±0.04a 0.20±0.04a 0.59±0.06a 0.54±0.06a D 组 3 0.13±0.03abc 0.11±0.04abc 0.29±0.06abc 0.32±0.05abc E 组 3 0.12±0.04abc 0.10±0.03abc 0.27±0.05abc 0.30±0.06abc F值 7.083 8.114 6.053 7.119 P 值 <0.05 <0.05 <0.05 <0.05
3 讨论
脑缺血/再灌注损伤指脑组织缺血一定时间后恢复血供,但相应脑组织功能未完全恢复或损伤更严重。脑缺血/再灌注损伤的发生机制较为复杂,可能与自由基过度形成、血管内皮功能损伤、细胞内Ca2+超载、炎性反应等有关,其中再灌注是脑缺血后神经功能恢复的根本条件,但再灌注又是加重脑组织损伤的主要原因之一[8]。脑缺血/再灌注的本质是恢复脑组织循环功能,减轻脑组织损伤,避免脑组织缺血范围扩大,加速缺血半暗带神经元功能恢复等。本研究采用改良Zea-Longa线栓法制备急性脑缺血/再灌注损伤大鼠模型,结果显示,B组大鼠缺血区域内出现缺血/再灌注损伤病理表现,且神经功能缺损评分较高,提示模型制备成功。
阿托伐他汀为他汀类调脂药,其不但具有良好的调脂作用,还具有抑制血栓形成、细胞黏附、平滑肌细胞增殖及改善内皮功能等多种效应。既往研究表明,负荷剂量他汀类药物可降低脑卒中发病率[9]。动物实验表明,阿托伐他汀能缩小血脂正常的缺血性脑卒中大鼠脑梗死面积,保护其神经功能,降低其心血管事件发生概率[10]。本研究结果显示,再灌注2、6、24、48、72 h,D组和E组大鼠神经功能缺损评分和梗死体积/大脑总体积低于B组、C组;再灌注72 h,B、C、D、E组大鼠神经元凋亡率高于A组,D组和E组大鼠神经元凋亡率低于B组、C组,提示阿托伐他汀10、20 mg/kg灌胃可有效减轻急性脑缺血/再灌注损伤大鼠神经功能损伤,减少神经元凋亡。
VEGF是一种特异地作用于血管内皮细胞的强有力的多功能细胞因子,亦是目前临床发现的增加血管通透性作用最强的物质之一,其可诱导新生血管形成及血管内皮细胞有丝分裂,对局灶性脑缺血后神经功能恢复具有重要促进作用[11-12]。NO是经细胞膜扩散的气体自由基,生理条件下其可调节血管张力,抑制血管平滑肌细胞、血小板激活因子及血小板聚集,诱导内皮细胞和中性粒细胞黏附;此外,其还在刺激神经元活动、血栓形成及控制脑血流量等方面具有重要作用。NOS是NO内源性合成的关键酶,可影响NO表达。本研究结果显示,再灌注2 h,D组和E组大鼠脑组织VEGF相对表达量高于B组、C组,B组大鼠脑组织NO、NOS含量高于A组;再灌注24、72 h,D组和E组大鼠脑组织VEGF相对表达量高于B组、C组,B、C、D、E组大鼠脑组织NO、NOS含量高于A组,D组和E组大鼠脑组织NO、NOS含量低于B组、C组,提示阿托伐他汀10、20 mg/kg灌胃可有效改善急性脑缺血/再灌注损伤大鼠血管内皮功能,分析其原因可能与阿托伐他汀促进局部脑组织血管新生、减少脑组织氧化应激损伤等有关。
自噬是将细胞内受损、变性、衰老的蛋白质或细胞器运输到溶酶体内并降解的过程,以胞质中出现自噬体作为主要标志。LC3-Ⅱ和Bechlin-1蛋白是哺乳动物自噬相关基因编码产物,二者与B细胞淋巴瘤蛋白2、哺乳动物自噬相关基因编码产物等相互影响而激活细胞自噬,因此LC3-Ⅱ和Bechlin-1蛋白常被认为是自噬标志分子[13-14]。既往研究表明,急性脑缺血/再灌注损伤与血管内皮功能密切相关,而再灌注过程中机体血管内皮细胞直接接触循环血液内高浓度血管紧张素Ⅱ(AngⅡ)而形成大量肿瘤坏死因子α(TNF-α)、白介素1(IL-1)、活性氧(ROS)等炎性因子及细胞内Ca2+,若机体Ca2+超载则血浆内钙调素(CaM)含量升高,钙/钙调蛋白激酶依赖性激酶β(CaMKK-β)激活,AMPK活性增大,磷酸化结节性脑硬化复合物2(TSC-2)而抑制重组人表皮因子(RHE),并经过负反馈抑制mTOR活性,进而激活细胞自噬,因此急性脑缺血/再灌注损伤与自噬密切相关,可通过调节Ca2+/AMPK/mTOR信号通路而促使血管内皮细胞凋亡、坏死,加重病情[15-16]。本研究结果显示,再灌注72 h,B、C、D、E组大鼠脑组织LC3-Ⅱ、Beclin-1、mTOR、AMPK蛋白相对表达量高于A组,D组和E组大鼠脑组织LC3-Ⅱ、Beclin-1、mTOR、AMPK蛋白相对表达量低于B组、C组,提示Ca2+/AMPK/mTOR信号通路可能参与急性脑缺血/再灌注损伤的病理过程,而阿托伐他汀10、20 mg/kg灌胃可通过抑制Ca2+/AMPK/mTOR信号通路激活而减轻自噬对脑组织血管内皮功能的损伤。
综上所述,阿托伐他汀10、20 mg/kg灌胃可有效减轻急性脑缺血/再灌注损伤大鼠神经功能损伤,减少神经元凋亡,改善血管内皮功能,其机制可能与调控自噬相关信号通路Ca2+/AMPK/mTOR有关。
