慢性肾脏病患者动脉僵硬度的相关因素研究
2019-07-15许嵘王跃娟倪杰黄辉宋旭光孙伟李正红
许嵘,王跃娟,倪杰,黄辉,宋旭光,孙伟,李正红
近年来,我国慢性肾脏病(chronic kidney disease,CKD)患病率呈逐年上升趋势,据最新流行病学调查结果显示,我国成年人CKD患病率为10.8%(约1.2亿),且有年轻化趋势[1]。CKD治疗花费大、病死率高,极大地增加了医疗开支及社会负担,已成为全球关注的重要公共卫生问题之一。心血管疾病是CKD患者最常见的并发症及最主要的死亡原因之一[2]。既往研究表明,动脉僵硬度增高是CKD尤其是终末期肾脏病患者心血管疾病发病和死亡的主要预测因子[3],已引起临床关注。超极速超声成像脉搏波(ultrafast ultrasound imaging pulse wave velocity,uf-PWV)技术是评价动脉弹性的新的无创技术,其可通过直接测量局部血管脉搏波传导速度(pulse wave velocity,PWV)而反映血管壁僵硬度[4-5]。本研究采用uf-PWV技术检测PWV并分析CKD患者动脉僵硬度的相关因素,旨在为防治CKD患者发生心血管疾病提供干预靶点。
1 对象与方法
1.1 研究对象 选取2016年1月—2018年6月江苏省中医院肾内科病房收治的CKD患者70例,均符合《KDIGO慢性肾脏病评价及管理临床实践指南》[6]中CKD的诊断标准。纳入标准:(1)年龄>18周岁;(2)未行透析治疗者。排除标准:(1)伴有严重感染者;(2)合并恶性肿瘤者。本研究经江苏省中医院医学伦理委员会审核批准,所有患者对本研究知情并签署知情同意书。
1.2 观察指标
1.2.1 一般资料 收集所有患者一般资料,包括年龄、身高、体质量及血压,并计算体质指数(BMI),BMI=身高/体质量2。
1.2.2 实验室检查指标 记录所有患者实验室检查指标,其中血肌酐(Scr)、尿素氮(BUN)、血红蛋白、空腹血糖、血钙、血磷采用OLYMPUS AU2700全自动生化分析仪进行检测,空腹胰岛素、血清1,25-二羟维生素D3〔1,25-(OH)2D3〕、甲状旁腺激素采用Beckman DXI800全自动微粒子化学发光仪进行检测,24 h尿蛋白定量采用日立704全自动生化分析仪进行检测,并采用CKD-EPI公式估算肾小球滤过率(eGFR)[7],计算稳态模型胰岛素抵抗指数(HOMA-IR),HOMAIR=空腹胰岛素(mU/L)×空腹血糖(mmol/L)/22.5[8]。
1.2.3 PWV 由专人采用AixPlorer彩色多普勒超声诊断仪(法国SuperSonic Imagine公司生产)检测PWV,探头频率4~15 MHz,具体操作如下:患者保持静息平卧位,头部居中,下颌略抬起,行双侧颈动脉常规超声检查,记录颈动脉二维声像图、彩色血流及频谱特征;然后平缓移动探头,不施压,选择颈总动脉管壁清晰平直段,尽量避开内壁斑块区域,嘱患者屏气5 s,图像稳定后切换至uf-PWV成像模式,系统自动描线并测值,保持描线与内膜基本吻合后得到PWV,同一颈总动脉重复测量3次取平均值。
本研究创新点:
与传统脉搏波检测技术不同,超极速超声成像脉搏波(uf-PWV)技术可更加精确地记录脉搏波瞬间通过观察窗的速度。本研究采用uf-PWV技术定量评价慢性肾脏病患者脉搏波传导速度,进而精准评估动脉僵硬度。
1.3 统计学方法 采用SPSS 16.0统计学软件进行数据处理,符合正态分布的计量资料以(±s)表示,组间比较采用两独立样本t检验;CKD患者PWV相关因素分析采用Pearson相关分析及多元线性回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料和实验室检查指标 本组患者年龄(55.8±14.0)岁,BMI为(24.47±4.07)kg/m2,收缩压为(135±18)mm Hg(1 mm Hg=0.133 kPa),舒张压为(79±11)mm Hg,Scr为(187.3±229.0)μmol/L,BUN为(10.86±8.83)mmol/L,血红蛋白为(121.89±23.23)g/L,血钙为(2.26±0.25)mmol/L,血磷为(1.20±0.32)mmol/L,血清1,25-(OH)2D3水平为(29.46±17.84)μg/L,甲状旁腺激素为(90.27±100.69)ng/L,eGFR 为(68.49±42.13)ml•min-l•(1.73 m2)-1,HOMA-IR为(2.01±1.56),PWV为(13.51±9.81)m/s。
2.2 相关性分析 Pearson相关分析结果显示,CKD患者PWV与年龄、收缩压、HOMA-IR呈正相关,与血清1,25-(OH)2D3水平、eGFR呈负相关(P<0.05,见表1、图 1~5)。
2.3 多元线性回归分析 将PWV作为因变量,将表1中有统计学差异的指标作为自变量进行多元线性回归分析,结果显示,年龄和血清1,25-(OH)2D3水平与CKD患者PWV独立相关(P<0.05,见表2)。
3 讨论
PWV是评价大动脉僵硬度的“金指标”[9]。《2003年欧洲高血压防治指南》[10]指出,PWV是心脑血管疾病的独立预测因子,在欧美国家其已被列为常规检测项目。uf-PWV技术是评价动脉弹性的新的无创技术,与传统脉搏波检测技术不同,其是利用超快速瞬时拍照技术实时记录颈动脉内膜线在脉搏波通过瞬时的位移轨迹并进行细致运算,可更加精确地记录脉搏波瞬间通过观察窗的速度,进而评估动脉弹性[11]。国内外研究证实,采用uf-PWV技术检测动脉弹性具有良好的稳定性及可靠性[4]。

图1 年龄与CKD患者PWV关系的散点图Figure 1 Scatter plot for relationship between age and PWV in patients with CKD
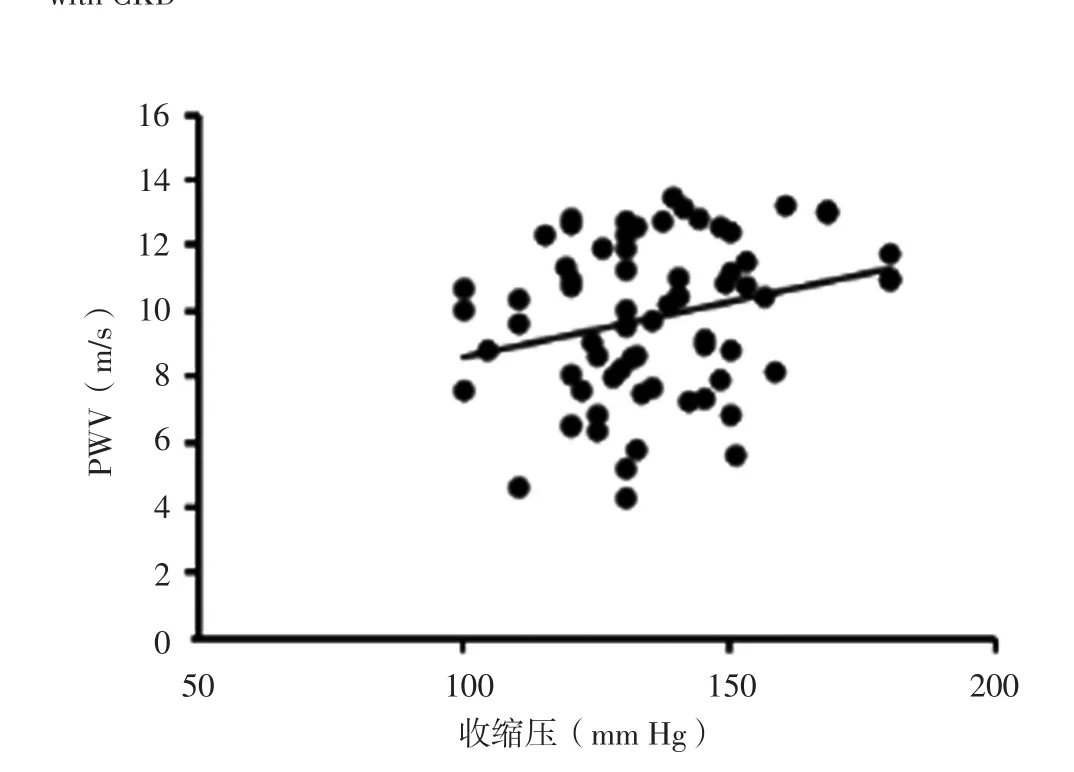
图2 收缩压与CKD患者PWV关系的散点图Figure 2 Scatter plot for relationship between systolic blood pressure and PWV in patients with CKD
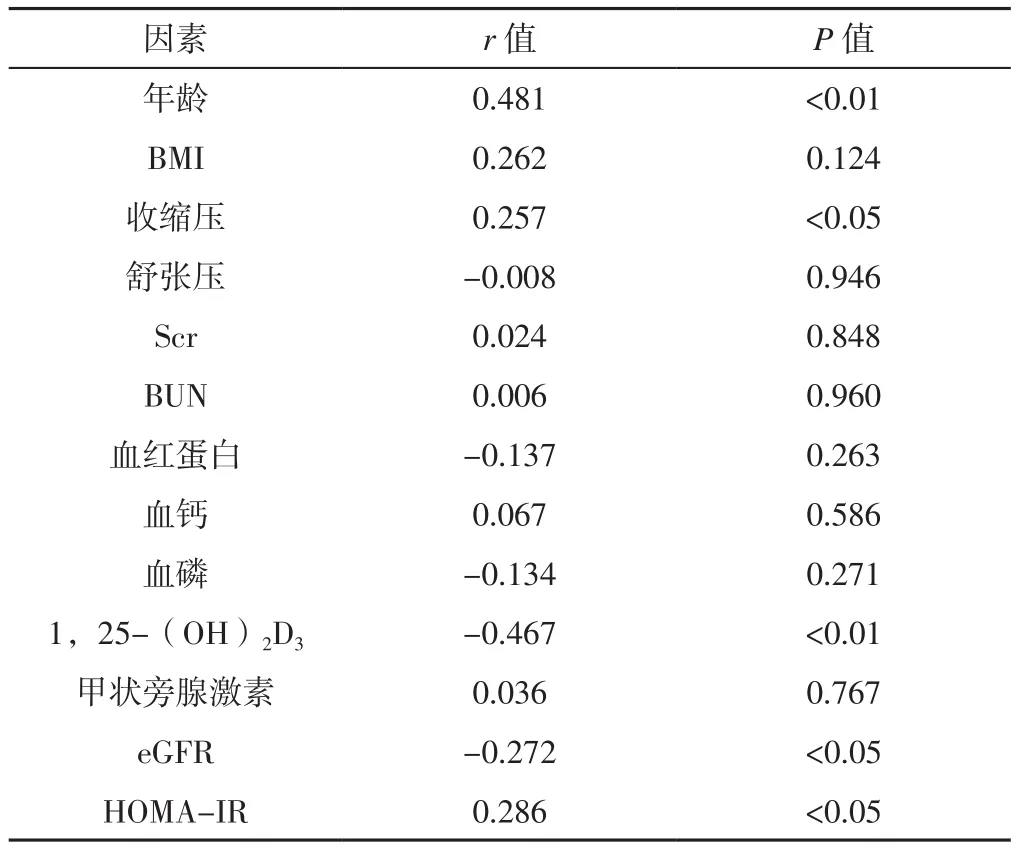
表1 PWV与CKD患者一般资料和实验室检查指标的相关性分析Table 1 Pearson correlation analysis on correlations of PWV with general information and laboratory examination results in patients with CKD
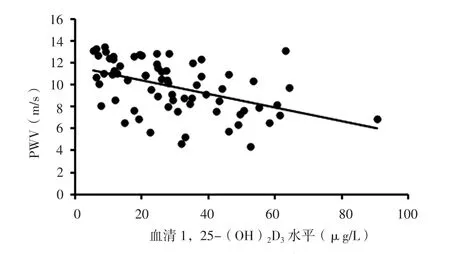
图3 血清1,25-(OH)2D3水平与CKD患者PWV关系的散点图Figure 3 Scatter plot for relationship between serum 1,25-(OH)2D3 level and PWV in patients with CKD

注:eGFR=估算肾小球滤过率
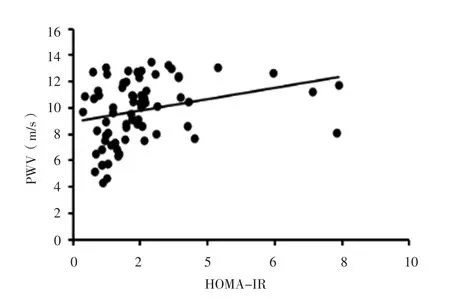
图5 HOMA-IR与CKD患者PWV关系的散点图Figure 5 Scatter plot for relationship between HOMA-IR and PWV in patients with CKD

表2 CKD患者PWV相关因素的多元线性回归分析Table 2 Multiple linear regression analysis on related factors of PWV in patients with CKD
众所周知,高龄是心血管疾病危险因素。本研究结果显示,CKD患者PWV与年龄呈正相关,进一步行多元线性回归分析结果显示,年龄与CKD患者PWV独立相关,提示高龄CKD患者动脉僵硬度增高,并发心血管疾病风险较高,分析其原因主要与随着年龄增长血管壁弹性蛋白、胶原纤维顺应性减退及胶原沉积等有关[12]。既往研究表明,亚洲CKD患者常存在不同程度维生素D缺乏,且维生素D缺乏是心血管不良事件的独立危险因素[13]。动脉僵硬是心血管疾病的独立危险因素[14],故维生素D缺乏与动脉僵硬的关系值得深入研究。本研究结果显示,CKD患者PWV与血清1,25-(OH)2D3水平呈负相关,进一步行多元线性回归分析结果显示,血清1,25-(OH)2D3水平与CKD患者PWV独立相关,提示血清1,25-(OH)2D3水平较低的CKD患者动脉僵硬度较高,分析其原因可能与维生素D调节肾素-血管紧张素系统、改善胰岛素抵抗、抑制血管平滑肌增殖等有关[15]。
既往研究表明,高血压在血管硬化过程中发挥着重要作用,血压升高促使血管壁重构,随着代偿机制失衡而出现纤维蛋白断裂、血管壁脆性增加及僵硬度增高[16-18]。YOON等[19]、AKDAM等[20]研究结果显示,eGFR与PWV呈负相关,即随着eGFR降低,PWV逐渐升高。且近期有研究表明,PWV升高是导致CKD发生和肾功能进行性下降的独立危险因素,其可作为CKD患者进展至终末期肾脏病的独立预测因子[14,21]。CHEN等[22]研究表明,CKD患者常存在不同程度胰岛素抵抗现象。而HOMA-IR作为CKD患者心血管疾病死亡的独立预测因子可能与胰岛素抵抗导致高脂血症、高血压、高尿酸血症、高凝状态等有关[23-24]。本研究结果显示,CKD患者PWV与收缩压、HOMA-IR呈正相关,与eGFR呈负相关,但多元线性回归分析结果未证实上述关系存在。因此,CKD患者动脉僵硬度与收缩压、HOMA-IR及eGFR的关系仍需要进一步研究证实。
综上所述,高龄及血清1,25-(OH)2D3水平较低的CKD患者动脉僵硬度增高,应引起临床重视。但本研究为单中心研究,样本量较小,且横断面研究不能确定因果关系,故研究结果结论仍需联合多中心、扩大样本量进一步证实。
