杜氏盐藻无菌化处理及其对生长的影响
2019-07-12王玲玲刘晓燕马贵范王吝安
王玲玲 刘晓燕 马贵范 王吝安
摘 要:采用药敏试验法、抗生素除菌法、带菌株与无菌株生长比较法,研究了盐藻中杂菌对不同抗生素的敏感性、不同抗生素对盐藻藻株生长的影响、抗生素对盐藻的无菌化处理方式、无菌株和带菌株生长曲线变化。结果表明:200μg·mL-1氨苄青霉素、50μg·mL-1头孢呋辛、400μg·mL-1庆大霉素3种抗生素联合逐次使用,可实现盐藻藻株的无菌化处理,且对藻株生长的影响不显著(P>0.05);带菌盐藻与无菌盐藻在延滞期和指数生长期细胞密度差异不显著,稳定期后无菌藻可以保持较长一段时间的稳定生长,但带菌盐藻细胞密度下降,易下沉老化。
关键词:杜氏盐藻;无菌化;抗生素;比生长率;细胞密度
中图分类号 Q943.1文献标识码 A文章编号 1007-7731(2019)11-0017-5
Abstract:Sensitivity test,antibiotic sterilization and comparison of non-axenic strain and axenic strain growth were used to investigate the susceptibility of hybrid bacteria in Dunaliella salina to different antibiotics,the effect of different antibiotics on the growth of Dunaliella salina strains,the axenation of Dunaliella salina by antibiotics,and the changes in growth curve of non-axenic strains and axenic strains. The results showed that the axenation of Dunaliella salina strains could be achieved by successive use of 200 μg·mL-1 ampicillin,50 μg·mL-1 cefuroxime and 400 μg·mL-1gentamicin,and its effect on the growth of Dunaliella salina strains was not significant. No significant difference was found in the lag phase and exponential phase between non-axenic strains and axenic strains. After the stationary phase,the axenic strains kept the cell density for a period of time,but the cell density of non-axenic strains decreased and were prone to aging.
Key words:Dunaliella salina;Axenation;Antibiotics;growth rate;Cell density
杜氏盐藻(Dunaliella salina)富含蛋白质、天然胡萝卜素等具有特殊生物活性的物质,是目前公认的具有独特经济价值的微藻[1]。盐藻的无菌纯种是研究盐藻生理生态学、分子学等的基础,也是进行遗传工程、盐藻资源开发的关键[2]。在培养过程中,由于藻种常伴有杂菌,而无法准确开展藻-菌相互作用、兼养异养等方面的研究[3]。抗生素可抑制细菌的繁殖,在除菌抑菌方面表现出了强大作用。为此,笔者以抗生素为除菌工具,在实验室条件下[4]研究了不同抗生素对杜氏盐藻无菌处理效果及其对盐藻生长的影响,并获得了无菌杜氏盐藻株系,以期为开展盐藻大规模异养奠定基础。
1 材料
1.1 藻种来源 实验用盐藻筛选分离于山东省荣成市桑沟湾自然水域,经分子鉴定为杜氏盐藻。
1.2 培养基 盐藻培养基采用f/2培养基[5]:其中NaNO3 74.8mg、NaH2PO44.4mg、NaSiO310.0mg、“f/2”微量元素溶液1mL、“f/2”维生素溶液配方1mL,过滤海水1000mL,盐度60‰、pH为8.0、121℃、0.11MPa灭菌20min待用。细菌培养基采用牛肉膏蛋白胨培养基:牛肉膏3g、蛋白胨10g、NaCl5g、琼脂15~20g、纯水1000mL、pH为7.5;121℃、121℃、0.11MPa条件下灭菌20min待用。
1.3 主要试剂 化学试剂硝酸钠、磷酸二氢钠等分析纯试剂,天津科密欧化学试剂有限公司生产;氨苄青霉素、头孢呋辛、麦迪霉素等药敏纸片(执行标准:WS/T125-1999)杭州天和微生物有限公司生产;万古霉素等抗生素购自Sigma公司,参照萨姆布鲁克等[6]法配制抗生素母液,配制的抗生素母液,用0.22μm的玻璃纤维滤膜过滤除菌。
1.4 主要仪器 智能光照培养箱(型号为KGHP-160/E),购自上海百典仪器设备有限公司;电子天平(型号为BS2202S),购自赛多利斯科学仪器(北京)有限公司;高压蒸气灭菌锅(型号为XFH-50CA),购自浙江新丰医疗器械有限公司;可见分光光度计(型号为V-1200),购自翱艺仪器(上海)有限公司。
2 方法
2.1 盐藻培养条件 光照培养箱中培养,设置温度26℃,光暗比12h∶12h,光照強度3000~4000lx,每天振荡2次。
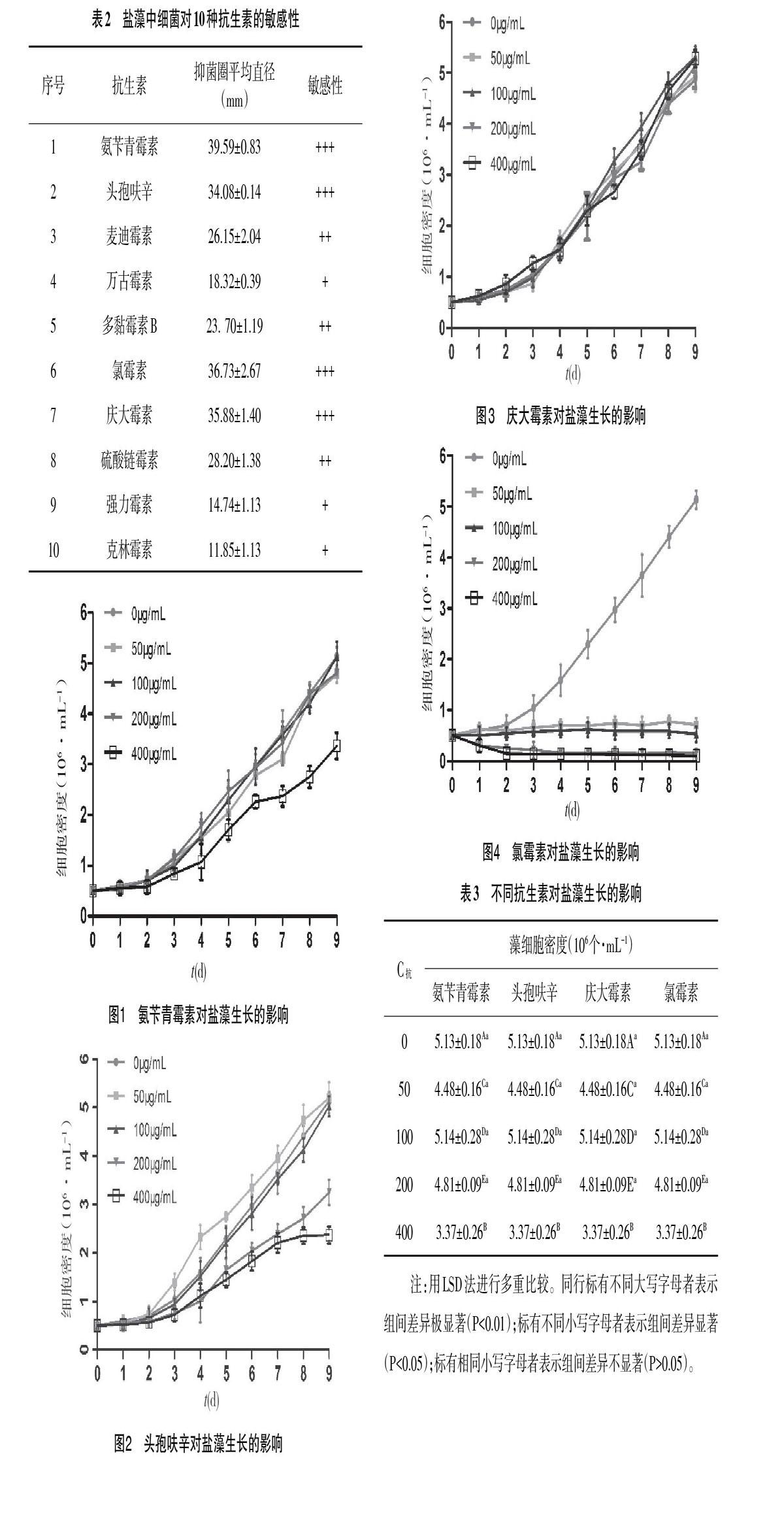
2.2 藻液中细菌对抗生素的敏感性检测 取对数生长期的藻液,1∶10接种到牛肉膏蛋白胨液体细菌培养基中,置于30℃培养箱中进行细菌扩大培。24h后吸取该藻液10μL,涂布于牛肉膏蛋白胨固体培养基表面,采用药敏试验法检测藻液中细菌对氨苄青霉素、头孢呋辛、麦迪霉素、万古霉素、多黏霉素B、氯霉素、庆大霉素、硫酸链霉素、强力霉素和克林霉素10种抗生素的敏感性,每个平板上平贴2个滤纸片,每组设置3个平行平板,30℃培养箱中培养1d,记录抑菌圈的大小,选择抑菌圈大于30mm的抗生素作为除菌工具。
2.3 盐藻对不同抗生素及浓度的敏感性检测 根据药敏试验结果,取抑菌效果较为理想的氯霉素、氨苄青霉素、庆大霉素和头孢呋辛4种抗生素母液按照一定体积加入到150mL盐藻藻液中,使其终质量浓度分别为50、100,200、400μg·mL-1,每组设置3个平行,以未加抗生素的微藻作为对照,培养条件如2.1,培养9d。每天定时记录盐藻的生长密度。
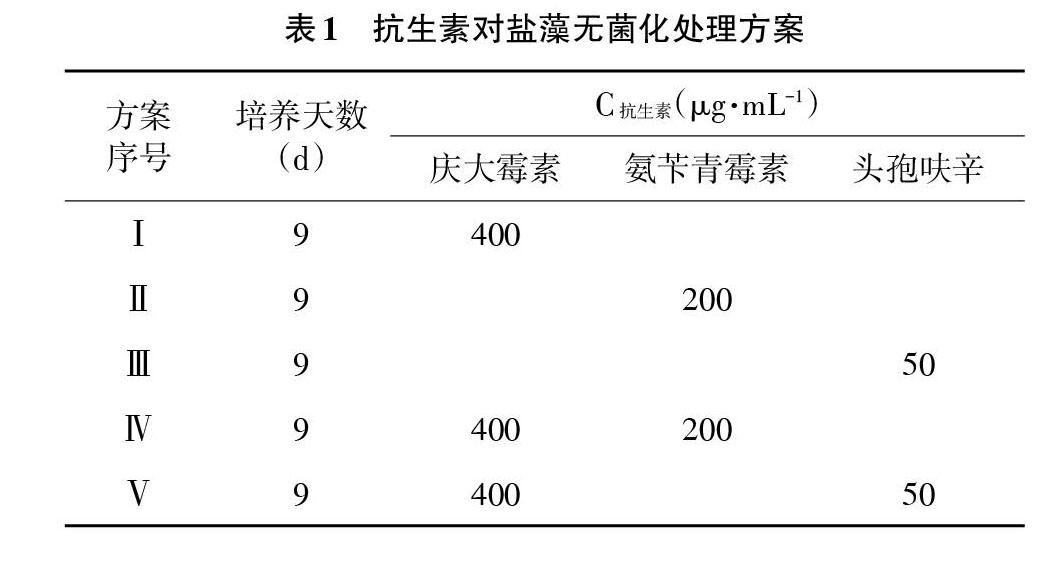
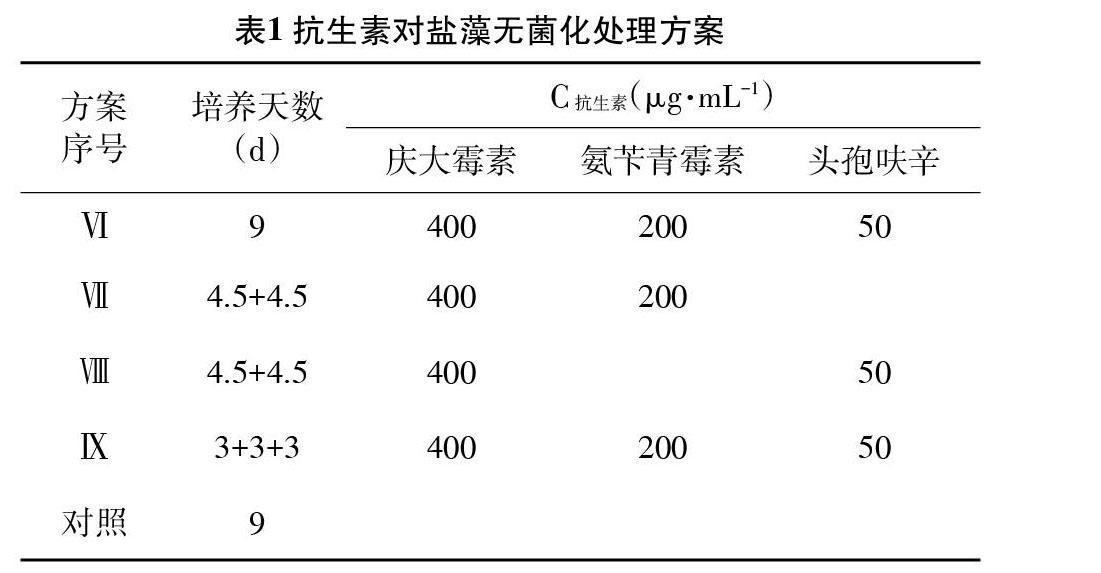
2.4 抗生素单一和联合除菌试验 根据藻液中细菌对抗生素的敏感性和盐藻对不同抗生素及浓度的敏感性实验结果,选取庆大霉素、氨苄青霉素、头孢呋辛3种抗生素按照表1中9种方案对盐藻进行除菌试验,培养条件如2.1,培养9d,每天定时记录盐藻的生长密度;以未加抗生素的盐藻藻液为对照组。
2.5 无菌检测 分别取2.4试验中经过抗生素除菌处理的盐藻藻液10μL涂布于牛肉膏蛋白胨固体培养基表面,置于30℃培养箱中培养1d,观察有无细菌生长。初步认定无菌后,再经3次传代培养(按1∶10的接种量培养于150mL的三角瓶中,每代培养9d),培养条件同2.1,彻底消除残留抗生素影响。再取各组藻液10μL涂布于牛肉膏蛋白胨固体培养基表面,置于30℃培养箱中培养1d,观察有无细菌生长。
2.6 自然带菌藻和无菌盐藻生长曲线比较 取对数生长期的带菌和无菌藻液,接种于150mL的f/2培养基中,接种初始密度均为0.5×106个·mL-1,培养28d,每天定时记录盐藻细胞密度。取样时均遵循无菌操作规则。
2.7 生长情况测定方法
2.7.1 细胞密度的测定 用血球计数板计数盐藻细胞密度,再使用V-1200分光光度计测定相应细胞浓度下的藻液OD630值,绘制吸光度与藻细胞密度的标准曲线。每天测定实验藻液的OD630值,根据标准曲线计算出对应的细胞密度,每个样计3次,取平均数。
2.7.2 比生长速率测定 比生长速率μ=(lnNt-lnN0)/T,其中Nt为培养t天时的细胞数,N0为初始时的细胞数,T为培养时间。
2.8 数据处理 采用SPSS 23.0软件对试验数据进行分析,采用单因素方差分析和LSD多重比较及t检验法,P<0.05表示有显著性差异,P<0.01表示有极显著性差异。
3 结果与分析
3.1 藻液中细菌对抗生素的敏感性 由表2可知,10种抗生素对盐藻藻液中的细菌都有不同程度的抑菌杀菌作用。根据形成的抑菌圈直径的大小,判断盐藻藻液中细菌对抗生素的敏感性从强到弱依次是:氨苄青霉素>氯霉素>庆大霉素>头孢呋辛>硫酸链霉素>麦迪霉素>多黏霉素B>万古霉素>强力霉素>克林霉素。其中,氨苄青霉素、氯霉素、庆大霉素、头孢呋辛药敏纸片上抑菌圈平均直径在30~40mm,麦迪霉素、多黏霉素B、硫酸链霉素药敏纸片上抑菌圈平均直径在20~30mm,万古霉素、强力霉素、克林霉素药敏纸片上抑菌圈平均直径在10~20mm,选取抑菌圈直径>30mm的4种抗生素进一步检验盐藻对其的敏感性。
3.2 盐藻对不同抗生素及浓度的敏感性 根据图1~图4结果可知,不同抗生素种类和质量浓度可以引起盐藻细胞生长密度的不同变化。当头孢呋辛质量浓度50μg·mL-1时,盐藻细胞的生长密度高于对照组;当青霉素质量浓度为50、100和200μg·mL-1时,头孢呋辛的质量浓度为100μg·mL-1时,庆大霉素的质量浓度为50、100、200和400μg·mL-1时,盐藻细胞生长的密度变化与对照组接近;氨苄青霉素的质量浓度为400μg·mL-1时,头孢呋辛的质量浓度200、400μg·mL-1时,氯霉素的质量浓度在50、100、200和400μg·mL-1时盐藻细胞生长密度低于对照组,且氯霉素各浓度组中细胞出现明显的下沉老化现象。
采用单因素方差分析和LSD多重比较法,比较各抗生素各浓度组对盐藻细胞生长密度的影响,结果如表3所示。由表3可知,当氨苄青霉素的质量浓度为50、100和200μg·mL-1时,头孢呋辛的质量浓度50、100μg·mL-1时,庆大霉素的质量浓度为50、100、200和400μg·mL-1时,盐藻细胞的生长密度与对照组差异不显著(P>0.05)。但当头孢呋辛的质量浓度为200、400μg·mL-1时,氯霉素的质量浓度为50、100、200和400μg·mL-1时,盐藻藻株生长缓慢,细胞数呈现下降趋势,盐藻藻株生长则受到明显抑制,且与对照组差异极显著(P<0.01)。
3.3 盐藻的无菌化处理和无菌检测 比较各抗生素处理组中盐藻的生长情况,如图5所示。由图5可知,按照无菌化方案Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅶ、Ⅷ、Ⅸ进行处理,盐藻藻细胞比生长速率与对照组无明显差异(P>0.05),按照无菌化方案Ⅴ进行处理,其比生长速率低于对照组,且与对照组差异显著(P<0.05);按照无菌化方案Ⅵ进行处理,其比生长速率则明显低于对照组,且与对照组差异极显著(P<0.01)。各无菌化处理方案获得的盐藻经3次传代之后,接种于牛肉膏蛋白胨固体培养基上,结果表明,经过无菌化方案Ⅵ、Ⅸ处理,盐藻藻株已无细菌污染,而按照无菌化方案Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅶ、Ⅷ处理仍有细菌存在。综合各方案除菌效果和对盐藻生长的影响,盐藻无菌化处理方案优选无菌化处理方案Ⅸ。
3.4 自然带菌藻和无菌盐藻的生长曲线 比较带菌藻和无菌藻的生长曲线,如图6所示,第1~12d带菌藻与无菌藻生长曲线无明显差异,第1~3d为延滞期,第4d进入指数增长期,第11d进入稳定期;但进入第13d后,带菌藻液细胞数量下降,出现下沉等老化现象,而无菌藻液细胞数量可以保持一段时间的稳定且藻液颜色均匀,未有藻细胞下沉等老化现象。
4 讨论和结论
4.1 无菌化处理中抗生素的选择 抗生素能够有效抑制或杀灭细菌,是微藻无菌化处理的常用方法[7]。抗生素的使用需具备以下2个基本条件,一是具有高效抑菌杀菌活性,二是对微藻细胞毒性低。由于抗生素的抗菌譜存在差异,各微藻液中菌落结构不同,采用抗生素抑制或杀灭藻液中的细菌,在不同藻种以及剂量方面存在差异。郑凌凌[8]等研究表明,使用卡那霉素、庆大霉素、链霉素可以实现对雨生红球藻FACHB-712藻株无菌化处理。周文俊[9]等研究表明,卡那霉素、庆大霉素、链霉素可以完成对球等鞭金藻的无菌化处理。本研究选用了具有不同抗菌机理的氨苄青霉素、庆大霉素、万古霉素等10种抗生素检测对盐藻藻液中细菌的抑制作用,同时为避免抗生素的使用抑制微藻细胞的生长,进行了盐藻藻株对抗生素耐受性实验,最终筛选质量浓度为200μg·mL-1的氨苄青霉素、50μg·mL-1的头孢呋辛和400μg·mL-1庆大霉素作为盐藻无菌化处理的抗生素。
4.2 抗生素使用方法的选择 多种抗生素联合使用具有协同作用,可有效去除藻液中的细菌,获得无菌藻株。李静华[10]等应用多种抗生素组合处理获得波吉卵囊藻的无菌株;黄振华[11]等应用青霉素、庆大霉素等多种抗生素组合也获得了球等边金藻的无菌藻株;Cottrell[12]等认为作用机制的不同可能导致合用抗生素间产生拮抗,因此他们在微藻除菌中采用了逐种抗生素加入法也取得了成功。本研究设计了3种抗生素的单一使用,联合同时及联合逐次3种方式9种方案,结果显示,氨苄青霉素、庆大霉素、头孢呋辛3种联合使用的除菌效果优于单一使用某一抗生素,且逐次使用抗生素可以减少对藻株生长量的影响同时获取无菌藻株。但林伟[13]等研究发现,抗生素逐种加入不能获得无菌的扁藻1040、中肋骨条藻及锥状斯克利普藻,而同样的联合使用可以获取无菌藻株,未发现抗生素对微藻细胞毒性的增强,研究结果的差异可能与抗生素使用的种类和浓度,以及体系中杂菌与藻细胞的相互关系相关。
4.3 抗生素无菌化处理对藻株的生长的影响 抗生素无菌化处理带来的最大改变是微藻生长体系中细菌的数量和种类的改变,菌-藻之间有可能存在着共生、拮抗、互生等相互关系,一方种类和数量的改变会打破原有的平衡,本研究发现,无菌盐藻和带菌盐藻在延滞期和指数生长期,细胞生产密度差异不显著,但到达稳定期后自然带菌盐藻出现细胞密度下降,下沉老化的现象。形成这种现象的机理,有待进一步研究菌-藻之间的关系。
参考文献
[1]周文俊,郑立,韩笑天.微藻异养化培养的研究进展[J].海洋科学,2012,36(2):136-142.
[2]林伟.海洋微藻与细菌相互关系的研究——正负相互作用的几个例证[D].青岛:中国科学院研究生院,2005.
[3]姜思,刘莹莹,佟少明.4种常用抗生素对莱茵衣藻生长及光化学活性的影响[J].生物加工过程,2017,15(2):13-20.
[4]Charles L,Divan and Heinrich K.Schnose. Production of Axenic Gonyaulax Cultures by Treatment with Antibiotics[J].Applied microbiology,1982,44(1):250-254.
[5]成永旭.生物饵料培养学[M].北京:中国农业出版社,2005.
[6]Mbrook J,Fritsch E F,Naniatis T.Molecular Cloning:A Laboratory Manual[M].Beijing:Science Press,1992.
[7]Hyun-Na,Joo and Choul-Gyun Lee.Antibiotics Addition as an Alternative Sterilization Method for Axenic Cultures in Haematococcus pluvialis[J].Journal of Industrial&Engineering Chemistry,2007,13(1):110-115.
[8]郑凌凌,张琪,李天丽,等.雨生红球藻无菌化处理及其对生长和生理的影响[J].福建师范大学学报(自然科学版),2017,33(1):44-50.
[9]周文俊,鄭立,郑明刚,等.海洋微藻的无菌化处理及对其生长特性和生化组成的影响[J].海洋学报,2012,34(6):177-186.
[10]李静红,黄翔鹄,刘慧玲.波吉卵囊藻对抗生素的敏感性及其无菌化培养[J].广东海洋大学学报,2009,29(3):37-41.
[11]黄振华,刘晓娟,胡章喜,等.湛江等鞭金藻对抗生素的反应及无菌化培养[J].生态科学,2007,26(2):120-121,125.
[12]Cang-Guk Choi,Myong-Sook Bae,Chi-Yong Ahn,et al.Induction of axenic culture of Arthrospira (Spirulina) platensis based on antibiotic sensitivity of contaminating bacteria[J].Biotechnology letters,2008,30(1):87-92.
[13]林伟.几种海洋微藻的无菌化培养[J].海洋科学,2000,24(10):4-6.
(责编:张宏民)
