电化学本生反应研究型实验教学探索
2019-07-12郑晓园
应 芝, 郑晓园
(上海理工大学 能源与动力工程学院, 上海 200093)
教学与科研结合是当代教育改革的重要途径[1]。通过传统的课堂理论教学可以传授学生理论知识,比如太阳能和风能转化成电能的原理、如何利用电能从水中制取氢气等。在此基础上,辅以相关的实验教学,加深学生对专业知识的理解和运用。如果能在实验教学中引入学科的前沿内容[2-3],将会有效地拓展学生的科学思维,提高学生的创新能力。
近年来,新能源开发和利用进入快速发展阶段,培养掌握新能源开发与利用技术的工程型、应用型、创新型高级人才迫在眉睫。结合在氢能领域的基础研究经验,设计了适合新能源专业的研究型实验——电化学本生反应基础特性实验。该实验涉及电解原理、溶液组分分析方法等知识,需要学生查阅文献、确定实验方案、摸索实验方法和分析实验结果,有助于提升学生自主学习和科学创新的综合能力。
1 电化学本生反应基本原理
美国GA公司[4]最早提出热化学硫碘(SI)循环水分解制氢,随后得到欧美和日韩国家的广泛关注和研究[5]。SI循环第一步反应即为本生反应[6]:
近年来,日本学者Nomura等[7]提出利用电化学方法实现上述反应。即采用一个电解池,由阳极、阴极和质子交换膜等组成。通电后,阳极液中SO2被氧化成H2SO4,多余氢离子通过质子交换膜进入阴极液,与阴极液中I2还原得到的I-形成HI。阳极和阴极反应如下:
阳极:SO2+2H2O→H2SO4+2H++2e-
阴极:I2+2H++2e-→2HI
上述反应总和就是本生反应,故称该方法为电化学本生反应。此方法使H2SO4和HI分别在电解池两极生成,无需人为进行分离,克服了传统反应方法的不足[8],简化了后续处理流程,有利于提高整个硫碘循环系统热效率[9]。
2 实验系统及设备
实验系统如图1所示,可进行不同电流密度、温度、反应物组分浓度等工况下的电化学本生反应基础实验,研究超恒沸HI溶液的生成特性。该系统主要包括恒压/恒流电源、电解池、阳极液和阴极液储液罐、电解池与储液罐之间的循环回路以及气体管路5部分。
电解池的关键组成包括2个石墨电极与1个质子交换膜,由温控器控温。通过高温循环器和水循环系统对两个双层夹套储液罐进行控温,由磁力搅拌器保证溶液混合均匀。聚四氟乙烯管连接电解池与储液罐,经蠕动泵驱动电解液的循环。管路采用保温棉包裹以避免散热。电源向电池输入恒电流,同时监测电压变化。
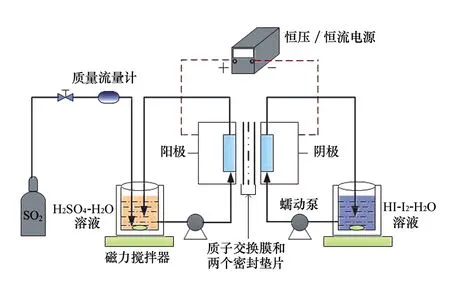
图1 实验系统
3 实验方法
3.1 实验过程
配制阴、阳极电解液,阳极液由硫酸(~98wt%)和去离子水混合而成,阴极液由氢碘酸(~56wt%)、固体碘(纯度>99.9%)和去离子水组成,调节恒温水浴控制溶液温度。以恒定流速持续向阳极液通入SO2气体一定时间后,开启蠕动泵使电解液在电极流道与储液罐之间循环流动。打开恒压/恒流电源,供应电解池恒电流,进行电化学本生反应实验,同时记录电压变化。反应过程中每间隔一段时间对两极溶液分别取样、称重,利用电位滴定法进行组分分析测定,确定两极酸溶液生成的规律。实验结束后使用扫描电子显微镜(SEM)和物理吸附仪(BET)等对质子交换膜作微观表征测试。
3.2 组分测定
电位滴定法是在待测溶液中插入一个指示电极和一个参比电极组成工作电池,缓慢加入滴定剂,与待测物质发生化学反应,导致待测物质浓度持续降低,指示电极的电位发生改变。当待测物质被完全消耗时,电位发生突跃,电位的微分曲线上对应一极值,表明达到滴定终点。根据消耗的滴定剂总量,即可确定待测物质的量。具体的反应如下:
(1) 测定H+浓度
采用标准NaOH溶液(0.5 mol/L)进行酸碱滴定,发生化学反应如下:
H++OH→H2O
(2) 测定I-浓度
在待测液中加入适量稀盐酸,采用标准KIO3溶液(0.05 mol/L)进行氧化还原滴定,发生化学反应如下:
(3) 测定I2浓度
在待测液中加入少量KI溶液使固体碘完全溶解,再利用标准Na2S2O3溶液(0.1 mol/L)进行滴定,发生反应如下:
4 实验结果与讨论
在教师指导下,学生初步开展了该研究型实验,探索了温度对阴极HI和阳极H2SO4生成的影响规律,并表征了质子交换膜的微观特性。
4.1 温度对H2SO4和HI生成的影响
如图2所示,随着电解进行,阳极H2SO4和阴极HI的质量摩尔浓度(以下简称浓度)增大。当温度从303 K提高至323 K时,H2SO4浓度显著降低。这是因为温度提高会降低SO2溶解度,所以SO2的转化率减小[10]。致使生成的H2SO4浓度从5.455 mol/kg降低到5.356 mol/kg。继续提高温度至343 K时,H2SO4浓度反而增大。这又是源于反应温度提高会加快电极反应速率[8],在一定时间内有利于生成更多的H2SO4,使得最终的H2SO4浓度提高到5.530 mol/kg。

图2 不同温度下阳极H2SO4和阴极HI的生成特性
在303 K条件下电解4 h,HI浓度从2.750 mol/kg稳定增加到3.066 mol/kg。当提高温度至323 K和343 K时,电解1 h电极反应速率快,HI浓度迅速上升,但随着水合氢离子大量进入阴极侧,第2 h时HI浓度降低;当电极反应速率与质子传递速率达到平衡时,溶液中的HI浓度继续稳定上升。第4 h电解结束时,在323 K条件下HI浓度最高,为3.193 mol/kg。
4.2 膜的微观特性
质子交换膜在电解池的电解过程中,长时间浸泡在酸溶液中易被腐蚀,且承担着多种物质的传递,其微观物理特性会发生变化,影响使用寿命。 对新Nafion 117膜和反应后的膜进行扫描电镜(SEM)表征,如图3所示。新膜表面光滑透明,如图3(a)所示。电解后的膜出现褶皱,表面沉积固体颗粒物,如图3(b)所示。这主要是因为高分子聚合物过度膨胀,空间生长受限,且在酸溶液中膜发生脱水。此外,膜是通过四周与电池紧密固定,而中间区域与电极之间维持170 μm的间隙,因此膜的四周与中间部分的应力不同,同样使膜表面发生改变。沉积在阴极侧膜上的颗粒物为固体硫,源于从阳极侧渗透到阴极侧的H2SO4与阴极的HI发生的副反应:H2SO4+ 6HI → S + 3I2+ 4H2O,与Nomura等的结论一致[11]。

图3 Nafion 117膜的SEM图
采用BET方法计算得到膜的比表面积。新膜比表面积(0.3969 m2/g)小于电解后的膜表面积(0.4077 m2/g),平均孔径则相反,因为电解后褶皱增大了膜的表面积,而硫堵塞了膜的孔隙。
5 结语
结合前沿学科和课堂理论教学设计了适合新能源专业本科生的电化学本生反应研究型实验,并由学生开展了初步实验。实验结果表明,随着电解进行,阳极H2SO4和阴极HI的浓度均呈上升趋势;提高反应温度可提高电极反应速率,降低SO2溶解度;分别在343 K和323 K时生成最高浓度的H2SO4和HI。电化学反应后的膜出现褶皱且有固体颗粒沉积,造成了比表面积增大和平均孔径减小。该实验教学涉及到电解反应、电位滴定、微观表征等实验内容,巩固了学生的理论知识,锻炼了学生的实验技能、激发了学生的求知欲,提升了学生的创新能力。
