高危型人乳头瘤病毒监测对宫颈病变治疗后的临床价值分析
2019-07-11罗兢蓉
罗兢蓉
【摘要】 目的:探讨高危型人乳头瘤病毒对宫颈病变治疗后监测效果及价值。方法:选择笔者所在医院2015年1月-2018年1月诊治且随访的CIN及宫颈癌I期患者共326例,根据FIGO分期标准,CIN分期:Ⅰ期50例,Ⅱ期38例,Ⅲ期140例,宫颈癌I期98例。使用第二代杂交捕获实验室技术(HC-Ⅱ)对患者进行HR-HPV负荷量的检测。使用薄层液基细胞学技术(TCT)对患者进行细胞学检测。统计和比较CIN-Ⅰ、Ⅱ、Ⅲ和宫颈癌I期的HR-HPV阳性。观察宫颈病变患者经过治疗后HR-HPV转阴情况。结果:(1)CIN-Ⅰ:共50例,术前HPV阳性率40例(80.00%);CIN-Ⅱ:共38例,术前HPV阳性率23例(60.53%);CIN-Ⅲ:共140例,术前HPV阳性率126例(90.00%);宫颈癌-Ⅰ:共98例,术前HPV阳性率83例(84.69%)。统计分析表明,CIN-Ⅰ:治疗后HR-HPV转阴38例(95.00%);CIN-Ⅱ:治疗后HR-HPV转阴20例(86.96%);CIN-Ⅲ:治疗后HR-HPV转阴120例(95.24%);宫颈癌-Ⅰ:治疗后HR-HPV转阴80例(96.38%)。统计分析表明,CIN-Ⅱ和CIN-Ⅲ术前HPV阳性率比较差异有统计学意义(P<0.05),各组间治疗后HR-HPV转阴率比较差异无统计学意义(P>0.05)。结论:对CIN和宫颈癌等宫颈病变的患者进行HR-HPV动态监测,可及时掌握患者的病情变化,从而尽早进行干预,阻断病情继续恶化。持续HR-HPV感染可预示宫颈病变的进展,应当予以高度的重视。
【关键词】 高危型人乳头瘤病毒; 宫颈病变; 治疗后监测; 效果及价值
doi:10.14033/j.cnki.cfmr.2019.07.037 文献标识码 B 文章编号 1674-6805(2019)07-00-02
根据分子生物学研究和现在流行病学报告,病毒感染是直接导致恶性肿瘤的重要原因[1]。根据研究结果,人乳头瘤病毒(HPV)感染是引起妇女宫颈癌的主要病毒[2]。因此,目前许多研究专家都以人乳头瘤病毒与宫颈癌的关系作为主题进行研究[3]。宫颈癌的演变需要经历漫长的过程,同时,癌前病变的疗效会明显高于宫颈癌的疗效。所以,尽早对宫颈癌前病变进行筛查和诊断,能够明显降低宫颈癌的发病率和死亡率。本研究通过对笔者所在医院CIN和宫颈癌Ⅰ期患者的资料进行回顾分析,探讨高危型人乳头瘤病毒对宫颈病变治疗后监测效果及价值,现报道如下。
1 资料与方法
1.1 一般资料
选择笔者所在医院2015年1月-2018年1月诊治且随访的CIN及宫颈癌Ⅰ期患者共326例,均通过病理诊断得到确诊,排除恶性肿瘤、严重的内科病患者。年龄20~69岁,平均(41.50±5.50)岁,根据FIGO分期标准,CIN分期:Ⅰ期50例,Ⅱ期38例,Ⅲ期140例,宫颈癌Ⅰ期98例。
1.2 方法
使用第二代雜交捕获实验室技术(HC-Ⅱ)对患者进行HR-HPV负荷量的检测。使用薄层液基细胞学技术(TCT)对患者进行细胞学检测。其中第二代杂交捕获实验室技术的检测高危HPV基因型共13个。判断标准:光量读数RLU/CO>1.0,则为阳性。术后每隔3~6个月收集患者的宫颈分泌物,首先进行细胞学涂片采样,然后进行HPV检测。留取样本,提高取样的准确程度。当TCT≥ASC或AGC患者,与HPV阳性患者则进行进一步阴道镜检查。通过阴道镜取宫颈异常样本送检,进行病理检查。
1.3 观察指标
统计和比较CIN-Ⅰ、Ⅱ、Ⅲ和宫颈癌I期的HR-HPV阳性。观察宫颈病变患者经过治疗后HR-HPV转阴的状况。
1.4 统计学处理
采用SPSS 20.0统计学软件进行统计分析,计量资料以(x±s)表示,采用t检验,计数资料以率(%)表示,采用字2检验,P<0.05为差异有统计学意义。
2 结果
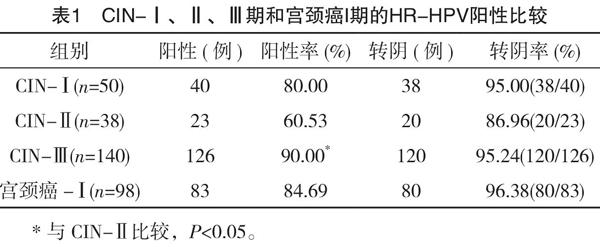
2.1 CIN-Ⅰ、Ⅱ、Ⅲ期和宫颈癌I期的HR-HPV阳性比较
CIN-Ⅰ:共50例,术前HPV阳性40例(80.00%);CIN-Ⅱ:共38例,术前HPV阳性23例(60.53%);CIN-Ⅲ:共140例,术前HPV阳性126例(90.00%);宫颈癌-Ⅰ:共98例,术前HPV阳性83例(84.69%)。统计分析表明,CIN-Ⅱ和CIN-Ⅲ术前HPV阳性率比较差异有统计学意义(P<0.05);其他各组间差异无统计学意义(P>0.05),见表1。
2.2 宫颈病变患者经过治疗后HR-HPV转阴情况
CIN-Ⅰ:治疗后HR-HPV转阴38例(95.00%);CIN-Ⅱ:治疗后HR-HPV转阴20例(86.96%);CIN-Ⅲ:治疗后HR-HPV转阴120例(95.24%);宫颈癌-Ⅰ:治疗后HR-HPV转阴80例(96.38%)。统计分析表明,各组间治疗后HR-HPV转阴率比较差异无统计学意义(P>0.05),见表1。
3 讨论
高危型人乳头瘤病毒是一种导致生殖道感染HPV的病毒。其型号较多,其中常见的型号包括:16、18、6、11型。不同部位感染的HPV型号存在一定差异。低危型HPV包括HPV6和11型,一般感染部位包括感染外阴、肛门、阴道等,多见于湿疣或宫颈上皮内低度病变妇女,和宫颈浸润癌无明显关系。HPV16和18型属于高危型。据统计,HPV16和18型感染率最高,HPV16占50%,HPV18占14%,HPV45占8%,HPV31占5%,其他占23%[4]。宫颈癌病理特征和HPV的型别密切相关。HPV16是导致宫颈鳞状上皮细胞癌的主要型号,而56%腺状上皮细胞癌标本和39%腺鳞细胞癌标本证实在宫颈腺状上皮细胞癌和宫颈腺鳞细胞癌中HPV18为主要的致病病毒型号[5]。早在19世纪,有学者认为HPV感染与宫颈癌相关,此后许多研究充分证实了此观点[6-7]。
宮颈癌是位居第二位的妇女恶性肿瘤,仅次于乳腺癌,根据流行病学报告、生物学研究,HR-HPV感染是导致宫颈癌发病和进展的高危因素[8-9]。HR-HPV感染持续时间超过半年的患者,宫颈癌发病率明显高于其他患者。研究显示持续HR-HPV感染导致宫颈癌的危险度增加250倍[10-12]。CIN和宫颈浸润密切相关。近几年,医学水平得到不断进步,宫颈癌筛查已经非常普及。特别是HR-HPV检测技术,为CIN患者早期发现和治疗提供重要的依据。
本研究选择笔者所在医院2015年1月-2018年1月诊治且随访的CIN及宫颈癌Ⅰ期患者326例进行研究,根据FIGO分期标准,CIN分期:I期50例,Ⅱ期38例,Ⅲ期140例,宫颈癌I期98例。使用第二代杂交捕获实验室技术对患者进行HR-HPV负荷量的检测。使用薄层液基细胞学技术对患者进行细胞学检测。统计和比较CIN-Ⅰ、Ⅱ、Ⅲ和宫颈癌I期的HR-HPV阳性。观察宫颈病变患者经过治疗后HR-HPV转阴的状况。结果显示,CIN-I:共50例,术前HPV阳性40例(80.00%);CIN-Ⅱ:共38例,术前HPV阳性23例(60.53%);CIN-Ⅲ:共140例,术前HPV阳性126例(90.00%);宫颈癌-Ⅰ:共98例,术前HPV阳性83例(84.69%)。治疗后HR-HPV转阴38例(95.00%);CIN-Ⅱ:治疗后HR-HPV转阴20例(86.96%);CIN-Ⅲ:治疗后HR-HPV转阴120例(95.24%);宫颈癌-Ⅰ:治疗后HR-HPV转阴80例(96.38%)。统计分析表明,经过字2检验,各组间治疗后HR-HPV转阴率比较差异无统计学意义(P>0.05)。
由此可见,对CIN和宫颈癌等宫颈病变的患者进行HR-HPV动态监测,可及时掌握患者的病情变化,从而尽早进行干预,阻断病情继续恶化。持续HR-HPV感染可预示着宫颈病变的进展,应当予以高度的重视。
参考文献
[1]张秋敏.阴道微生态与高危型人乳头瘤病毒感染和宫颈病变的关系研究[J].中国现代药物应用,2018,12(15):151-152.
[2]王爽,袁学华,柯盈月,等.阴道微生态异常与高危型人乳头瘤病毒感染及宫颈病变的关系[J].中国微生态学杂志,2018,30(8):959-963.
[3]梅玉枝.高危型人乳头状瘤病毒对评估宫颈环形电刀切除术治疗宫颈上皮内瘤样病变预后的价值[J].湘南学院学报:医学版,2017,19(4):49-50.
[4]颜霞,唐海旭,吴萍.高危型人乳头瘤病毒E6/E7 mRNA联合薄层液基细胞学检测对宫颈癌前病变筛查的临床价值[J].广西医学,2018,40(7):785-787.
[5]刘渝,李力,陈建昆,等.高危型人乳头瘤病毒与鳞状细胞癌抗原对宫颈癌患者术后复发的预测价值[J].第三军医大学学报,2018,40(11):1033-1037.
[6]任美丽.高危型人乳头瘤病毒检测结合宫颈细胞学检查在体检中心的应用[J].中国药物与临床,2018,18(7):1174-1176.
[7]王晓庆,杜凤霞,张洋.宫颈癌前病变筛查中高危人乳头瘤病毒检测的临床应用及其价值分析[J].航空航天医学杂志,2018,29(6):719-720.
[8]张莉.宫颈上皮内瘤变锥切术后患者高危型人乳头瘤病毒清除情况相关因素分析[D].南京:南京大学,2018.
[9]李娅.宫颈高危型HPV感染患者的中医体质、证素分析及中药治疗的文献研究[D].北京:北京中医药大学,2018.
[10] Rodrigo P A,Thalita A S,Diego G M,et al.The human papillomavirus (HPV)-related cancer biology:An overview[J].Biomedicine & Pharmacotherapy,2018,106:21-26.
[11] Mathew G,Marnie B,William A,et al.Staging HPV-related oropharyngeal cancer:Validation of AJCC-8 in a surgical cohort[J].Oral Oncology,2018,84:12-19.
[12] Bywaters S M,Brendle S A,Biryukov J W,et al.Production and characterization of a novel HPV anti-L2 monoclonal antibody panel[J].Virology,2018,524:56-62.
