结核性脑膜炎患者行脑脊液腺苷脱氨酶及其他生化项目检测的临床意义
2019-07-11陈颜强赵立明李薇孟艺哲白洪忠
陈颜强 赵立明 李薇 孟艺哲 白洪忠
结核性脑膜炎(tubercular meningitis,TBM)是由结核分枝杆菌感染引起的脑膜非化脓性炎症反应,是肺外结核常见的类型之一,具有很高的致死率及致残率[1]。TBM诊断的金标准是脑脊液中抗酸杆菌染色阳性或结核分枝杆菌培养阳性[2];但由于其阳性率不高、培养周期长,很容易出现漏诊,在临床应用中受到一定的限制。脑脊液生化检查是简便快速的常用检测方法,对结核性脑膜炎的诊断和预后评估有重要意义。本研究通过观察TBM患者生化指标的特点及动态变化情况,分析其与病情发展的关系,以期为临床诊疗提供依据。
资料和方法
一、一般资料
回顾性分析2011年1月至2014年9月河北省胸科医院收治入院的46例确定诊断和可能诊断[3]的结核性脑膜炎患者,其中男25例、女21例;年龄12~76岁,年龄中位数(四分位数)[M(Q1,Q3)]为33.5(22.0,52.0)岁。分析患者脑脊液生化指标与病情严重程度的关系,以及治疗后指标水平的变化情况。
46例患者中,发热、头痛、恶心呕吐最常见,分别为35、33、12例。11例患者表现为咳嗽咳痰、纳差、大小便失禁等颅外结核症状,包括大小便失禁1例、咳嗽咳痰5例、纳差1例;1例出现咳嗽咳痰+纳差+大小便失禁,2例出现咳嗽咳痰+纳差,1例出现纳差+大小便失禁。其他还有意识不清8例、头晕5例、视物模糊3例、肢体无力2例、抽搐1例、言语不清1例。入院时TBM患者病情严重程度参考英国医学研究会(British Medical Research Council, MRC)分期[4]:Ⅰ期13例,Ⅱ期21例,Ⅲ期12例。47.83%(22/46)患者并发颅外结核,其中8例并发继发性肺结核、8例并发血行播散性肺结核、1例并发关节结核、2例并发继发性肺结核+椎体结核,1例并发血行播散性肺结核+关节结核,1例并发血行播散性肺结核+肾结核,1例并发血行播散性肺结核+继发性肺结核+椎体结核。2例脑脊液抗酸染色阳性,4例结核分枝杆菌培养阳性;5例发现颅外结核病原学证据,包括2例痰抗酸染色阳性、2例痰培养阳性、1例痰涂片和痰培养均阳性;其余患者均为TBM可能诊断[3]。所有患者均给予异烟肼、利福平、吡嗪酰胺、乙胺丁醇抗结核药物治疗,对脑脊液指标异常者[即颅内压>180 mm H2O(1 mm H2O=0.0098 kPa),白细胞计数>5×106/L,氯化物<120 mmol/L,葡萄糖<2.5 mmol/L,蛋白>0.45 g/L]初始治疗时予异烟肼(0.1 g)+地塞米松(5 mg)椎管注药(每周2次)。
二、研究方法
1.TBM诊断标准:采用Thwaites诊断标准[3]。(1)确定诊断:脑脊液检测发现结核分枝杆菌。(2)TBM 可能:满足以下3条要求中的1条或1条以上者:①脑脊液检测以外的标本(如:痰、胸腔积液等)检出结核分枝杆菌;②胸部X线摄影检查发现活动性肺结核表现;③其他肺外结核的临床证据。(3)TBM 可疑:满足以下7条中的4条或4条以上者:①有结核病病史;②脑脊液检验中以淋巴细胞为主;③病史超过5 d;④脑脊液葡萄糖与血浆葡萄糖的比值低于0.5;⑤神志改变;⑥脑脊液外观为黄色;⑦有神经系统的定位体征(如偏瘫、昏迷、癫痫等神经系统受损的表现)。本研究纳入对象为确定诊断和可能诊断的TBM患者,治疗方案均给予常规的H-R-Z-E抗结核药物治疗方案和椎管注药。
2. 脑脊液指标:所有患者入院后均进行了腰椎穿刺术,以收集脑脊液标本送实验室行常规(细胞数、李凡他试验、单核细胞分类、多核细胞分类等)、生化[蛋白(比色法)、氯化物(离子电极法)、葡萄糖(己糖激酶法)、ADA(过氧化物酶法)]、细胞学(瑞吉染色)、抗酸染色(萋-尼染色镜检)、细菌培养(BACTEC MGIT 960)等检查,并且在治疗1、2、4周后进行脑脊液常规、生化、细胞学指标复查。本研究仅对脑脊液生化指标进行统计与分析。
3.病情严重程度分期:根据患者入院时的症状、体征参照MRC分期标准[4]确定TBM分期。Ⅰ期(轻度):意识清楚,无神经功能缺损;Ⅱ期(中度):嗜睡、昏睡,轻度神经功能障碍(如单一颅神经麻痹、肢体瘫痪);Ⅲ期(重度):昏迷,严重的神经功能障碍(多组颅神经麻痹、偏瘫等)。
三、统计学处理
采用SPSS 22.0软件进行数据分析,计量资料进行正态性检验,非正态分布的数据以中位数(四分位数)[M(Q1,Q3)]表示,多个独立样本(不同MRC分期、脑脊液氯化物、葡萄糖、蛋白、ADA)的比较采用Kruskal-WallisH秩和检验;两组间比较采用Mann-WhitneyU秩和检验。多个相关样本(不同治疗时间脑脊液氯化物、蛋白、葡萄糖、ADA)的比较采用Friedman秩和检验;两组间样本比较采用Bonferrroni法秩和检验,均以P<0.05为差异有统计学意义。
结 果
一、脑脊液指标与MRC分期
46例患者入院时的脑脊液指标均有不同程度的异常,具体表现为:脑脊液蛋白波动于0.10~3.38 g/L,M(Q1,Q3)为0.95 (0.56,1.34)g/L,38例(82.61%)升高(正常值>0.45 g/L);氯化物96.00~127.70 mmol/L,M(Q1,Q3)为114.75(103.05,118.55) mmol/L,其中36例(78.26%)降低(正常值<120 mmol/L);葡萄糖1.11~7.50 mmol/L,M(Q1,Q3)为2.14(1.67,2.99) mmol/L,29例(63.04%)低于正常(正常值<2.5 mmol/L);ADA 0.00~23.00 U/L,M(Q1,Q3)为3.50 (2.00,7.25) U/L。不同MRC分期患者脑脊液生化指标情况见表1。
结果显示,仅脑脊液ADA水平随MRC分期增高而明显增高,差异有统计学意义。经不同分期两两比较后发现,Ⅲ期患者脑脊液ADA、氯化物水平与Ⅰ期患者差异明显(U=13.609,P=0.033;U=2.122,P=0.035),虽然患者脑脊液氯化物水平随分期增高而降低,但差异无统计学意义。
二、脑脊液生化指标的动态变化
46例患者经规范治疗后脑脊液生化指标均逐渐好转,表现为在治疗1、2、4周时脑脊液氯化物、葡萄糖(相关性指标,采用Friedman秩和检验)均比入院时明显升高(χ2=34.103、27.642,P值均<0.01),而蛋白、ADA在治疗1、2、4周时均较入院时明显降低(χ2=29.221、26.209,P值均<0.01),呈升高或降低趋势。
从治疗过程看,相较于入院时的各项指标(采用Bonferrroni秩和检验),治疗1周后的各项指标没有明显变化;治疗2周后的各项指标开始有明显变化;在治疗4周时,各项指标水平与入院时差异明显(表2),但与治疗第2周时的氯化物、蛋白、葡萄糖、ADA水平差异均无统计学意义(t=0.413、0.087、0.315、0.467;P=0.750、1.000、1.000、0.495)。与治疗后1周时的脑脊液指标比较,治疗4周时的葡萄糖和氯化物水平明显增高(t=1.033,P=0.001;t=0.880,P=0.006)、ADA水平明显降低(t=0.870,P=0.007),而蛋白水平无明显变化(t=0.587,P=0.175)。
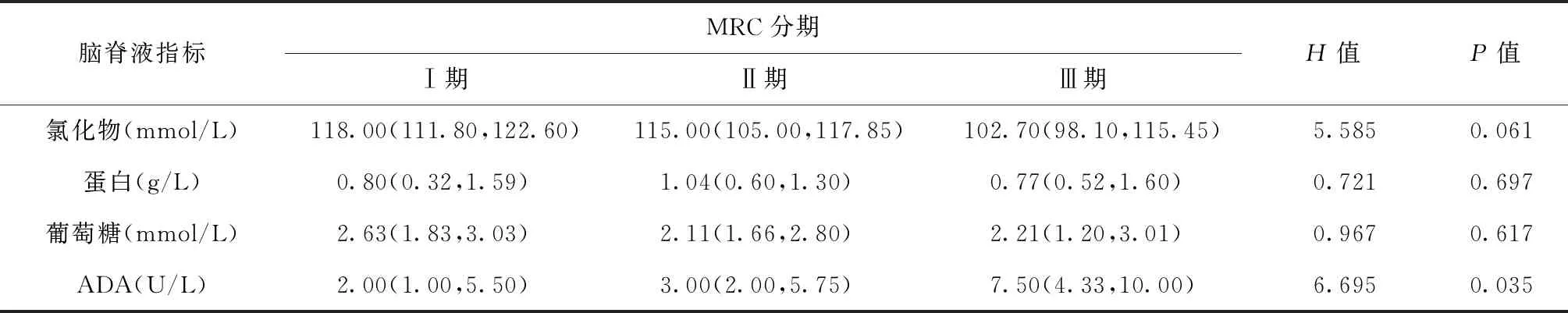
表1 各项脑脊液生化指标在不同MRC分期患者中检测结果的比较
注表中数据为非正态分布,故采用“M(Q1,Q3)”表示; 3组间比较,采用Kruskal-WallisH秩和检验
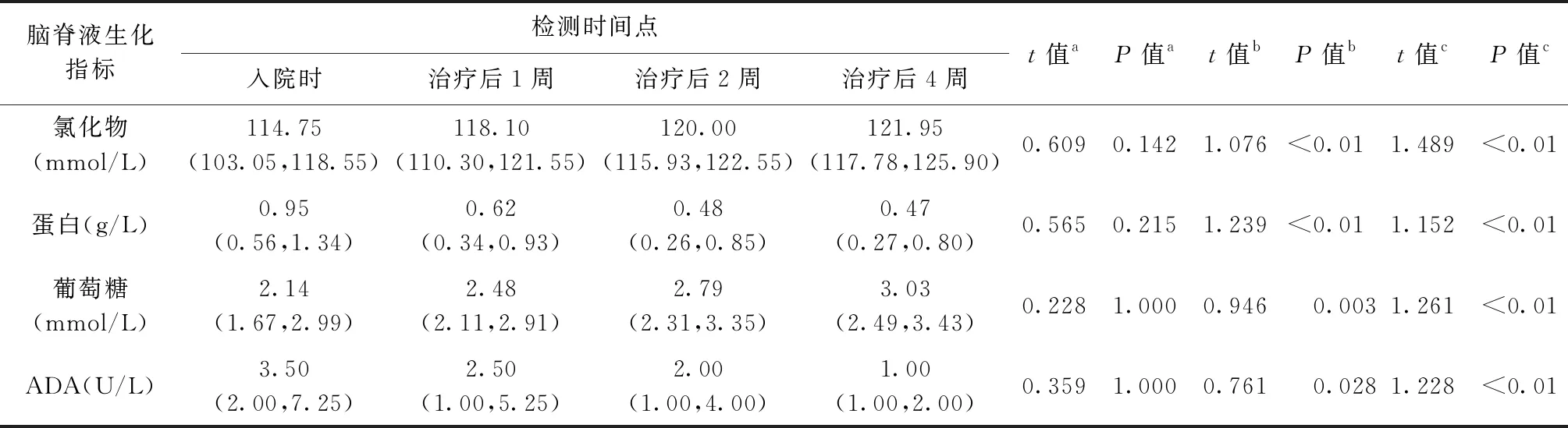
表2 结核性脑膜炎患者脑脊液各项生化指标在治疗前后不同时间点检测结果的比较
注表中数据为非正态分布,故采用“M(Q1,Q3)”表示;a、b、c分别为入院时与治疗后1、2、4周时的比较,采用Bonferrroni法秩和检法
讨 论
TBM约占全部结核感染的1%[5],占肺外结核的5%~10%,是最常见的肺外结核[6],TBM致残率高、预后差,约1/4的患者出现不同程度的神经系统后遗症。TBM是由于结核分枝杆菌侵入蛛网膜下腔,进而侵犯脑神经、脑实质、脑血管等引起的中枢神经系统感染性疾病,Thwaites等[3]依据结核分枝杆菌检测、脑脊液生化检验、临床症状提出TBM的诊断标准,并分为确定、可能性大和可疑3种不同水平。
一、 TBM的临床表现
TBM好发于青年患者,越来越多的患者早期临床症状不典型[7],缺乏特异性,常见发热、头痛、恶心、呕吐等中枢神经系统受损症状,当表现为意识不清、癫痫时应考虑脑损伤严重,提示重症TBM;本研究中有23.91%(11/46)的患者表现为咳嗽咳痰、纳差、大小便失禁等颅外结核症状,影响了TBM的早期诊断,容易出现临床误诊或漏诊。另外,结核感染可侵犯身体多个组织系统,故TBM患者常并发其他部位结核,本研究中约47.83%(22/46)的患者出现颅外结核,以肺结核多见,提示应注意筛查TBM患者其他部位有无结核感染,以免出现临床漏诊。TBM临床MRC分期取决于患者意识状态及神经功能损伤严重程度[4],是评估病情严重程度的重要指标,MRC分期高是患者预后不佳的危险因素[6]。
二、脑脊液细菌学检测
近些年脑脊液细菌学检测方法不断增多[8],检测水平不断提高,脑脊液抗酸杆菌及结核分枝杆菌培养、结核分枝杆菌核酸扩增试验(nucleic acid amplification test,NAAT)阳性成为诊断TBM的金标准[2]。
1.抗酸染色:虽然玻片离心改良抗酸染色法的阳性率约为60%[9],较传统萋-尼抗酸染色明显提高,但抗酸染色阳性并不能诊断结核病,也不能证明结核感染为致病状态还是潜伏感染[10]。本研究采用涂片抗酸染色,其检出率仅有4.3%(2/46),可能与传统抗酸染色易受试管离心法的影响,获取结核分枝杆菌菌量少,且染料不易进入细胞内,导致阳性率低有关。
2.结核分枝杆菌培养及PCR:结核分枝杆菌培养条件要求高、培养周期长,阳性率仅为28%左右[11],不利于早期临床诊断,本研究中痰菌培养阳性率为8.70%(4/46),明显低于上述文献,可能与脑脊液标本量少、收集方法不正确等有关;PCR是新的检测技术,检测时间短,其检测敏感度为31%~100%,特异度为66%~100%[8],可为临床快速诊断提供依据,但检测费用高。综上,TBM的早期诊断是一直存在的难题。
三、脑脊液ADA检测
ADA广泛存在于人体内各组织中,以T淋巴细胞含量最多,与T细胞的分化、增殖密切相关[12]。结核分枝杆菌突破血脑屏障感染中枢神经系统后,引起以细胞免疫为主的免疫应答,T细胞快速增殖、分化,并不断释放各种炎症因子,进而出现炎症、渗出现象,同时脑脊液中的ADA含量也随之增高,因此ADA是TBM诊断的特异性指标[13]。本研究发现,MRC分期Ⅲ期患者的脑脊液ADA水平明显高于Ⅰ期患者,提示脑脊液ADA含量的高低与患者的病情(临床分期)相关,病情严重的患者脑脊液ADA的含量更高。但是,随着治疗时间的延长,脑脊液ADA含量表现为逐渐降低,这与国内外其他学者的研究一致[14-15],说明在TBM患者中ADA含量存在动态改变,随着患者病情逐渐好转,ADA也逐渐下降。
四、脑脊液生化检查
脑脊液生化检查是最常用的临床检测方法,TBM患者入院后常规行腰椎穿刺术,留取脑脊液标本行常规、生化检查。由于结核分枝杆菌侵入中枢神经系统,引起以细胞免疫反应为主的脑膜炎症反应,可出现脑脊液蛋白含量升高、葡萄糖及氯化物含量降低的典型改变[16]。本研究发现,约80%的患者脑脊液蛋白升高、氯化物降低,63%的患者脑脊液葡萄糖含量低于正常,部分患者脑脊液生化指标无异常,考虑与TBM脑脊液表现不典型[17]、临床症状轻[18]有关;另外,脑脊液中葡萄糖和氯化物的水平也受到血液中葡萄糖、氯化物含量的影响[19],故当患者并发糖尿病或存在电解质紊乱时,会影响到脑脊液中葡萄糖、氯化物水平的测定,因此在行脑脊液检验时同时检测血液中葡萄糖和氯化物含量有助于判断脑脊液葡萄糖及氯化物的改变是否为TBM的原发改变[2]。
随着治疗时间的延长,脑脊液生化指标表现呈蛋白逐渐下降、葡萄糖及氯化物逐渐升高的动态变化[19]。本研究显示,治疗1周后的脑脊液生化指标与入院时相比差异无统计学意义,而治疗2周及4周后脑脊液生化指标均有改变,表现为脑脊液蛋白下降,葡萄糖和氯化物升高,且治疗4周后的葡萄糖及氯化物水平高于治疗1周后,但治疗2周的生化指标与治疗4周无明显差异,提示脑脊液生化指标的改变在治疗2周后最明显,其后随着治疗时间的延长,变化越来越不明显。本研究还发现,随着治疗时间的延长,脑脊液蛋白含量逐渐下降,葡萄糖、氯化物逐渐升高,而后慢慢恢复至正常范围,这与国内其他学者的研究一致[18-19]。虽然多项研究发现,年龄、MRC分期、脑积液指标水平是影响TBM患者预后的主要因素[20-22],但在治疗过程中,通过观察脑脊液指标的动态改变,有助于帮助临床医生判断患者病情变化。
综上所述,TBM患者临床表现缺乏特异性,常并发其他部位结核,容易出现误诊、漏诊,对疑似TBM的患者要详细询问病史,完善脑脊液检查等,早期识别诊断并给予正规有效治疗。脑脊液ADA检测可以为评估患者病情严重程度提供参考,动态监测脑脊液生化指标有助于了解病情变化,评估治疗效果,为进一步治疗提供意见。
