狐尾藻营养活性成分的研究
2019-07-10全天秀李祖明白志辉
李 倩,全天秀,李祖明,*,白志辉
(1.北京联合大学生物化学工程学院,北京 100023;2.中国科学院生态环境研究中心,北京100085)
目前全世界普遍关注因水体富营养化导致的环境问题[1]。肥料、污水和工业废水等污染物排放,导致水体营养供应增加,尤其是氮(N)和磷(P),其会引起水体富营养化,严重影响水质,对社会和经济产生影响[2]。因此越来越多研究者开始关注富营养化水体治理[3]。目前治理富营养化水体方法有物理、化学、生物等修复手段,其中生物修复能耗少、投资少、运转费用低、效率高、无二次污染,可实现原位修复和控制污染物,能够与绿化环境及生态景观改善相结合,实现生态修复最大效益,近年来受到国内外广泛关注[4]。
人工湿地是一种模拟自然系统并经过人工强化的净水系统,因成本低,管理容易而广泛用于富营养化水体治理中[5]。生物膜上的生物世代时间长,生物量大,在载体上富集有脱氮和脱磷微生物的生物膜可用于净化富营养化水体[6]。生物膜法以其效率高和运行成本低等优点被常用于污水的有机物去除及脱氮、脱磷工艺,其对缓解当前水体富营养化和废水处理设施用地紧张等问题有积极作用,拥有较大的发展潜力。
水生植物狐尾藻具适应环境能力强、生长速度很快、耐污染能力强、浅沟湿地生长良好、能显著降低废水中氮(N)和磷(P)等营养物浓度、低成本、效果好、维护需求少等优点,其生长迅速,产生大量地上生物量,具有作为食品、饲料、有机肥料、生物材料和生物能源潜力[7,9],被广泛应用于包括富营养化水体在内各种废水修复和净化,在湿地系统净化富营养化水体中发挥重要作用[7,9]。狐尾藻通过根系从底泥吸收氮、磷和通过茎、叶从水中吸收氮、磷相结合来提高氮、磷的吸收,在富营养化水体中,狐尾藻有多种养分吸收途径来提高氮和磷的去除能力[7],然而若不及时收获和资源化利用,其凋落物分解会使同化的氮和磷又释放到环境中[7-8]。
另外,狐尾藻还可通过协同微生物的消化和反硝化作用去除铵氮[10],其开发有利于未来对废水营养循环和生物质资源化高效利用进行优化集成,拓展其在食品及其它领域的高附加值化利用,实现环境保护、资源化高效利用和经济效益有机结合[7-10]。
本文分别检测了狐尾藻组和狐尾藻结合生物膜组处理富营养化水体后狐尾藻的营养活性成分的含量,考察狐尾藻中主要营养活性成分的含量及其变化,以期将狐尾藻中营养活性成分研究开发为高附加值的功能食品提供理论和实践指导。
1 材料与方法
1.1 材料与仪器
绿狐尾藻、绿狐尾藻结合生物膜 由中国科学院亚热带农业生态研究所长沙农业环境观察站开慧基地提供;16种单个氨基酸标准品(固体,纯度≥98%)、混合氨基酸标准溶液 美国Aladdin试剂公司;十一碳酸甘油三酯、混和脂肪酸甲酯标准品、单个脂肪酸甲酯标准品 美国Merck公司;微量元素标准品元素贮备液(1000或10000 mg/L):钾、钙、镁、铁、锰、锌 采用经国家认证并授予标准物质证书的单元素或多元素标准贮备液,国家标准物质中心;茚三酮溶液、乙酸锌、亚铁氰化钾、乙酸镁、无水硫酸钠、氯化钠、柠檬酸钠、硫酸氢钠、盐酸 均为优级纯,北京化工厂;焦性没食子酸、苯酚、三氯化硼甲醇溶液(浓度为15%)、正庚烷、异辛烷、乙腈 均为色谱纯,上海吉至生化科技有限公司。
人工湿地污水处理中试系统 位于长沙市长沙县金井镇,由中国科学院亚热带农业生态研究所长沙农业环境观察站建立;2300定氮仪、Soxtec2055全自动索氏提取仪 德国福斯;FIWE纤维素测定仪 意大利VELP;L-8900氨基酸分析仪 日本日立;SX2-4-10箱式电阻炉 上海一恒;ICAP-7400电感耦合等离子体发射光谱仪(ICP-OES)、ICS-3000离子色谱仪 美国赛默飞;10A-VP高效液相色谱仪 日本岛津;GC-2010气相色谱仪 日本岛津;UV-1700PC紫外可见-分光光度计 上海奥析。
1.2 实验方法
1.2.1 净化方法 在中国科学院亚热带农业生态研究所长沙农业环境观察站人工湿地污水处理中试试验系统开展富营养化水体净化实验。选取狐尾藻组(A组)、狐尾藻结合生物膜组(B组)来考察两种不同净化方法处理富营养化水体后绿狐尾藻主要营养活性成分含量的变化。狐尾藻组(A组)指实验单元中只种植狐尾藻,用狐尾藻处理富营养化水体。狐尾藻结合生物膜组(B组)指实验单元中不仅种植狐尾藻,而且分布有生物膜,生物膜采用聚丙烯纤维填料,长度为70 cm,生物膜挂膜采用自然挂膜,将生物膜材料系挂于网架上;该实验单元综合采用狐尾藻和生物膜来对富营养化水体进行净化[11]。
1.2.2 原料处理 将两种净化方法处理富营养化水体后的绿狐尾藻洗净后用食品级保鲜膜封装,放入食品冰箱-20 ℃冷冻24~48 h后进行冷冻干燥,然后用小型高速粉碎机将冻干样品粉碎、100目过筛,再用食品级保鲜袋封装后存放于4 ℃冰箱备用。水分含量测定采用鲜样,其余营养活性成分含量测定均采用干样,试验3次重复。
1.2.3 基本营养成分含量测定 水分含量测定采用冷冻干燥法,参照GB 5009.3-2010《食品中水分的测定》;灰分含量测定采用GB 5009.4-2016《食品中灰分的测定》(第一法);粗纤维含量测定参照GB/T 5009.10-2003《植物食品中粗纤维的测定》测定,结果以干样计;蛋白质含量测定采用微量凯氏定氮法(N×6.25),参照GB 5009.5-2016《食品中蛋白质的测定》;粗脂肪含量测定参照GB/T 5009.6-2016《食品中脂肪的测定》,采用索氏提取法。
1.2.4 氨基酸含量测定 氨基酸组成及含量测定根据GB 5009.124-2016《食品中氨基酸的测定》测定氨基酸的种类和含量。
1.2.5 脂肪酸含量测定 脂肪酸组成和含量测定参照GB 5009.168-2016《食品中脂肪酸的测定》来检测脂肪酸的组成和含量测定,结果均以干样计。
1.2.6 矿物元素含量测定 矿物质含量测定采用电感耦合等离子体发射光谱法,参照GB 5009.268-2016(第二法)《食品安全国家标准食品中多元素的测定》测定矿物质的含量。
1.2.7 可溶性糖与B族维生素含量测定 可溶性糖含量测定参照GB 5009.8-2016(第一法)《食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》;维生素B1含量测定参照GB 5009.84-2016《食品中维生素B1的测定》(第一法)检测,结果以干样计;维生素B2含量测定参照GB 5009.85-2016《食品中维生素B2的测定》(第一法)检测,结果以干样计;维生素B6含量测定参照GB 5009.154-2016《食品中维生素B6的测定》(第二法)检测,结果以干样计。
1.2.8 总黄酮含量测定 总黄酮含量测定参照《保健食品检验与评价技术规范》(2003)方法来检测,结果以干样计。
1.3 数据分析
试验3次重复,试验数据采用Graph Pad Prism 5进行处理和显著性分析。
2 结果与分析
2.1 基本营养成分
狐尾藻组(A组)和狐尾藻结合生物膜组(B组)处理富营养化水体后狐尾藻中各营养成分含量见表1所示。由表1可知,处理后狐尾藻的水分、灰分和粗纤维含量均分别高于92.00%、124.00 mg/g和13.00%,且B组略高于A组,但差异不显著。狐尾藻粗蛋白含量为18.00 g/100 g左右,且A组显著高于B组;粗脂肪含量均高于2.00 g/100 g,A组极显著高于B组。狐尾藻生长在水中,含水量较高,接近93%,这与Ando等[12]报道相似。狐尾藻中粗纤维含量略高于13.00%,这与文献[7]报道相似。Zhao等[13]发现富含膳食纤维的饮食改善了糖尿病人的肠道菌群,选择性地促进一组产短链脂肪酸细菌的富集,这组菌的丰度和多样性越高,血糖改善越好。狐尾藻粗蛋白含量较高,约为18.00 g/100 g,这与文献[7,14]报道相似。这也进一步说明狐尾藻对环境中氮吸收能力强,转化为自身蛋白含量较高。目前膳食纤维和蛋白质类功能食品是食品领域普遍关注的焦点之一,可将狐尾藻中的蛋白质和纤维素分别提取出来,分别制成蛋白质和膳食纤维用于食品领域的研究开发,制备高附加值功能食品,为狐尾藻在功能食品领域的高附加值资源化开发利用提供数据支持。
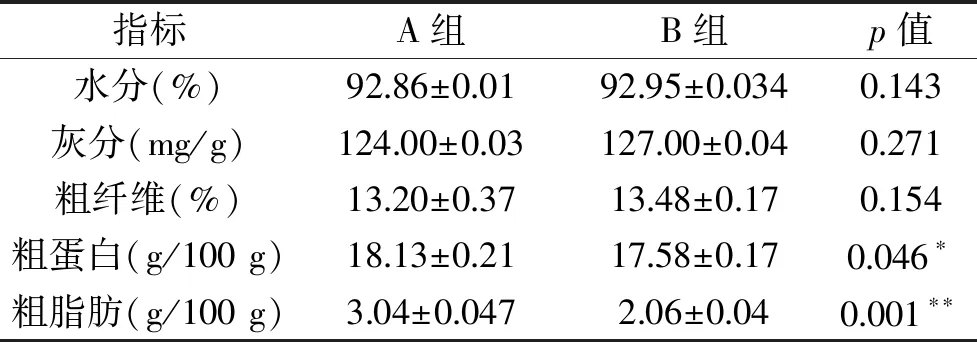
表1 净化方法对狐尾藻基本营养成分的影响
2.2 氨基酸含量
氨基酸组成是食品营养价值可靠指标,蛋白质营养价值高低取决于必需氨基酸含量和组成比例[15]。A组和B组狐尾藻含有全部18种氨基酸,总氨基酸含量分别为13.39和13.28 g/100 g,如表2所示。总体上,除天冬氨酸外,对于同一种氨基酸含量,A组略高于B组,但差异不显著。8种人体必需氨基酸除蛋氨酸和色氨酸外含量较高,必需氨基酸分别占总游离氨基酸的33.91%和30.80%。狐尾藻亮氨酸、赖氨酸、缬氨酸和精氨酸含量较高,天冬氨酸含量未见报道[7],这与本文中结果不完全一致。根据FAO/WHO建议的理想蛋白模式,必需氨基酸/总氨基酸的比值在40%左右的蛋白质质量较好[16]。狐尾藻中氨基酸含量较高、组成较合理,可为人体提供较为全面的氨基酸,这有利于将狐尾藻研究开发为高附加值化多肽类功能食品。
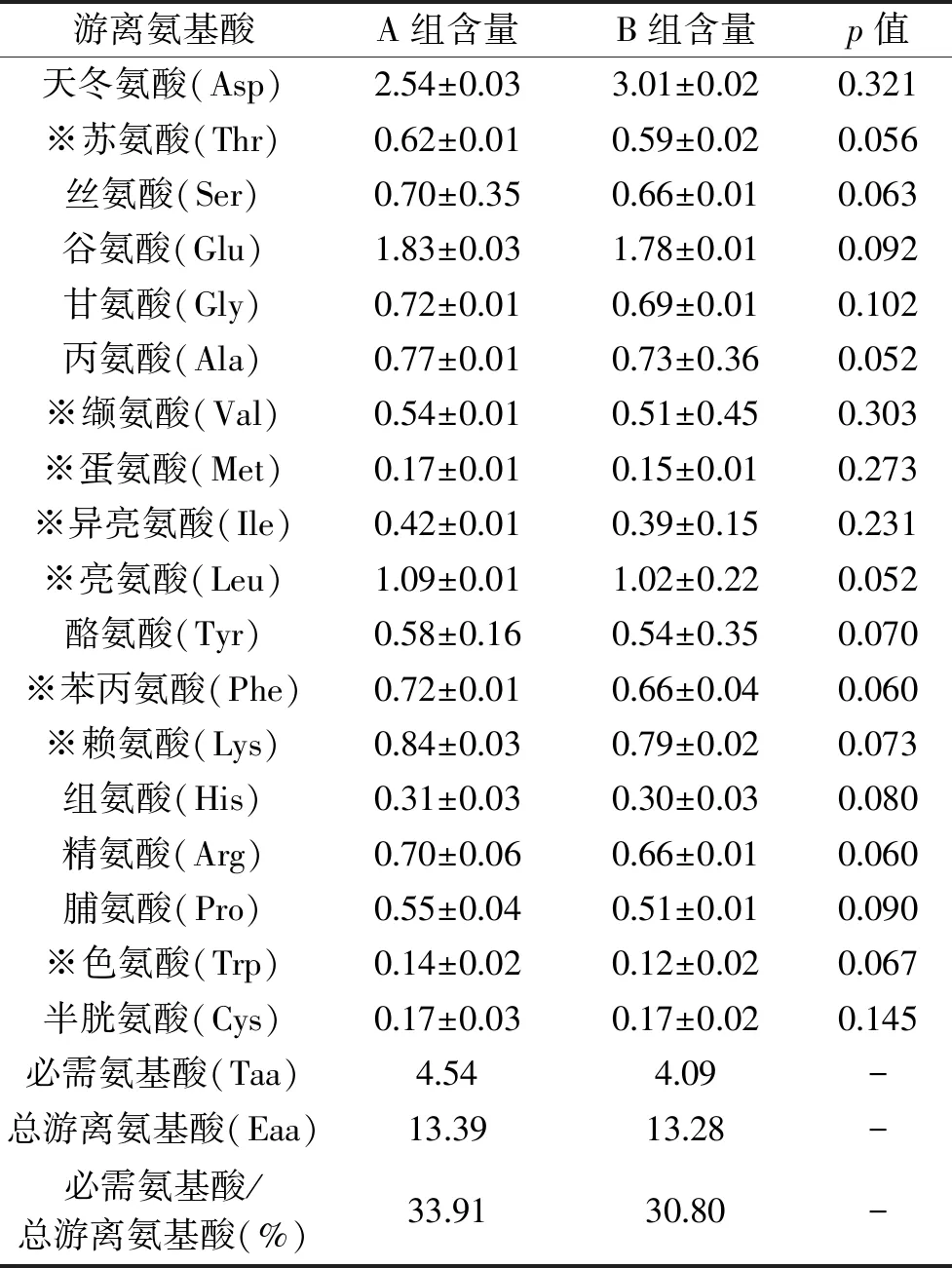
表2 净化方法对狐尾藻氨基酸含量的影响(g/100 g)
2.3 脂肪酸含量
脂质是机体主要能量贮存分子和能量来源之一,也是细胞膜结构和功能重要物质基础,特别是多不饱和脂肪酸是生物体繁殖和生长所必需的,因此脂质含量及种类也是评价食品营养重要指标之一[17]。A组和B组狐尾藻脂肪酸组成相似,α-亚麻酸和二十一碳酸含量差异显著,其余均不显著,如表3所示。A组和B组狐尾藻棕榈酸、亚油酸、α-亚麻酸含量较高,其总和分别占总脂肪酸含量92.39%和89.89%。
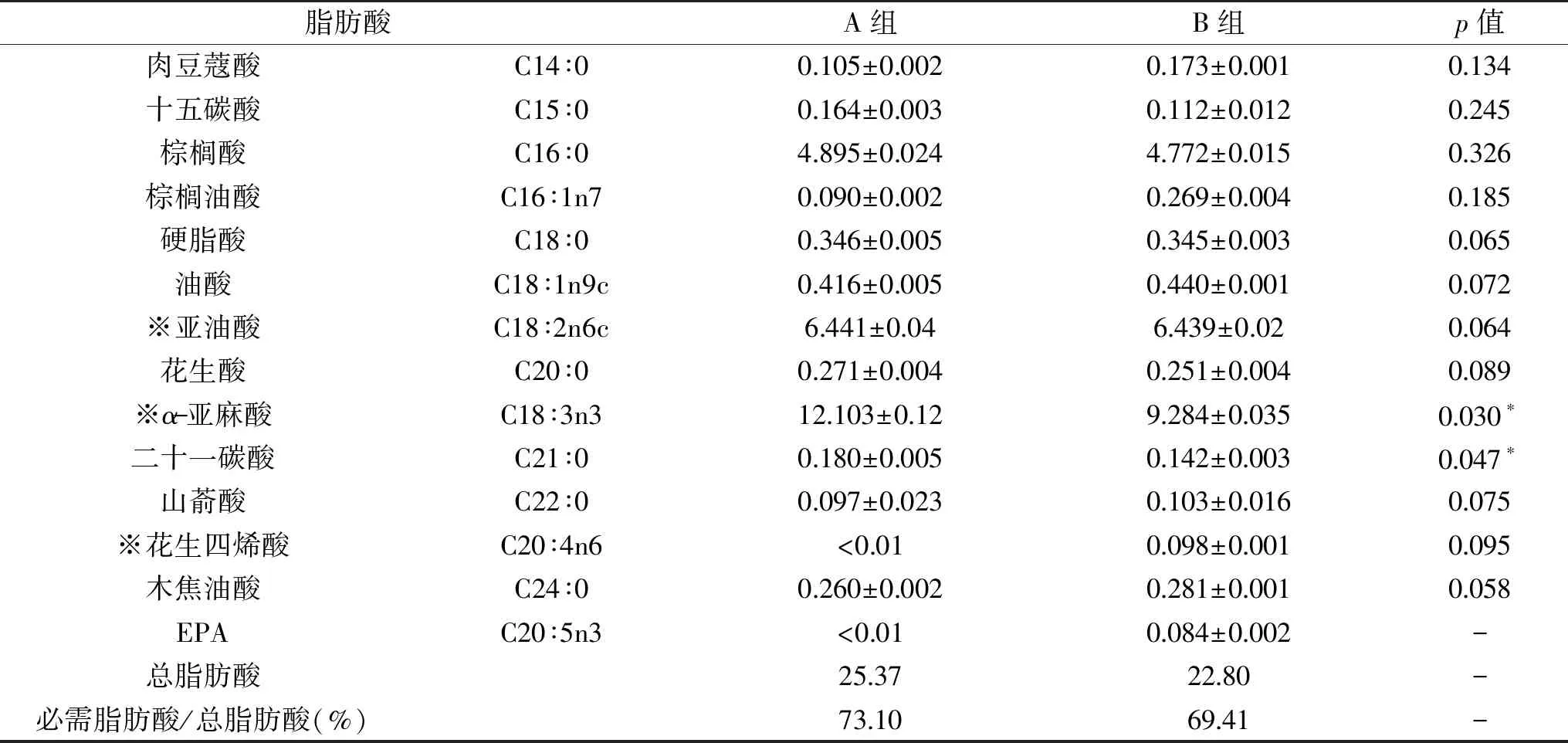
表3 净化方法对狐尾藻脂肪酸含量的影响(mg/g)
必需脂肪酸含量较高,其总和分别占总脂肪酸73.10%和69.41%;α-亚麻酸含量最高,分别为(12.103±0.12)和(9.284±0.035) mg·g-1,分别占必需脂肪酸总和65.27%和58.68%。狐尾藻必需脂肪酸含量较高,含量最高的α-亚麻酸又是构成细胞膜和生物酶基础物质,在人体和动物健康中发挥重要作用;α-亚麻酸在体内还可转化为DHA、DPA、EPA等[18]。狐尾藻可在食品中补充必需脂肪酸,其中高含量的α-亚麻酸可提出出来制备功能食品,拓展其资源化利用范围。
2.4 矿物元素含量
A组和B组绿狐尾藻矿物元素中钙、钾、锰、镁含量较高,A组略高于B组,如表4所示;钙含量最高,分别为(20.735±0.389)和(15.430±0.547) mg·g-1,这与文献[19]相似。钙和锰含量差异显著,其余不显著。钙是人体所不可或缺的微量元素,是人体内最丰富的矿物质,参与人体整个生命过程。从骨骼形成、肌肉收缩、心脏跳动、神经以及大脑的思维活动、直至人体的生长发育、消除疲劳、健脑益智和延缓衰老等等。镁在人体中的重要性和钙不相上下,是人体细胞内第二重要的阳离子,几乎参与人体所有的新陈代谢过程。锰在人体中的作用是非常重要的,它不仅可以促进人体骨骼的正常发育,也可维持正常脑功能[20]。故狐尾藻可在食品中补充一定量的矿物元素,其中较高含量的钙可制成钙制剂补充人体所需钙,促进人体健康。

表4 净化方法对狐尾藻矿物元素含量的影响(mg/g)
2.5 可溶性糖与B族维生素含量
A组和B组狐尾藻中麦芽糖、乳糖和维生素B1含量极少,小于检出限,如表5所示。果糖、葡萄糖和蔗糖含量较高,A组略高于B组;果糖含量最高,分别为(27.00±0.15)和(19.30±0.10) mg·g-1,差异显著;葡萄糖和蔗糖含量差异不显著。维生素B族中VB6、VB2分别为(5.30±0.06)和(4.50±0.12)、(1.48±0.45)和(1.44±0.002) mg·(100 g)-1,A组略高于B组,差异不显著。VB6是人体和动物某些辅酶组成成分,参与多种代谢反应,尤其与氨基酸代谢密切相关[21]。狐尾藻中可溶性糖可供给机体能量,B族维生素可用于食品补充维生素,它们均有利于人体健康。

表5 净化方法对狐尾藻可溶性糖含量及B族维生素含量的影响
2.6 总黄酮含量
黄酮类功能食品是目前功能食品领域研究的热点之一;黄酮类化合物是多酚类植物次生代谢产物,具抗氧化、抗过敏和免疫调节活性等多种生物活性[22]。A组和B组狐尾藻中总黄酮含量分别为(31.81±0.049)和(21.75±0.058) mg·g-1,A组总黄酮含量显著高于B组,如表6所示。狐尾藻中黄酮类化合物可经过提取和分离制备生物活性物质,并深入研究开发为黄酮类功能食品,可应用于功能食品领域,提高其资源化利用附加值。
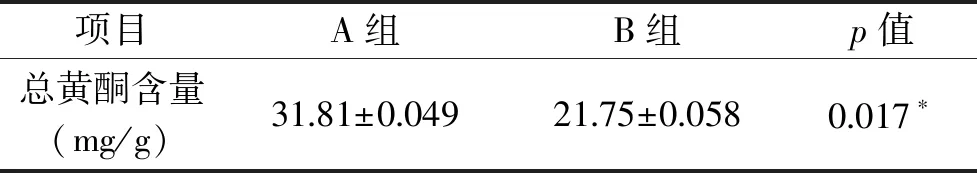
表6 净化方法对狐尾藻总黄酮含量的影响
3 结论
经本文研究表明,狐尾藻组和狐尾藻结合生物膜组处理富营养化水体后狐尾藻中主要营养活性成分含量发生了一定的变化。总体上,对于相同组分含量狐尾藻组略高于狐尾藻结合生物膜组。两组在粗蛋白、粗脂肪、α-亚麻酸、二十一碳酸、钙、锰、果糖和总黄酮含量差异显著,而在水分、灰分、粗纤维、氨基酸、棕榈酸、亚油酸、VB6、VB2含量差异不显著。狐尾藻含有种类较齐全的营养活性成分,可将其中含量较高的纤维素、蛋白质、α-亚麻酸、钙和黄酮等提取分离出来,深入研究开发为具有不同保健功能的高附加值功能食品,拓展狐尾藻的应用领域,实现环境保护、资源化高效利用和经济效益有机结合。可见,狐尾藻在功能食品领域的资源化利用前景十分广阔。
