秀珍菇鲜味菇液酶解制备工艺优化
2019-07-09方若思吴安琰顾宇婷陈咨豪项雅丽楚秉泉肖功年刘士旺龚金炎
方若思 吴安琰 顾宇婷 陈咨豪 李 坚 项雅丽 楚秉泉 肖功年 刘士旺 龚金炎
(1. 浙江科技学院生物与化学工程学院,浙江 杭州 310023;2. 浙江省农产品化学与生物加工技术重点试验室,浙江 杭州 310023;3. 浙江省农业生物资源生化制造协同创新中心,浙江 杭州 310023)
食用菌含有丰富的氨基酸等呈味物质,鲜味独特,因此调味料开发是其深加工的重要方向。国内外采用食用菌提取物提味增鲜,但工艺简单,食用菌来源单一[1]。秀珍菇脂肪含量较低,蛋白质含量丰富,氨基酸种类齐全,其中必需氨基酸含量在35%以上[2-3],还含有活性多糖、黄酮等成分[4-6]。但关于酶解法提取秀珍菇有效成分的工艺研究较少,陈雅平等[7]以氨基酸利用率为主要评价指标酶解秀珍菇,通过单因素试验和正交试验,最佳酶解条件为复合风味酶用量0.5%,酶解时间120 min,酶解温度50 ℃,pH值8.5,秀珍菇氨基酸利用率为27.9%;李佳佳等[8]以秀珍菇干粉为原料,利用生物酶解和美拉德反应技术制备具有菌菇特征风味的调味核心基料,以还原糖含量和挥发性风味物质为指标,确定纤维素酶和中性蛋白酶的最佳酶解条件,在此条件下制备的秀珍菇酶解液水解度为13.75%。利用秀珍菇与其他菌类复配的食用菌调味菇液的研究则未见报道,国外研究主要集中在秀珍菇的主要功能及相关生物活性、营养成分的鉴定分离纯化及开发等方面[8-9];而国内研究则主要集中在生物学特性、褐变保鲜、功能成分提取及活性等方面[10-11]。
海鲜菇是一种药食两用的珍稀菌[12-13],氨基酸含量丰富,含有对人体有益的黄酮和酚类等营养成分,具有抗炎症、抗氧化等功能[14-16]。香菇营养丰富,含有如多糖、香菇嘌呤、氨基酸等多种有效成分,香菇多糖的抗病毒,抗肿瘤以及调节免疫功能突出[17]。灰树花味道鲜美,营养丰富,抗肿瘤多糖、多酚、酮类和甾类的含量可观,具有抗肿瘤、免疫调节、平衡营养成分等特殊药理作用[18-19]。
为均衡营养、提高活性成分含量,协调不同食用菌的功能,本试验拟以秀珍菇为主要原料,辅以海鲜菇、香菇和灰树花3种食用菌,探索不同配比的食用菌在纤维素酶和蛋白酶复配的酶解条件下,优化制取高氨基酸含量的食用菌调味菇液的工艺条件,以期为秀珍菇等食用菌综合开发利用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
秀珍菇、海鲜菇、香菇、灰树花:缙云县珍稀食用菌专业合作社提供;
秀珍菇、海鲜菇、香菇、灰树花在50~70 ℃下烘干8 h、磨成粉末,装在封口袋中放置于阴凉干燥处保存。
1.1.2 试剂
抗坏血酸:生物试剂,纯度>98%,广东省化学试剂工程技术研究开发中心;
茚三酮:生物试剂,纯度>98%,国药集团化学试剂有限公司;
醋酸、正丙醇、正丁醇、乙二醇:分析纯,上海凌峰化学试剂有限公司;
硫酸:分析纯,衢州巨化试剂有限公司。
1.2 仪器与设备
高速离心机:TG18K型,长沙东旺实验仪器有限公司;
高速多功能粉碎机:RHP-600型,浙江荣浩工贸有限公司;
凯氏定氮仪:UDK 159型,上海人和科学仪器有限公司;
电热鼓风干燥箱:GZX-9076 MBE型,上海博迅实业有限公司医疗设备厂;
紫外可见分光光度计:UV 5500PC型,上海元析仪器有限公司。
1.3 方法
1.3.1 工艺流程
各食用菌按比例混合→加水溶解→调节pH→纤维素酶酶解4 h→调节pH→蛋白酶酶解→灭酶→离心→鲜味菇液
1.3.2 食用菌蛋白质含量测定 凯氏定氮法。参照GB/T 5009.5—2003《食品中蛋白质的测定》,采用VELP UDK159自动定氮仪测定。
1.3.3 酶解工艺的优化
(1) 食用菌配伍比例:取3.333 g(料液比1∶15 g/mL)不同食用菌配伍比(见表1)食用菌干粉,加入50 mL去离子水充分溶解,调节pH至5.0,加入0.04%纤维素酶,摇匀,于50 ℃水浴酶解4 h,调节pH至7.0,加入0.1% 蛋白酶,摇匀,再置于50 ℃水浴酶解5 h。酶解结束后,水解液在100 ℃下加热灭酶10 min,7 000 r/min离心15 min,取适量上清液20倍稀释后备用。
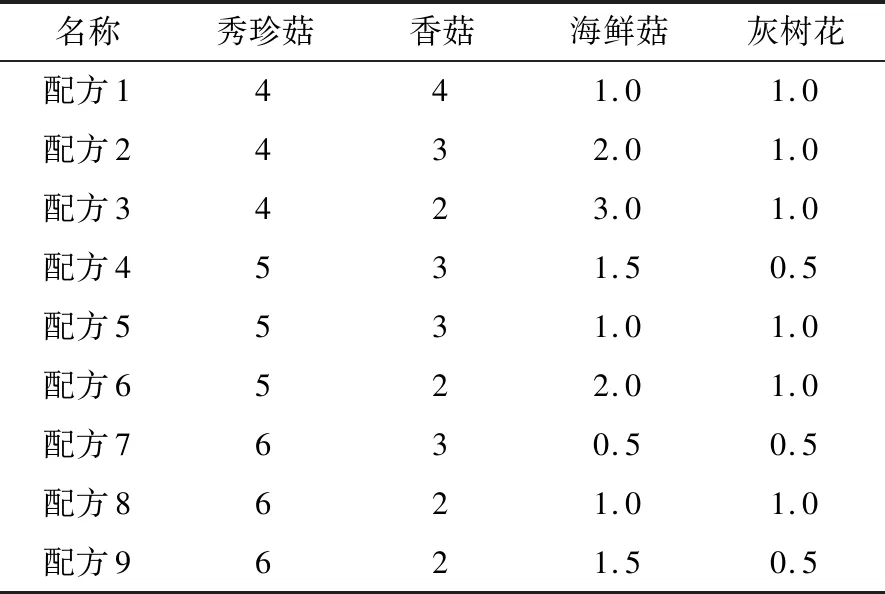
表1 食用菌配伍质量比例
(2) 料液比:取秀珍菇∶香菇∶海鲜菇∶灰树花质量比为5∶3∶1∶1的食用菌干粉,以料液比1∶10,1∶15,1∶20,1∶25 (g/mL),按1.3.2(1)所示方法,考察料液比对水解度的影响。
(3) 蛋白酶酶解温度:取秀珍菇∶香菇∶海鲜菇∶灰树花质量比为5∶3∶1∶1的食用菌干粉,按1.3.2(1)所示方法,加入蛋白酶摇匀后,分别于30,35,40,45,50,55 ℃ 的水浴酶解5 h,考察蛋白酶酶解温度对水解度的影响。
(4) 蛋白酶酶解时间:取秀珍菇∶香菇∶海鲜菇∶灰树花质量比为5∶3∶1∶1的食用菌干粉,按1.3.2(1)所示方法,加入蛋白酶摇匀后,分别于50 ℃水浴酶解0.5,1.0,3.0,5.0,7.0 h,考察蛋白酶酶解时间对水解度的影响。
(5) 纤维素酶酶解pH值:取秀珍菇∶香菇∶海鲜菇∶灰树花质量比为5∶3∶1∶1的食用菌干粉,分别调节纤维素酶酶解pH至4.0,4.5,5.0,5.5,6.0,6.5,7.0,按1.3.2(1)所示方法,考察纤维素酶酶解pH值对水解度的影响。
(6) 蛋白酶酶解pH值:取秀珍菇∶香菇∶海鲜菇∶灰树花质量比为5∶3∶1∶1的食用菌干粉,加入50 mL去离子水充分溶解,调节pH至5.0,加入0.021 3 g 纤维素酶,摇匀,于50 ℃水浴酶解4 h,分别调解pH至6.0,6.5,7.0,7.5,8.0,加入0.053 3 g蛋白酶,摇匀,于50 ℃水浴酶解5 h。随后加热灭酶并离心,取适量上清液20倍稀释后备用。
(7) 纤维素酶添加量:取秀珍菇∶香菇∶海鲜菇∶灰树花质量比为5∶3∶1∶1的食用菌干粉,按1.3.2(1)所示方法,分别加入0.02%,0.04%,0.10%,0.20%,0.40% 纤维素酶,考察纤维素酶添加量对水解度的影响。
(8) 蛋白酶添加量:取秀珍菇∶香菇∶海鲜菇∶灰树花质量比为5∶3∶1∶1的食用菌干粉,按1.3.2(1)所示方法,分别加入0.02%,0.04%,0.10%,0.20%,0.40% 蛋白酶,摇匀,考察蛋白酶添加量对水解度的影响。
1.3.4 测定项目及方法
(1) 游离α-氨基态氮测定:取待测液1.0 mL,去离子水1mL,水合茚三酮3.0 mL(0.6 g重结晶的茚三酮用15 mL 正丙醇、30 mL正丁醇、60 mL乙二醇及9 mL pH 4.54的醋酸盐缓冲液溶解),0.1%抗坏血酸溶液0.1 mL,混匀,封口。沸水浴加热15 min后冷却,加入14.9 mL的60%乙醇溶液,摇匀,于570 nm测定吸光度。
标准曲线的绘制:分别取5 μg/mL精氨酸氨基酸标准溶液0.0,0.2,0.4,0.6,0.8,1.0 mL至6个25 mL容量瓶中,分别加水补充至2.0 mL,加水合茚三酮3.0 mL,加抗坏血酸溶液0.1 mL(质量分数0.1%),混匀,封口,在沸水浴中加热15 min,取出用冷水快速冷却至室温,定容,摇匀,静置15 min,加入14.9 mL的60%乙醇溶液,摇匀,于570 nm波长下,以空白试剂为参比测定各溶液吸光度A,以氨基酸质量浓度为横坐标,吸光度A为纵坐标,绘制标准曲线。
(2) 水解度的测定:水解度指游离α-氨基态氮占总氮的百分比,按式(1)计算:
(1)
式中:
c——水解度,%;
m1——游离α-氨基态氮质量,g;
m2——总氮质量,g。
2 结果与分析
2.1 食用菌蛋白质含量测定
由表2可知:秀珍菇蛋白质含量(19.958 g/100 g)最高,其次为灰树花(蛋白质含量约14.128 g/100 g),再次为海鲜菇(蛋白质含量为12.852 g/100 g),香菇蛋白质含量最低(12.719 g/100 g)。因此,选择以秀珍菇为主要原料,配合香菇、海鲜菇和灰树花的食用菌干粉为研究对象。
2.2 游离α-氨基氮标准曲线的绘制
以精氨酸标准液质量为横坐标,吸光值为纵坐标,绘制得到的标准曲线,回归方程为y=0.037 3x-0.009 3,相关系数为R2=0.989 9,结果如图1所示。
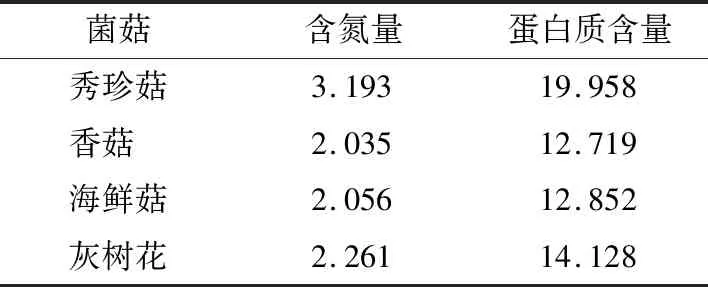
表2 各菌菇的含氮量及蛋白质含量(干基)
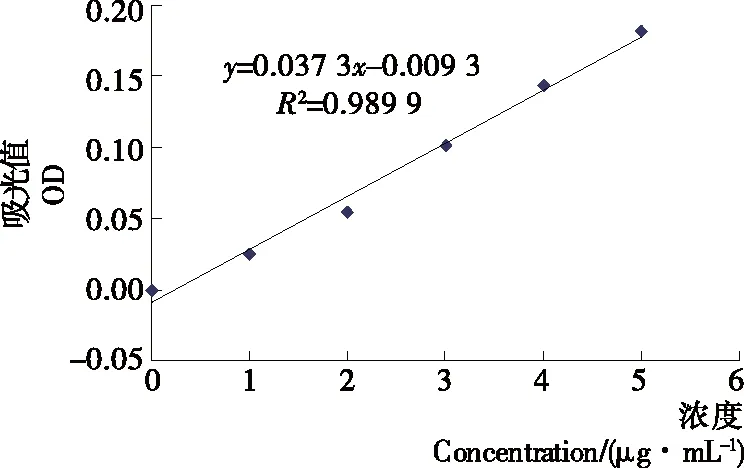
图1 α-氨基氮标准曲线
2.2 单因素最佳酶解条件确定
2.2.1 食用菌配伍比例对水解度的影响 蛋白质含量高的菌菇,其组分含量越高,水解度就越大,秀珍菇的蛋白质含量最大。由图2可以看出:随着秀珍菇组分含量的升高,水解度增大,秀珍菇∶香菇∶海鲜菇∶灰树花=6.0∶3.0∶0.5∶0.5时,水解度达到最大值为16.987%,此时氨基酸占总氮含量的比重最大,说明在该条件下,酶解产生的游离氨基酸含量最高。因此,确定该配比为最佳配比。
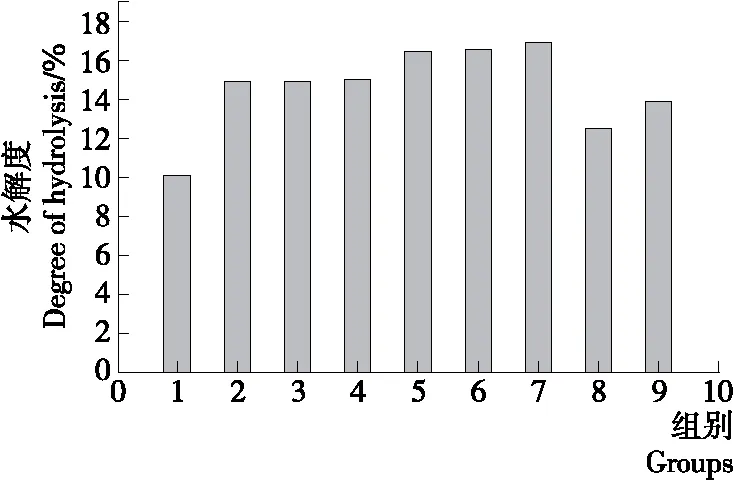
图2 组分比对水解度的影响
2.2.2 料液比对水解度的影响 由图3可知:当料液比为1∶15(g/mL)时,水解度达到最大值为16.463%,此时氨基酸占总氮含量的比重最大,说明在该条件下,酶解产生的游离氨基酸含量最高。因此,确定该料液比为最佳。
2.2.3 蛋白酶酶解温度对水解度的影响 蛋白酶酶解温度是影响蛋白酶活性的重要因素。如图4所示,在30~40 ℃时水解度随着温度的升高而大幅增大,温度达到40 ℃ 时样品蛋白质的水解度达到最大值17.939%,当温度从40 ℃继续上升到60 ℃时水解度逐渐下降,酶解温度对水解度的影响较大。因此,选定40 ℃为蛋白酶酶解的最适温度,进入下一步试验。
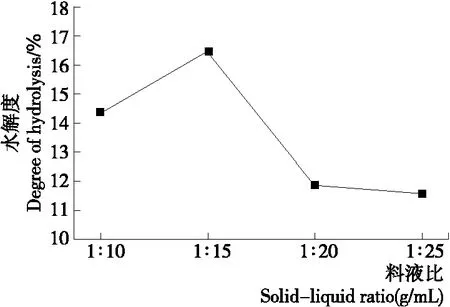
图3 料液比对水解度的影响
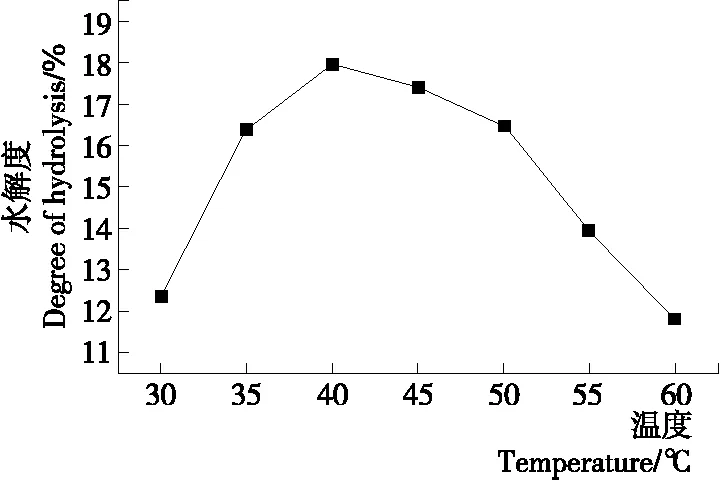
图4 蛋白酶酶解温度对水解度的影响
2.2.4 蛋白酶酶解时间对水解度的影响 由图5可知,酶解0.5~5.0 h时,随时间的延长,水解度逐渐增大,且在3~5 h时增幅最大,酶解5 h后增幅减缓。故后续试验选择蛋白酶酶解时间为5 h。
2.2.5 纤维素酶酶解pH值对水解度的影响 pH值可影响底物和纤维素酶的稳定性。由图6可知:随着pH的增大,水解度逐渐增大,当pH达到5.5时水解度达到最大值17.470%,之后水解度呈现明显的下降趋势。因此,选择纤维素酶酶解pH为5.5为最佳。
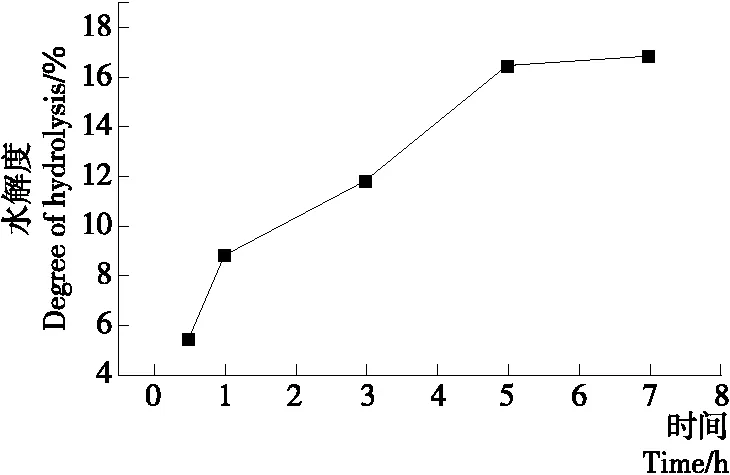
图5 蛋白酶酶解时间对水解度的影响
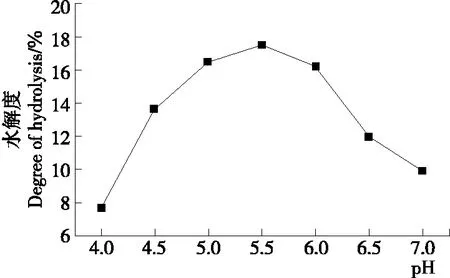
图6 纤维素酶酶解pH值对水解度的影响
2.2.6 蛋白酶酶解pH值对水解度的影响 由图7可知,随着pH的增大,水解度逐渐增大,当pH达到7.5时水解度达到最大值,之后水解度呈现明显的下降趋势。因此,后续试验选择蛋白酶酶解pH为7.5。
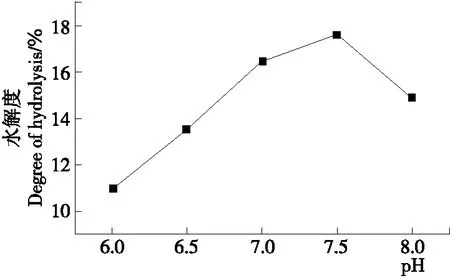
图7 蛋白酶酶解pH值对水解度的影响
2.2.7 纤维素酶添加量对水解度的影响 如图8所示,当底物含量较高时,酶促反应速度与酶含量呈正比,纤维素酶添加量在0.02%~0.10%时,水解度大幅增加,而在0.10%~0.40%时水解度有减小的趋势,原因有两个:① 当酶添加量达到0.1%以后,水解产生的产物可能对酶活有抑制作用;② 大部分底物已被反应消耗。所以最适纤维素酶添加量为0.10%。
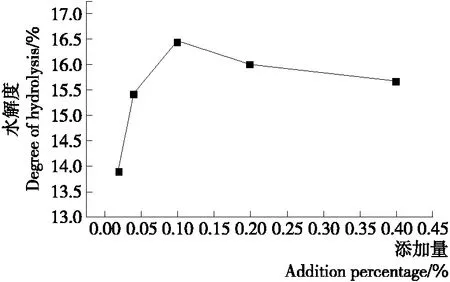
图8 纤维素酶添加量对水解度的影响
2.2.8 蛋白酶添加量对水解度的影响 从图9可以看出:当蛋白酶添加量从0.02%增加到0.10%时,酶促反应速率大大增加,水解度大幅增加。当蛋白酶添加量从0.10% 增加到0.40%时,虽然酶促反应速率继续增大,但底物物料有限,几乎被完全水解,所以水解度趋于平稳。因此,选择0.10%为最适蛋白酶添加量。
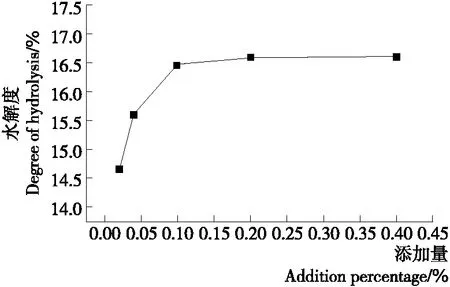
图9 蛋白酶添加量对水解度的影响
2.3 响应面法优化最佳酶解工艺
2.3.1 模型的建立及显著性检验 在单因素试验的基础上,选取对水解度影响较大的蛋白酶酶解温度、纤维素酶添加量和蛋白酶酶解pH值等3个影响因子,其他因素选取单因素试验最佳条件,采用三因素三水平的响应曲面分析方法进行酶解条件的优化,其因素水平编码见表3,试验因素与水平设计见表4。软件分析得到水解度对以上3个因素的二次多项回归模型为:
DH=-437.710 18+5.471 63A+31.909 13B+93.122 27C+0.959 53AB-0.044 06AC+5.580 96BC-0.062 499A2-505.540 58B2-6.298 88C2。
(2)
2.3.2 响应曲面分析与优化 由图9可以看出,随着纤维素酶量从0.05%增加到0.11%和蛋白酶酶解温度从35 ℃ 上升到42 ℃的过程中,水解度上升变化明显;继续提高纤维素酶添加量和蛋白酶酶解温度,水解度开始下降。结合等高线图可以得出,等高线中的最小椭圆的中心点即是响应面的最高点,等高线形状呈椭圆形,表示A和B两因素交互作用较显著。由图10可以得出,蛋白酶酶解温度和蛋白酶pH值曲线坡度大,说明这两个因素对水解度的影响变化很快。随着蛋白酶酶解温度从35 ℃上升到42 ℃和蛋白酶pH值从7.0上升到7.4的过程中,水解度上升变化明显;继续提高蛋白酶酶解温度,水解度上升变化不明显;而继续提高蛋白酶pH值,水解度急剧下降,表明蛋白酶对pH变化较敏感且其最适宜pH为7.2~7.4。结合等高线图可以得出,等高线中的最小椭圆的中心点即是响应面的最高点,等高线形状呈椭圆形,表示A和C两因素交互作用较显著。由图11以发现,蛋白酶pH值曲线比纤维素酶添加量曲线变化更大,说明蛋白酶pH值对水解度的影响更为显著。随着纤维素酶添加量从0.05% 上升到0.11%和蛋白酶pH值从7.0上升到7.4的过程中,水解度平稳上升;继续提高纤维素酶添加量和蛋白酶pH值,水解度呈现下降趋势。结合等高线图可以发现,等高线图形呈明显的椭圆形,表明B和C两因素交互作用显著。
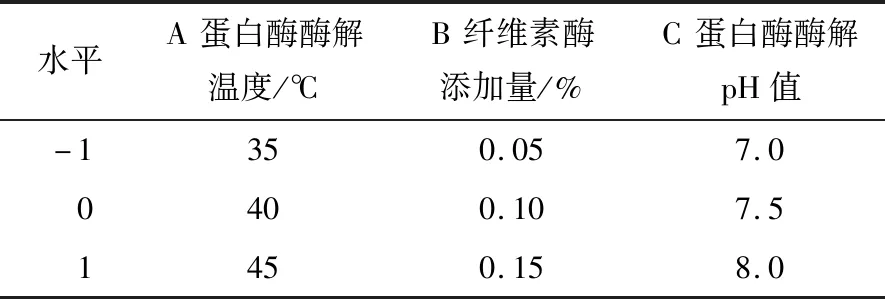
表3 因素水平编码表
表4纤维素酶和蛋白酶酶解条件的响应面优化方案与结果
Table4Responsesurfaceoptimizationschemeandresultsofcellulaseandneutralproteasehydrolysisconditions
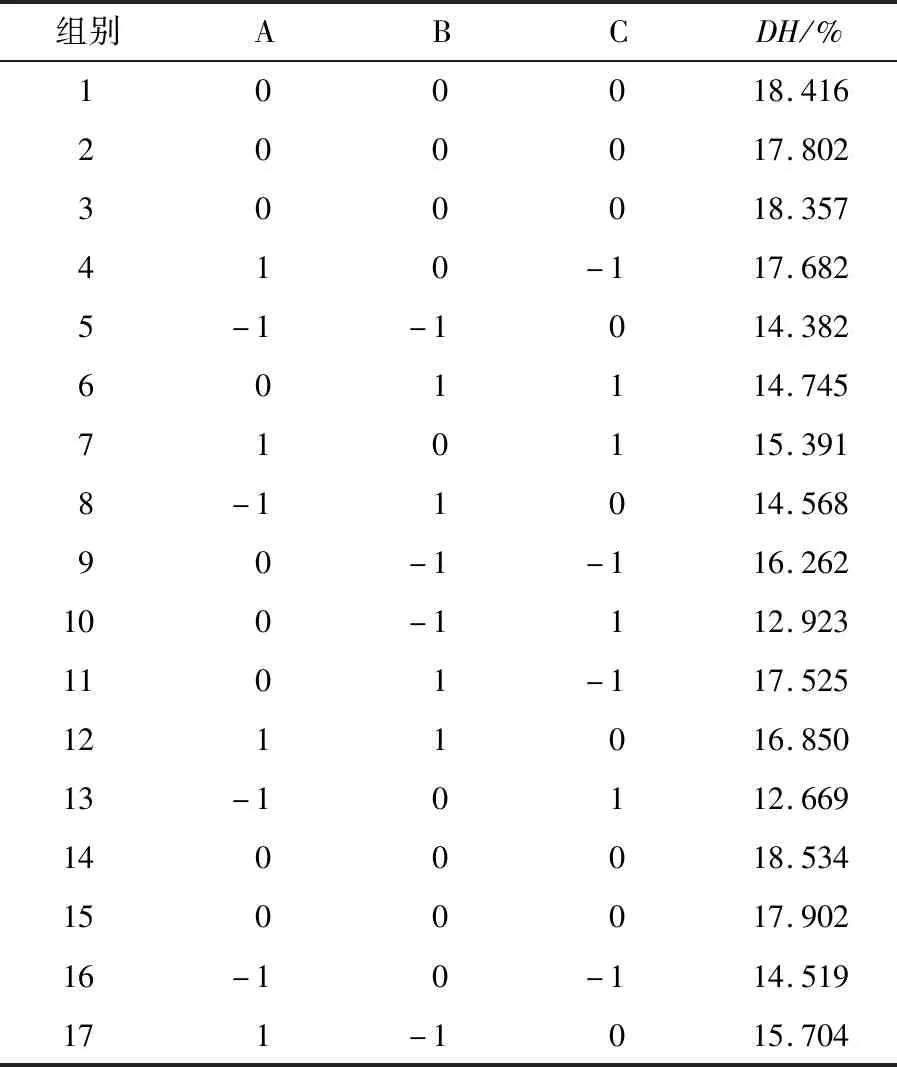
组别ABCDH/%100018.416200017.802300018.357410-117.6825-1-1014.382601114.745710115.3918-11014.56890-1-116.262100-1112.9231101-117.5251211016.85013-10112.6691400018.5341500017.90216-10-114.519171-1015.704
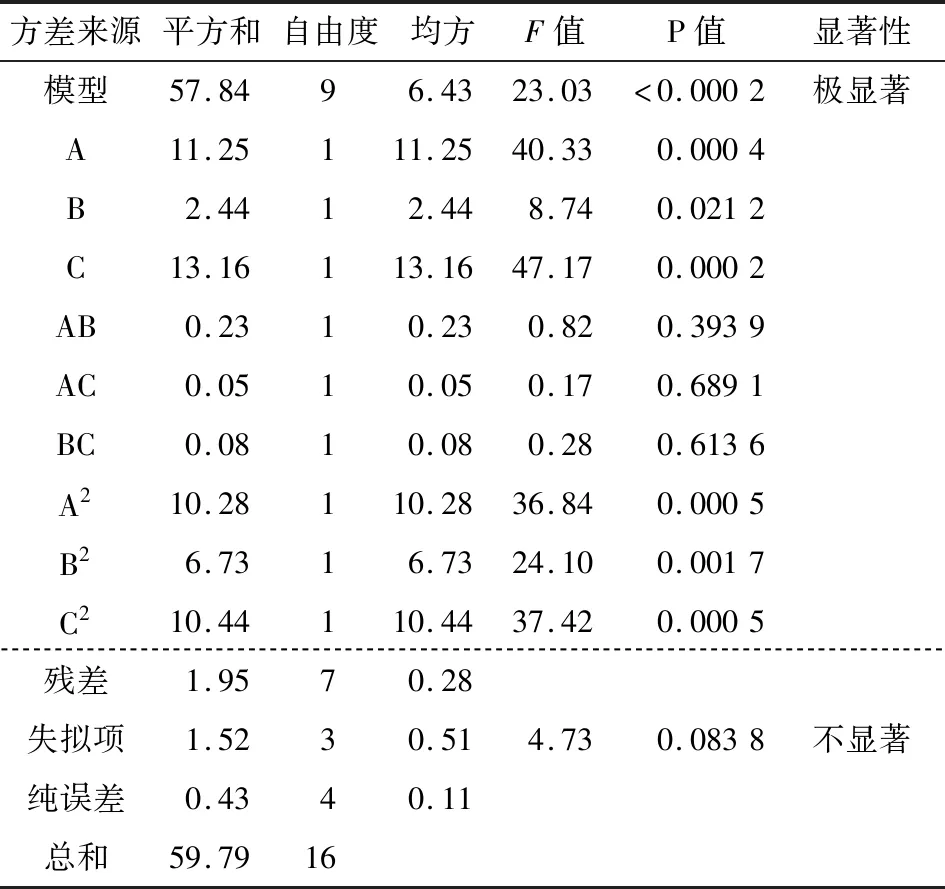
表5 响应曲面二次回归方程模型方差分析结果†
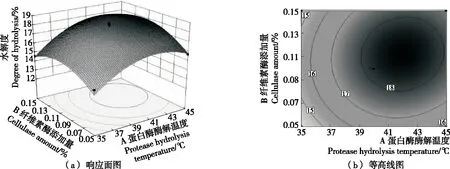
图10 蛋白酶酶解温度和纤维素酶添加量对水解度的影响
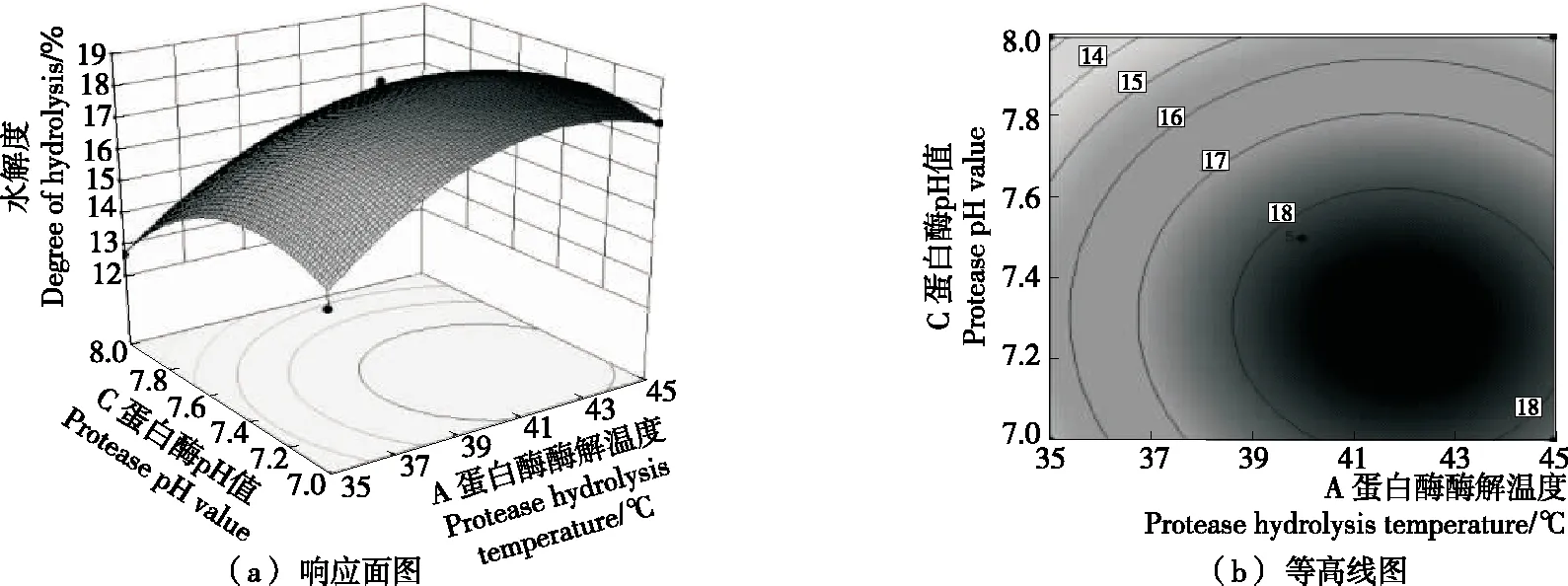
图11 蛋白酶酶解温度和酶解pH值对水解度的影响
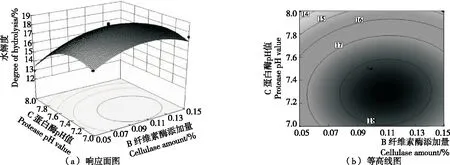
图12 纤维素酶添加量和蛋白酶酶解pH值对水解度的影响
结合P值可知:模型的一次项A和C极显著,二次项A2和C2极显著,B2显著表明各因素对水解度的影响不是简单的线性关系。该模型下得到最佳工艺参数为蛋白酶酶解温度42.06 ℃、蛋白酶pH 7.29、纤维素酶添加量0.11%,此时水解度为18.775%。结合实际,调整各因素为蛋白酶酶解温度42 ℃、蛋白酶pH 7.30、纤维素酶添加量0.10%,此时水解度为18.510%,与预测值相差为1.41%,证明了该模型的可靠性。
3 结论
本试验结果表明,制取高氨基酸含量的最优酶解工艺条件为蛋白酶酶解温度42 ℃、蛋白酶pH 7.30、纤维素酶添加量0.10%,此时水解度为18.510%。
多种食用菌复配结合制备鲜菇菌液的方式,不仅有利于协调不同食用菌的氨基酸,同时可以增加产品的功能性,为开发秀珍菇等食用菌深加工产品提供新思路,但是本研究还存在一些不足,虽然水解度比单一采用秀珍菇水解度高[19],但仍有提高空间,这可能与所选取的食用菌种类有关,后续可以本研究作为基础,开发更多秀珍菇及其他菌类复合的深加工产品,提高氨基酸利用率,增进营养和保健功能。同时,进行单一菌菇酶解制备菇液,得到鲜味液体在气味上尚有不足;如果通过添加部分还原糖,进行美拉德反应,就能够满足气味上的要求。
