丁香精油—壳聚糖纳米胶囊的制备及表征
2019-07-09张慧芸康怀彬赵梦月李银辉李森杰张海艳曹笑菲
何 鹏 张慧芸 康怀彬 赵梦月 李银辉 李森杰 张海艳 曹笑菲
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
微胶囊技术是指利用高分子聚合物薄膜,将气体、液体和固体进行包埋的微型封装技术[1]。由于纳米胶囊特有的纳米尺寸效应,与传统微胶囊相比,其具有更好的生物相容性、靶向性和缓释性,能够有效降低生物活性物质的敏感性大大提高活性物质的生物利用率[2],近年来对纳米级微胶囊的开发利用已成为研究热点。在食品工业中,纳米胶囊作为功能性活性物质的新型载体,增加了这些物质的可利用范围,尤其对难溶性物质可起到良好的增溶效果,增强其作用[3],更好地被利用。
在食品中添加抗菌剂和抗氧化剂可以控制酸败的发展,延缓有毒产物的形成,保持营养质量,延长产品的保质期[4]。由于某些合成抗菌剂和抗氧化剂对健康有负面影响[5],所以食品工业要求用天然抗氧化剂来取代合成抗菌剂[6]和抗氧化剂[7],特别是肉类行业[8]。丁香一直是最有价值的香料之一[9],数百年来被世界各地广泛应用。丁香精油是由丁香花蕾、茎、叶中提取而来,其主要成分为丁香酚、β-石竹烯、蛇麻烯(α-石竹烯)、乙酸丁香酚酯[10-11]。丁香精油具有防腐[12]、抗氧化[13]、镇痛[14]和神经保护[15]等多种药用价值,因此在医药[16]、食品[17]和化妆品行业中备受关注。但由于丁香精油具有较强烈的特殊风味、易挥发、不溶于水,且对光、氧和温度较为敏感等原因,极大地限制了其在食品防腐方向的利用。
壳聚糖作为一种具有生物相容性、可降解性以及良好成膜性的天然高分子物质[18]被作为增稠剂和被膜剂列入中国食品添加剂使用标准。壳聚糖是由甲壳素脱乙酰得到的,也是自然界中唯一存在的碱性多糖,成本低廉、来源较广,因此将其作为包埋蛋白质、多肽、维生素、功能油脂等物质的壁材[19]。壳聚糖纳米胶囊常用制备方法有离子凝胶法、共价偶联法、大分子复合法和自组装法等。其中离子凝胶法制备工艺简单便捷,反应条件温和,纳米粒粒径均匀、性质稳定[20],近年来国内外对微胶囊化植物精油方面研究较多[21],但对丁香精油—壳聚糖纳米胶囊的研究却鲜有报道。传统微胶囊粒径一般在5~200 μm不等,较大粒径导致传统微胶囊分散性不好、对芯材保护能力有限且与细胞接触面积较小,对于生物活性物质的释放速率和利用率不能够起到很好的控制效果;与传统微胶囊相比,将生物活性物质进行纳米级封装可大大减小胶囊粒径、增加胶囊比表面积,同时提高了包埋率和芯材物质的释放面积[22]。在亚细胞尺寸下的纳米胶囊拥有更好的分散性和稳定性,以及较高的细胞吸收和特异性,大大提高了生物活性物质的生物利用率。
本试验拟以壳聚糖为壁材,以三聚磷酸钠为交联剂,采用离子凝胶法制备丁香精油—壳聚糖纳米胶囊,研究制备条件对纳米胶囊包埋率及粒径的影响,并对所制备纳米胶囊进行表征分析,为缩小与国外天然活性保鲜剂方面的研究差距,扩大精油在食品工业中的应用范围,开发新型精油保鲜剂提供理论参考。
1 材料与方法
1.1 材料与试剂
丁香精油:丁香酚含量85.0%,上海国药集团化学试剂有限公司;
壳聚糖:脱乙酰化≥95.0%,北京酷尔化学科技有限公司;
吐温-80:分析纯,天津市德恩化学试剂有限公司;
多聚磷酸钠:分析纯,天津市津北精细化工有限公司;
丁香酚标准品:上海源叶生物科技有限公司;
冰醋酸:分析纯,江苏强盛功能化学股份有限公司;
溴化钾:光谱纯,天津市科密欧化学试剂有限公司。
1.2 仪器与设备
傅里叶红外仪:Vertex 70型,德国布鲁克科技有限公司;
扫描电镜:TM3030Plus型,日本日立公司;
差示扫描量热仪:DSC3型,瑞士梅特勒—托利多集团;
紫外可见光分光光度计:UV2800型,上海尤尼柯仪器有限公司;
激光粒度仪:MS2000型,英国马尔文仪器有限公司;
微量高速台式离心机:TG16-W型,长沙湘仪离心机仪器有限公司;
恒温磁力搅拌器:85-2型,常州越新仪器制造有限公司;
台式pH计:雷磁PHS-3E型,上海仪电科学仪器股份有限公司;
真空冷冻干燥机:LGJ-10D型,北京四环科学仪器厂有限公司;
超声清洗机:KQ-500DE型,昆山市超声仪器有限公司。
1.3 方法
1.3.1 丁香精油—壳聚糖纳米胶囊的制备 参照Woranuch等[23]的方法,稍加改进,采用离子凝胶法制备丁香精油—壳聚糖纳米胶囊。将壳聚糖溶于1%冰醋酸中,制成5 mg/mL的壳聚糖溶液,60 ℃磁力搅拌60 min后采用0.45 μm微孔滤纸过滤,用2 mol/L 氢氧化钠调节滤液pH值。取50 mL上述壳聚糖溶液加入与丁香精油相同质量的吐温-80,60 ℃搅拌30 min得到均匀混合物冷却至常温备用。丁香精油溶于无水乙醇,将精油溶液加入壳聚糖溶液中,常温搅拌30 min。将多聚磷酸钠溶液(调节pH值使其与壳聚糖溶液一致)逐滴加入到精油—壳聚糖乳化液中,常温搅拌60 min,形成丁香精油—壳聚糖纳米胶囊分散液,经12 000 r/min离心20 min,纳米胶囊悬浮于蒸馏水中,经15 Pa冻干24 h用于进一步分析。
1.3.2 单因素试验
(1) 壳聚糖溶液pH值对丁香精油—壳聚糖纳米胶囊粒径以及包埋率的影响:采用1.3.1的制备方法,分别将壳聚糖溶液pH值调节为4.0,4.5,5.0,5.5,6.0,壳聚糖与三聚磷酸钠质量比为3∶1,丁香精油与壳聚糖质量比为0.8∶1.0。
(2) 壳聚糖与三聚磷酸钠质量比对丁香精油—壳聚糖纳米胶囊粒径以及包埋率的影响:采用1.3.1的制备方法,壳聚糖溶液pH值为4.5,壳聚糖与三聚磷酸钠质量比分别为3∶1,4∶1,5∶1,6∶1,7∶1,丁香精油与壳聚糖质量比为0.8∶1.0。
(3) 丁香精油与壳聚糖质量比对丁香精油—壳聚糖纳米胶囊粒径以及包埋率的影响:采用1.3.1的制备方法,壳聚糖溶液pH值为4.5,壳聚糖与三聚磷酸钠质量比为5∶1,丁香精油与壳聚糖质量比分别为0.4∶1.0,0.6∶1.0,0.8∶1.0,1.0∶1.0,1.2∶1.0。
1.3.3 正交试验 根据单因素试验结果,选取壳聚糖溶液pH值、壳聚糖与三聚磷酸钠质量比、丁香精油与壳聚糖质量比为主要影响因素,利用DPS 7.05软件,以胶囊粒径和包埋率为考察指标,设计三因素三水平正交试验,确定最佳制备工艺。
1.3.4 丁香精油—壳聚糖纳米胶囊包埋率的测定 参照文献[24-25]方法,稍加改进,纳米胶囊分散液经过12 000 r/min 离心20 min后除去上清液,经去离子水冲洗后将其分散于50 mL无水乙醇中,经25 ℃、500 W超声30 min使纳米胶囊壁材破碎,其中所包埋的丁香精油溶于无水乙醇中,测定282 nm波长处的吸光度,根据丁香酚紫外标准曲线方程计算出纳米胶囊中包埋丁香酚的质量,由丁香酚质量算出纳米胶囊中包埋丁香精油的总质量,按式(1)计算包埋率。
(1)
式中:
E——包埋率,%;
ML——包埋丁香精油总质量,mg;
M——加入丁香精油总质量,mg。
1.3.5 丁香精油—壳聚糖纳米胶囊的粒径分布检测 使用纯净水作为背景,测定背景后加入胶囊分散液使溶液充分混合,控制其浓度在可测试范围内,通过激光粒度分析仪测定胶囊粒径大小和分布状况[26]。
1.3.6 丁香精油—壳聚糖纳米胶囊的扫描电镜观察 将制备好的胶囊样品溶液均匀滴在黑色导电胶上晾干,放入仪器样品台上,通过扫描电镜对胶囊的形态进行观察[27]。
1.3.7 丁香精油—壳聚糖纳米胶囊的傅里叶红外光谱分析 使用溴化钾作为背景,样品研磨后压制成透明薄片,放入傅里叶红外仪中进行红外扫描。仪器参数:光谱扫描范围4 000~400 cm-1,扫描次数32,分辨率4 cm-1[28]。
1.3.8 丁香精油—壳聚糖纳米胶囊的差示扫描量热仪分析 以壳聚糖、丁香精油、空白胶囊冻干粉和胶囊冻干粉为样品,放入样品台检测。仪器参数:升温速率15 ℃/min,测定温度区间30~450 ℃,保护气选择氮气,氮气流速为100 mL/min[29]。
1.4 数据分析
所得数据取3次平行试验的平均值,用Excel 2010以及DPS 7.05对试验数据进行处理(显著水平P<0.05),用Origin pro 9.0作图。
2 结果与分析
2.1 壳聚糖溶液pH值对丁香精油—壳聚糖纳米胶囊粒径以及包埋率的影响
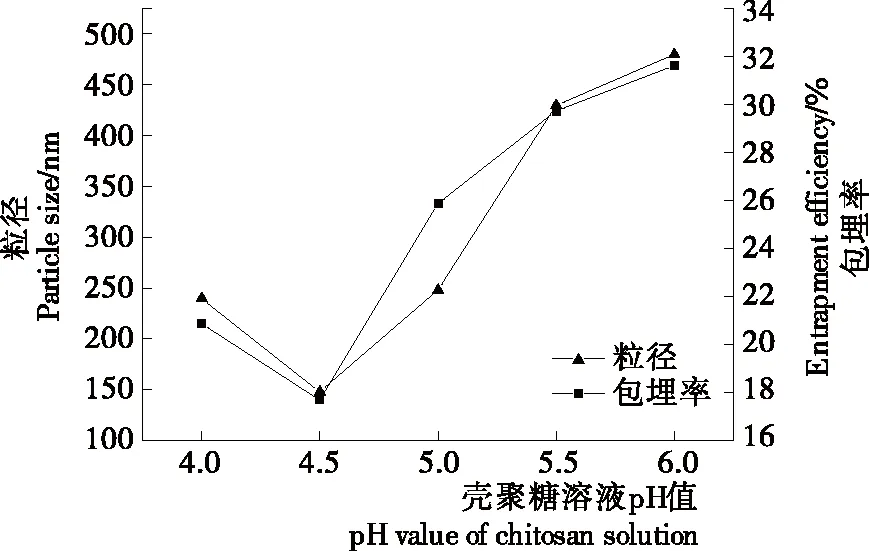
图1 壳聚糖溶液pH值对丁香精油—壳聚糖纳米胶囊粒径以及包埋率的影响
Figure 1 Effect of pH value of chitosan solution on particle size and entrapment efficiency of chitosan-clove essential oil-loaded nanocapsules
2.2 壳聚糖与三聚磷酸钠质量比对丁香精油—壳聚糖纳米胶囊粒径以及包埋率的影响
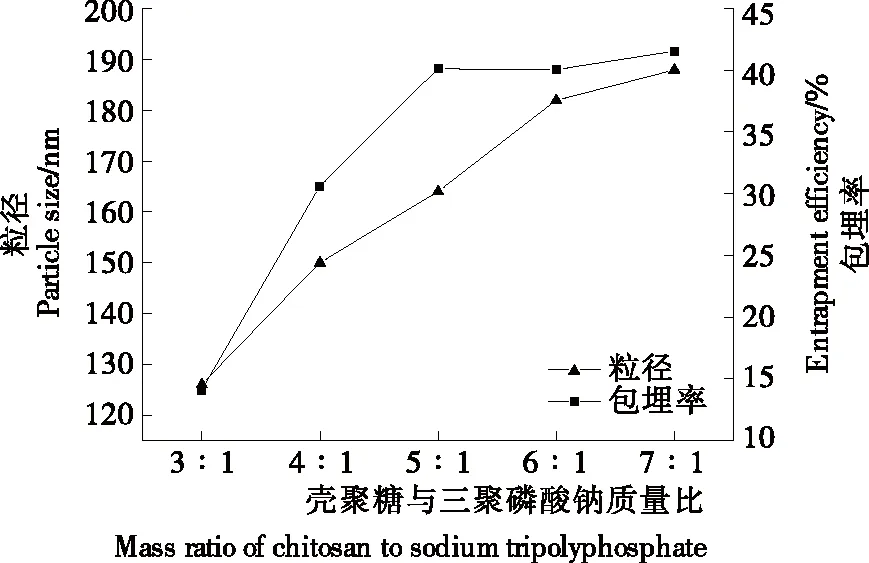
图2 壳聚糖与三聚磷酸钠质量比对丁香精油—壳聚糖纳米胶囊粒径以及包埋率的影响
Figure 2 Effects of mass ratio of chitosan to sodium tripolyphosphate on particle size and entrapment efficiency of chitosan-clove essential oil-loaded nanocapsules
2.3 壳聚糖与丁香精油质量比对丁香精油—壳聚糖纳米胶囊粒径以及包埋率的影响
由图3可知,随着丁香精油添加量的增加,纳米胶囊粒径逐渐增大,包埋率先升高后略有下降。这是因为当精油含量较少时,丁香精油形成极为细小的液滴分散于溶液中,壳聚糖与三聚磷酸钠交联形成囊壁时包裹精油量较少,导致胶囊粒径较小[34];随着精油添加量的增加,精油液滴之间相互碰撞发生凝聚致使精油液滴粒径增大,壳聚糖对大粒径精油液滴表面进行包裹使得胶囊粒径增大[32]36。当丁香精油与壳聚糖质量比高于0.8∶1.0时,纳米胶囊粒径继续增大,但包埋率却出现下降趋势,这主要是由于精油浓度增加,单位体积内大粒径精油液滴相应增多,但形成囊壁的壳聚糖却相对减少,囊壁也会越来越薄,甚至出现破裂致使精油渗出[35],胶囊之间出现严重黏连[36],导致胶囊粒径增大包埋量却有所降低。
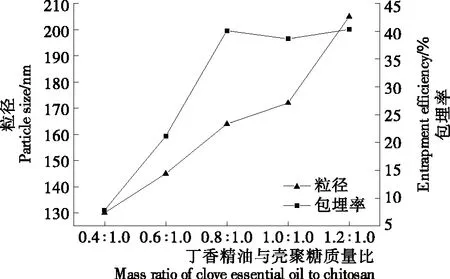
图3 丁香精油与壳聚糖质量比对丁香精油—壳聚糖纳米胶囊粒径以及包埋率的影响
Figure 3 Effect of mass ratio of clove essential oil to chitosan on particle size and entrapment efficiency of chitosan-clove essential oil-loaded nanocapsules
2.4 正交试验结果
在单因素试验基础上,采用三因素三水平正交试验对纳米胶囊制备工艺进行优化,其试验设计方案及考察因素水平见表1。
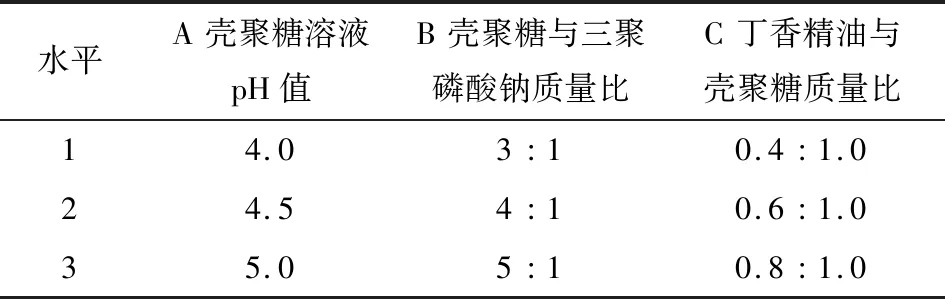
表1 正交试验设计因素与水平
由表2可知,各因素对胶囊粒径影响的主次顺序为A>C>B,由胶囊粒径越小越好得到粒径最优组合为A2B1C1;各因素对胶囊包埋率影响的主次顺序为C>B>A,由包埋率越大越好得到包埋率最优组合A1B3C3。由表3可知,壳聚糖溶液pH值对胶囊粒径影响显著(P<0.05),丁香精油与壳聚糖质量比对胶囊粒径影响最小,为得到较小粒径应选择A2为最佳制备水平之一。由表4可知,丁香精油与壳聚糖质量比对胶囊包埋率影响显著(P<0.05),壳聚糖溶液pH值对胶囊包埋率影响最小,为得到较大包埋率应选择C3为最佳制备水平之一。壳聚糖与三聚磷酸钠质量比对粒径及包埋率影响皆不显著,为得到较大包埋率应选择B3为最佳制备水平之一。综上所述,为了得到粒径较小包埋率较大的精油胶囊,选择最佳组合A2B3C3,即壳聚糖溶液pH值4.5、壳聚糖与三聚磷酸钠质量比5∶1、丁香精油与壳聚糖质量比0.8∶1.0,此条件下制得胶囊粒径为175 nm,包埋率为40.2%,用于下一步表征分析。
2.5 丁香精油—壳聚糖纳米胶囊的粒径分布及形态观察
由图4可以看出,空白胶囊和丁香精油—壳聚糖纳米胶囊均呈现双峰分布,其平均粒径分别为128 nm和175 nm;空白胶囊和丁香精油—壳聚糖纳米胶囊都在448 nm 处出现第二峰,这是由于部分胶囊相互凝聚导致较大颗粒的粒径分布增强,且丁香精油—壳聚糖纳米胶囊在448 nm处的粒径分布强度强于空白壳聚糖纳米胶囊,可能是胶囊表面残留的游离芯材加重了胶囊间的凝聚。图5表明,丁香精油—壳聚糖纳米胶囊为球形颗粒,形态饱满,颗粒之间相互接触紧密,部分胶囊相互黏连,与粒径分析结果一致。徐俊等[37]研究缓释型驱蚊纳米胶囊的制备,经电镜扫描后观察到球状纳米颗粒有团聚现象,与本研究结果一致。
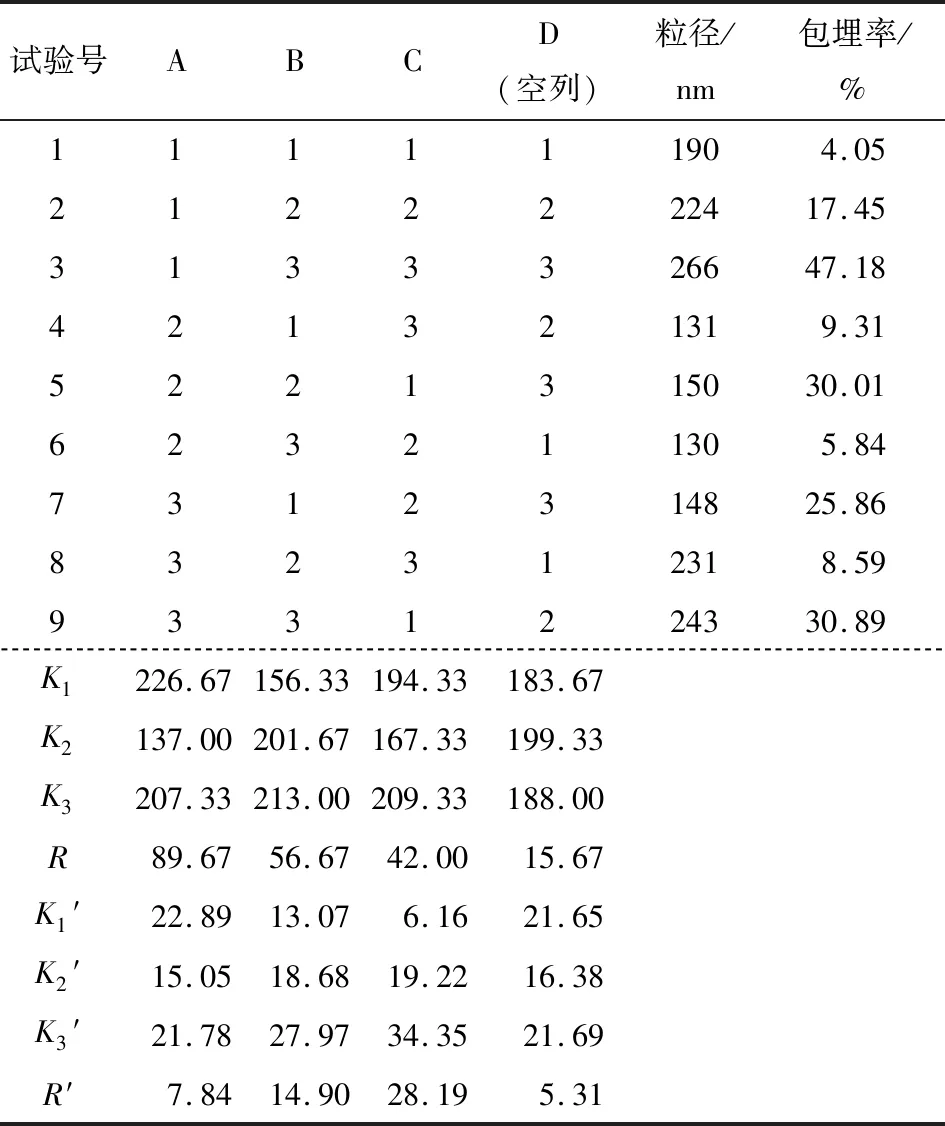
表2 粒径正交试验设计与结果
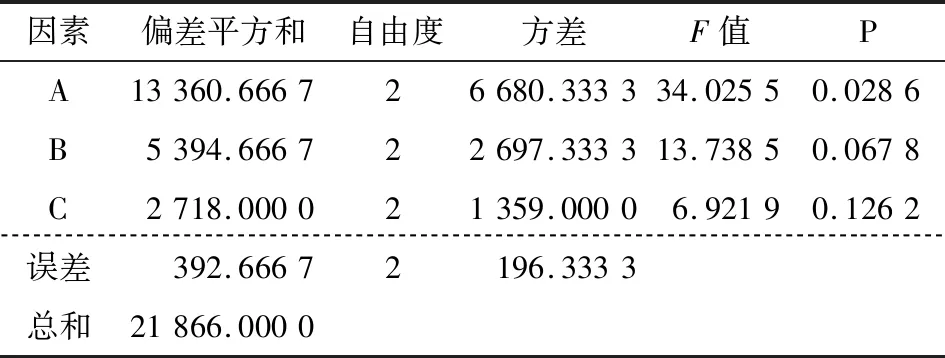
表3 粒径方差分析
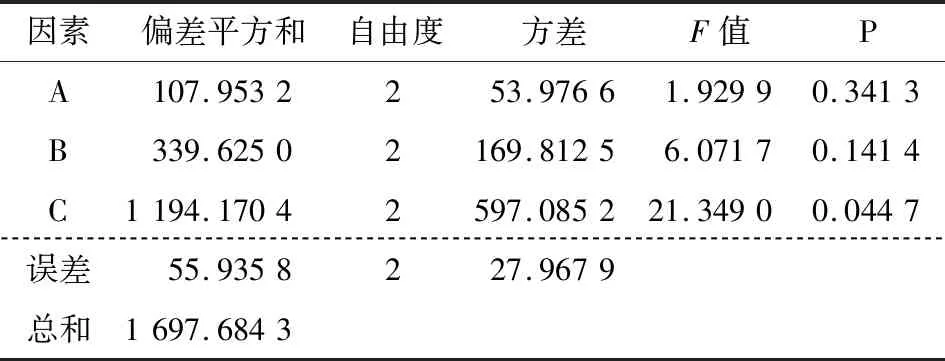
表4 包埋率方差分析
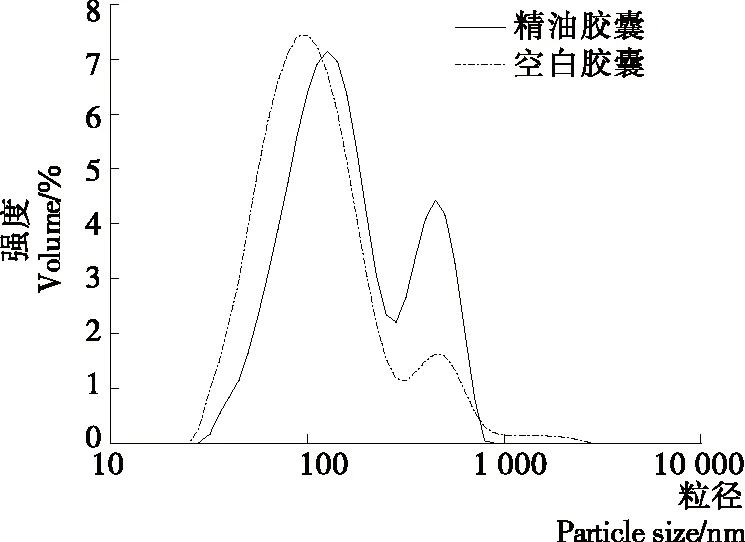
图4 丁香精油—壳聚糖纳米胶囊与空白壳聚糖纳米胶囊的粒径分布
Figure 4 Particle size distribution of chitosan nanoparticles and chitosan-clove essential oil-loaded nanocapsules

图5 丁香精油—壳聚糖纳米胶囊的扫描电镜图
2.6 丁香精油—壳聚糖纳米胶囊的傅里叶红外光谱分析
由图6可知,壳聚糖在2 876 cm-1出现C—H伸缩振动吸收峰,1 657 cm-1出现酰胺Ⅰ带的C═O伸缩振动吸收峰,1 598 cm-1出现N—H弯曲振动吸收峰,1 424 cm-1出现C—N对称伸缩振动吸收峰,1 093 cm-1出现—CH3对称变形振动以及C—O骨架振动吸收峰。空白胶囊中伯胺基与仲胺基的吸收峰发生蓝移向短波移动至1 642 cm-1和1 547 cm-1,这是由于三聚磷酸钠中的磷酸基团与壳聚糖中的氨基在静电作用下结合。陶武等[38]采用傅里叶红外光谱研究壳聚糖包埋山梨酸钠微胶囊的结构变化,结果也出现伯、仲胺基蓝移的情况。丁香精油的红外图谱出现大量吸收峰,表明其中存在多种挥发性化合物,在2 930 cm-1出现C—H不对称伸缩振动吸收峰,2 855 cm-1出现C—H对称伸缩振动吸收峰;1 742 cm-1出现酰胺I带的C═O伸缩振动吸收峰[39],1 513 cm-1出现芳香族C═C伸缩振动吸收峰。与空白胶囊相比,丁香精油—壳聚糖纳米胶囊在2 925 cm-1与2 862 cm-1处出现明显增强的C—H伸缩振动吸收峰,并在1 736 cm-1处出现一个新峰,为酰胺I带的C═O伸缩振动吸收峰,表明丁香精油已被成功包埋到壳聚糖与三聚磷酸钠形成的纳米胶囊中。
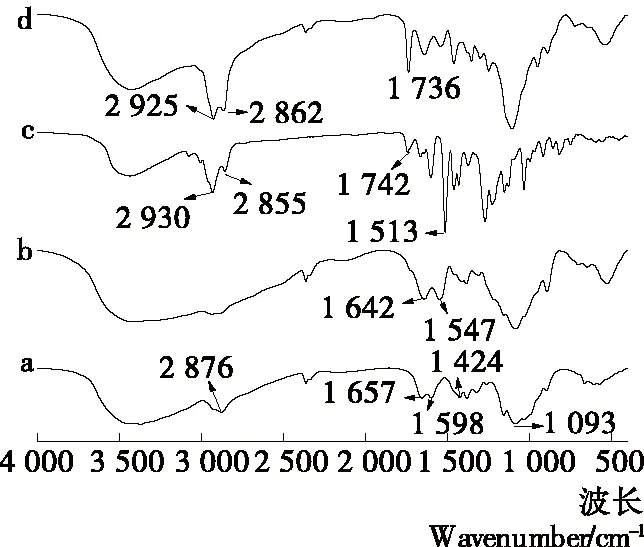
a. 壳聚糖粉 b. 空白胶囊 c. 丁香精油 d. 精油胶囊
2.7 丁香精油—壳聚糖纳米胶囊的差示扫描量热仪分析
由图7可知,随着温度的升高,丁香精油挥发速度快速增加,温度到达252 ℃出现吸热峰,是由于精油沸腾汽化。纯壳聚糖粉在99 ℃出现较宽吸热峰,是由于壳聚糖亲水基团吸附水的蒸发,在315 ℃出现尖锐放热峰,是由于壳聚糖发生降解。空白胶囊在252 ℃出现尖锐放热峰,可能是由于壳聚糖与三聚磷酸钠交联反应过程中发生能量变化导致降解放热峰改变。廖霞等[36]对壳聚糖与海藻酸钠复合物进行热分析,结果表明壳聚糖与海藻酸钠复合后峰位也出现向低温偏移的情况。与空白胶囊相比,精油胶囊在252 ℃放热峰减弱,可能是纳米胶囊外层部分精油吸收了空白胶囊降解的部分热量;与空白胶囊相比,精油胶囊在413 ℃出现吸热峰,是由于中间产物进一步裂解碳化[40],胶囊壁完全破裂精油发生汽化;与丁香精油相比,精油胶囊吸热峰由252 ℃提高到413 ℃,说明壳聚糖对精油进行了包埋并对精油起到了一定的保护作用。
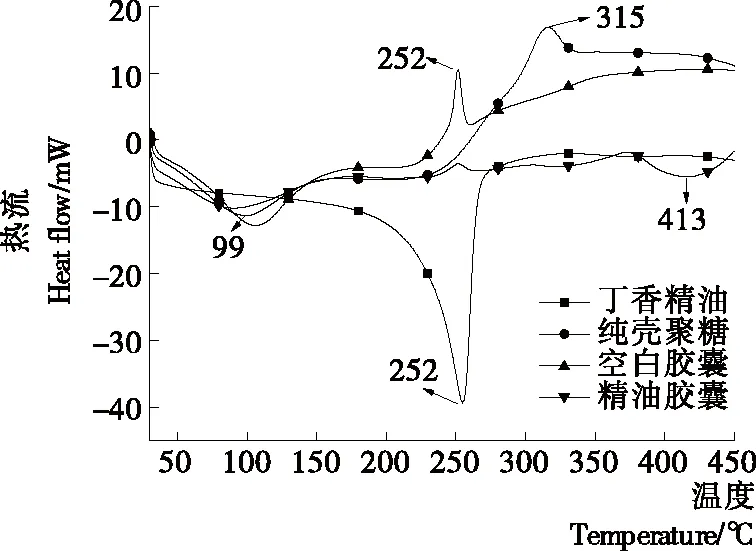
图7 差示扫描量热分析图
3 结论
本研究采用离子凝胶法制备丁香精油-壳聚糖纳米胶囊,通过正交试验进行工艺优化,得到最佳工艺条件为:壳聚糖溶液pH值4.5、壳聚糖与三聚磷酸钠质量比5∶1、丁香精油与壳聚糖质量比0.8∶1.0,此条件下制得纳米胶囊包埋率达到40.2%,胶囊平均粒径为175 nm。丁香精油—壳聚糖纳米胶囊外观呈球形,形态饱满,且具有良好的热稳定性。将所制备纳米胶囊应用于食品保鲜中,研究其对食品贮藏期间品质的影响仍需进一步探讨。
