5种炎性指标对革兰阴性菌和革兰阳性菌所致脓毒症的早期诊断及鉴别诊断价值比较
2019-07-09卢秋维廖美娟林雪珍
卢秋维,廖美娟,林雪珍
(广西壮族自治区人民医院,南宁530021)
脓毒症是指由病原体血流感染引起的全身炎性反应综合征,其发生机制与免疫功能紊乱、内毒素移位、炎性因子分泌失控和病原体的构成等因素有关。脓毒症感染的病原体以革兰阴性菌(G-菌)和革兰阳性菌(G+菌)为主,而G-菌引起的血流感染较G+菌病理过程更加严重,其发生脓毒性休克及死亡的可能性更高,另有研究显示,脓毒症早期的病理生理改变是功能性的、可逆的,及时有效的冶疗可降低患者病死率[1]。因此早期识别脓毒症患者血流感染病原菌的种类对临床治疗至关重要。血培养是目前确诊脓毒症和病原菌的金标准,但存在等待结果的时间长、检出率低、污染率高等问题[2]。近年来,血中炎性标志物越来越多地用于脓毒症的早期诊断和预后评价,但也存在一些不足和分歧。本研究通过检测脓毒症患者的血清降钙素原(PCT)、C反应蛋白(CRP)、脑钠肽(BNP)、白细胞计数(WBC)、中性粒细胞比率(NE%),分析上述炎性指标对G-菌与G+菌引起的脓毒症的早期鉴别价值。
1 资料与方法
1.1 临床资料 选择2014年10月~2017年12月广西壮族自治区人民医院收治的脓毒症患者251例,男145例、女90例,年龄8个月~95岁。排除急性冠状动脉综合征、急性心力衰竭等循环系统疾病。根据血培养结果,将患者分为G-菌组和G+菌组。G-菌组154例,男95例、女59例,年龄(47.39±28.72)岁;G+菌组97例,男60例、女37例,年龄(43.55±30.17)岁。另选择同期收治的局部感染或疑有系统性感染的非脓毒症患者221例(对照组),男130例、女91例,年龄(55.28±20.51)岁,血培养均为阴性。三组性别、年龄具有可比性。本研究经医院伦理委员会审核批准,患者均知情同意。
1.2 血清PCT、BNP、CRP、WBC、NE%检测 采用Roche cobas e601电化学发光法定量检测血清PCT和BNP;WBC和NE%检测采用SysmeXN9000血细胞分析仪;CRP检测采用韩国BODITE荧光干式分析仪,严格按说明书操作。

2 结果
2.1 三组血清炎性指标水平比较 见表1、表2。G-菌组血PCT、CRP、BNP水平高于G+菌组和对照组,G+菌组血PCT、CRP、BNP水平高于对照组(P均<0.05),三组WBC、NE%比较差异均无统计学意义(P均>0.05)。
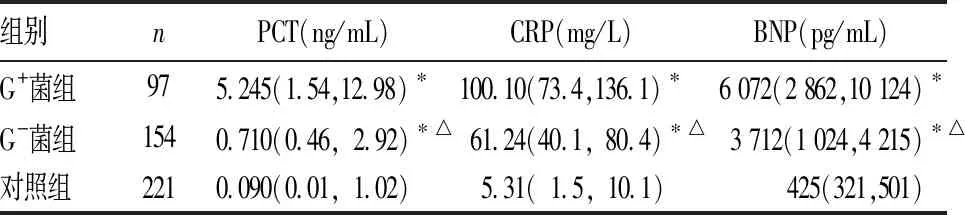
表1 三组血清PCT、CRP、BNP水平比较[M(P25,P75)]
注:与G-菌组比较,*P<0.05;与G+菌组比较,△P<0.05。
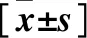
表2 三组血WBC、NE%比较
注:与G-菌组比较,*P<0.05;与G+菌组比较,△P<0.05。
2.2 鉴别病原体最有价值炎性指标的筛选结果 使用Multinomial Logistic 回归法对WBC、NE%、PCT、CRP、BNP进行逐步回归,最后筛选出PCT和CRP这两个因素对鉴别病原体最有价值,见表3。似然比检验显示,PCT的诊断价值(χ2=25.946,P=0.000)较CRP(χ2=6.911,P=0.032)更高。
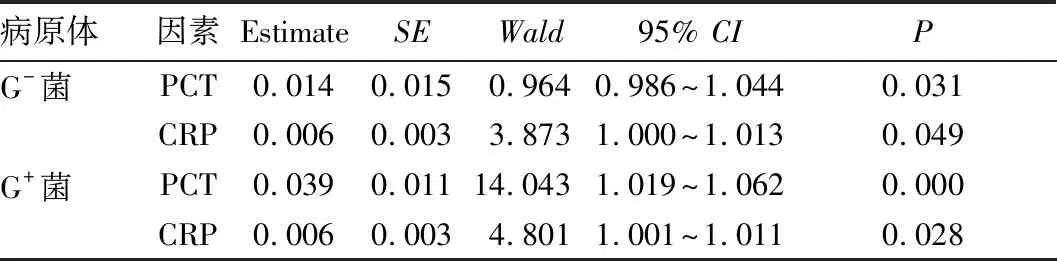
表3 多因素分析筛选鉴别病原体最有价值的炎性指标
2.3 各炎性指标对不同病原菌引起的脓毒症的诊断效能
2.3.1 各炎性指标区分G+菌引起的脓毒症和非脓毒症的诊断效能 见图1。BNP、WBC、NE%不能区分G+菌引起的脓毒症和非脓毒症(AUC分别为0.517、0.444、0.483,P均>0.05)。PCT的AUC为0.717,P=0.001,最佳诊断阈值为0.975,以PCT>0.975 pg/mL作为诊断G+菌引起的脓毒症的标准,其敏感度为67.2%,特异度为76.9%。CRP的AUC为0.619,P=0.035,最佳诊断阈值为98.59,以CRP>98.59 ng/mL作为诊断G+菌引起的脓毒症的标准,其敏感度为57.7%,特异度为71.1%。
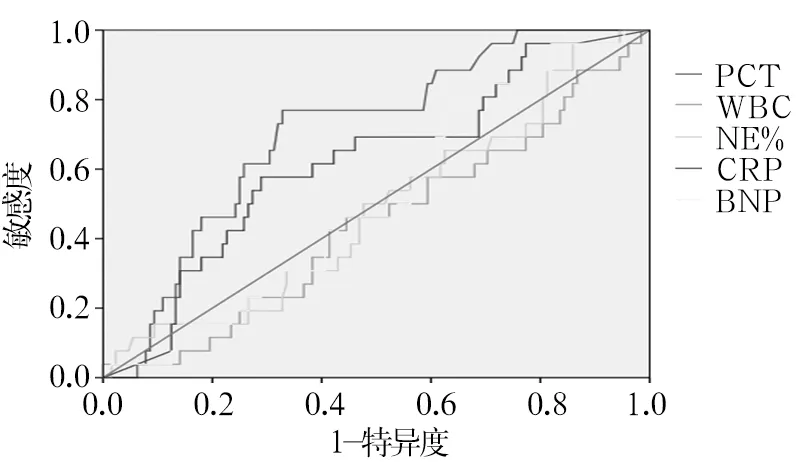
图1 各炎性指标区分G+菌引起的脓毒症和非脓毒症的ROC曲线
2.3.2 各炎性指标区分G-菌引起的脓毒症和非脓毒症的诊断效能 见图2。WBC、NE%不能区分G-菌引起的脓毒症和非脓毒症(AUC分别为0.506、0.569,P均>0.05)。PCT的AUC为0.797,P=0.000,最佳诊断阈值为2.06,以PCT>2.06 pg/mL作为除外非脓毒症、考虑G-菌引起的脓毒症,其敏感度为65.4%,特异度为82.0%。CRP的AUC为0.643,P=0.003,最佳诊断阈值为101.17,以CRP>101.17 ng/mL作为除外非脓毒症、考虑G-菌引起的脓毒症,其敏感度为55.8%,特异度为71.9%。BNP的AUC为0.638,P=0.004,最佳诊断阈值为2 759,以BNP>2 759 pg/mL作为除外非脓毒症、考虑G-菌引起的脓毒症,其敏感度为59.4%,特异度为65.4%。
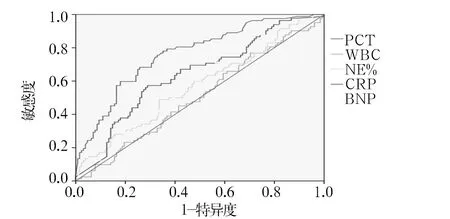
图2 各炎性指标区分G-菌引起的脓毒症和非脓毒症的ROC曲线
2.3.3 各炎性指标区分G-菌和G+菌引起的脓毒症的诊断效能 见图3。WBC、NE%、CRP和BNP不能区分G-菌和G+菌引起的脓毒症(AUC分别为0.525、0.569、0.509,P均>0.05)。PCT的AUC为0.645,P=0.012,最佳诊断阈值2.47,以PCT>2.47 pg/mL作为除外G+菌引起的脓毒症,考虑G-菌引起的脓毒症,其敏感度为65.4%,特异度为60.4%。
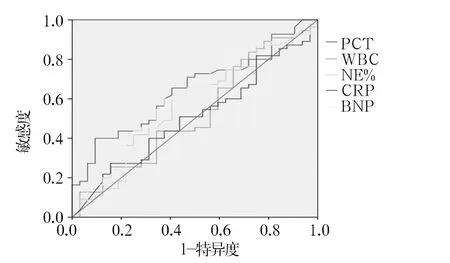
图3 各炎性指标区分G-菌和G+菌引起的脓毒症的ROC曲线
3 讨论
脓毒症是病原菌侵袭人体并在血流中播散导致严重感染的疾病。不同病原菌类型所致的脓毒症病死率有所差异。与G+菌相比,G-菌所致脓毒症病情进展更加迅速,病死率更高。由于血培养作为 “金标准”检出病原菌耗时长,且脓毒患者中多达70%已接受过抗感染治疗,影响了病原菌的检出时间和阳性检出率。因而寻找更快速且特异的脓毒症实验室诊断指标有着非常重要的临床价值。
本研究结果显示,在血清PCT、BNP、CRP、WBC、NE%这五个指标中,WBC、NE%在非脓毒症感染组、G-菌和G+菌的脓毒症组间没有统计学差异。ROC曲线分析显示,WBC和NE%的AUC较低,在0.4~0.5,且P均>0.05。表明WBC、NE%对早期诊断脓毒症及鉴别病原体缺乏诊断价值。WBC和NE是机体的防御细胞,在抵抗病原菌的侵袭过程及机体防御中起重要作用,是对炎症辅助诊断最为传统和原始的指标。WBC和NE%升高对诊断细菌感染有一定临床价值,但在脓毒症的发展过程中它们的波动范围非常广泛,不同病原体感染或某些严重脓毒症和感染性休克情况下,WBC可以升高也可以降低甚至缺乏[3],所以在诊断脓毒症时WBC和NE%缺乏特异性和敏感性,更无法鉴别病原菌类型,其诊断价值非常有限。
BNP由心肌细胞合成,表达于心肌细胞及脑组织中,常用于心力衰竭、心肌梗死等心血管疾病的危险程度分级及预后预测。关于BNP在脓毒症中的作用,目前还存在争议[4]。Vila等[5]报道,在健康男性中,大肠杆菌释放内毒素可导致BNP升高。Piechota等[6]在不合并心力衰竭的脓毒症患者中发现,BNP水平与PCT、CRP水平高度相关。Ma等[7]通过离体实验证实,白细胞介素6、肿瘤坏死因子等可直接刺激心肌细胞分泌BNP。以上研究提示,感染是除心功能障碍外导致BNP增加的一个重要原因。既往BNP在脓毒症中作用的研究多集中在对疾病的分程和预后关系[8],关于其对病原菌的识别鲜有报道。李成健等[9]研究显示,G-菌感染脓毒症患者的BNP显著高于G+菌患者。本研究结果显示,对照组、G-菌组和G+菌组BNP水平存在统计学差异,且区分G-菌组和非脓毒症的AUC为0.638,最佳诊断阈值为2 759,敏感度为59.4%、特异度为65.4%,P=0.004。表明脓毒症可导致BNP明显升高,在G-菌感染致脓毒症患者中升高更加明显,可用于G-菌感染脓毒症与非脓毒症感染者的鉴别。但在本研究中,BNP与PCT、CRP相比,不能区分G+菌感染的脓毒症和非脓毒症患者,各项指标均不具备优势。
CRP是急性时期反应蛋白。人体正常状态下,CRP血清含量极低。当炎症、感染和组织损伤时,CRP由肝脏合成,在感染6~8 h后升高,24~48 h达高峰,病情缓解1周内逐渐下降至正常。CRP常用来反映感染的严重程度,是临床广泛应用的炎性标志物。有研究显示,CRP在10~99 mg/L提示局部或浅表性感染,≥100 mg/L提示败血症或侵袭性感染,CRP适用于提示是否存在脓毒症的感染及监测治疗效果[10]。本研究ROC曲线分析提示,CRP区分G+菌脓毒症和非脓毒症的AUC为0.619,最佳诊断阈值98.59,敏感度57.7%,特异度71.1%,区分G-菌脓毒症和非脓毒症AUC为0.643,最佳诊断阈值101.17,敏感度55.8%,特异度71.9%;两组的AUC、敏感度和特异度无明显差异,特异度较为理想,表明CRP水平高低能够用于脓毒症病原体感染者与非脓毒症感染者的鉴别。另外,本研究的5个炎性指标中虽然CRP和PCT为鉴别病原体最有价值的炎性因子,但进一步研究显示CRP区分G+菌和G-菌脓毒症的ROC曲线显示P>0.05,提示CRP不适用于在脓毒症患者中病原体类型的区分。这可能与CRP的诊断特异性有关,因为在非细菌诱导的疾病如创伤、自身免疫性疾病和肿瘤等疾病CRP都会升高[11],而本研究未完全排除这些病例。
PCT是由甲状腺细胞产生的前肽糖蛋白,健康人群中含量极低,在细菌感染特别是脓毒症状态下可迅速升高,一般在感染3 h升高,12 h达高峰,峰值最高可达1 000 ng/L。与CRP相比,PCT在局部细菌感染、严重的病毒感染和非感染性起源的炎症反应时不会增加或仅轻微增加,是鉴别细菌感染和病毒感染的良好指标。很多研究认为,PCT在早期鉴别细菌感染类型方面的敏感度和特异度均高于CRP[12]。一项纳入3 487例患者的荟萃分析显示,降钙素原水平用于脓毒症诊断的总体敏感性和特异性分别为0.77和0.79,ROC为0.85[13]。进一步研究发现,PCT水平可用于区分G+菌和G-菌感染。Kumar等[14]认为,不同病原体的感染可以诱导不同水平的PCT产生,由于G-菌产生内毒素,加上Toll样受体激活信号通路不同,G-菌相比G+菌可产生更高水平的PCT释放。Leli等[15]的前瞻性研究发现,PCT在截点为10.8 ng/mL可以区分G+菌和G-菌感染的脓毒症,敏感性为0.60,特异性为0.82。本研究中PCT水平不仅在G-菌组最高,还可根据水平高低区分是G+菌还是G-菌感染,而且经检定提示PCT(P=0.000)比CRP(P=0.032)鉴别病原体能力更强。在本研究中的ROC曲线分析中,PCT区分G-菌引起的脓毒症和非脓毒症的诊断价值最高,面积为0.797,诊断阈值为2.06,敏感度为65.4%,特异度为82.0%,而PCT区分G-菌和G+菌引起的脓毒症的AUC为0.645,诊断阈值为2.47,敏感度为65.4%,特异度为60.4%。这一结果与戴莉等[16]的报道相近(阈值为2.105),而与Leli等[15]的报道(阈值为10.8)存在差异,其原因可能与患者构成、菌属分布以及对照组选择等因素相关。本研究选取的是各科住院的血培养阳性患者,因此选取不同类别的患者,其相应的参考值也不同。故PCT可用于诊断脓毒症及预测细菌菌种,其效能优于WBC和NE%以及BNP和CRP。
综上所述,血清PCT、CRP、BNP水平在G-菌组和G+菌组的水平有显著差异,且在G-菌组最高。PCT对脓毒症的早期诊断价值及鉴别病原体能力最强,CRP次之,BNP相对较弱,而WBC和NE%诊断值有限。由于脓毒症病情较为复杂,本研究尚有不足:①选取或收集病历资料时,可能受主观因素影响。②未对炎性指标做动态描述和分析。③未剔除可能影响炎性指标水平的创伤、自身免疫性疾病、肿瘤等病例。因此,针对脓毒症早期诊断因素仍需临床深入探讨。
