维生素 D受体对 LPS诱导的大鼠小肠隐窝上皮细胞 IEC-6炎症模型的保护机制 ※
2019-07-09王海久姚丹华李幼生樊海宁
许 航,王海久,姚丹华,李幼生*,樊海宁*
(1.青海大学附属医院肝胆胰外科,青海 西宁 810000;2.青海省包虫病研究重点实验室,青海 西宁 810000;3.上海交通大学医学院附属第九人民医院普外科,上海 200011)
and the concentration of IFN-γ and IL-6 in the supernatantof IEC-6 by MTT
如今,越来越多关于维生素D在肠道中的生理作用被人们所重视。由于维生素D的生物学作用都是通过维生素D受体(Vitamin D receptor,VDR)来实现的,活性维生素D可以激活VDR,因此我们认为活性维生素D的作用等同于VDR的作用。近几年来的研究发现,VDR是一个胃肠道的保护性受体,并广泛分布于人体各个器官,具有抗炎作用[1]。动物实验证实,小肠切除术后,在膳食中添加维生素D,可以促进隐窝的分化和肠上皮细胞的增殖[2],也可以维持肠上皮细胞的稳态[3]。同时,VDR下调可以减轻大鼠结肠炎症[4]。但目前维生素D对缓解肠道炎症的具体机制不明,因此,本实验通过体外建立LPS诱导的大鼠小肠隐窝上皮细胞IEC-6炎症模型,观察VDR对该模型的影响,探究其可能存在的机制。
1 材料与方法
1.1 试剂与仪器
IEC-6 细胞购于富衡生物公司;培养用胎牛血清(Fetal Bovine Serum,FBS)购于Gibco公司;DMEM培养基、胰酶、脂多糖(Lipopolysaccharide,LPS)、1,25二羟维生素D3(1,25-dihydroxy-vitamin D3,1,25D3)购于Sigma公司;INF-γ、IL-6 ELISA试剂盒购于联科生物;RNA提取试剂盒GeneJET RNA Purification Kit购于Thermo公司;cDNA逆转录试剂盒购于Takara公司;PowerUp SYBR Master Mix购于ABI公司;RIPA细胞裂解液、BCA蛋白浓度定量试剂盒购于代轩生物公司;Claudin-1一抗购于Abcam公司;Occludin一抗购于Novus公司。
1.2 实验方法
1.2.1 细胞培养
将IEC-6细胞放在10% FBS的DMEM培养基(37℃,5%CO2,湿润)上培养,每两天传代1次。
1.2.2 实验细胞分组及干预
取生长良好的IEC-6细胞做如下分组:空白对照组(normal control,NC组);LPS组;1nM-1,25D3+ LPS组(1nM组),10nM-1,25D3+ LPS组(10nM组);100nM-1,25D3+ LPS组(100nM组);200nM-1,25D3+ LPS组(200nM组);500nM-1,25D3+ LPS 组(500nM组)。空白对照组正常培养,其余各组分别用0、1、10、100、200、500nM的1,25D3预处理72 h,之后加入LPS,使LPS总浓度达到10 mg/L,培养24 h后收集细胞及上清液进行后续实验。
1.2.3 MTT实验
将预先接种到96孔板中并处理过的各组细胞,加入20 μL MTT,孵育4 h后用移液器吸去孔内培养液,加150 μL DMSO。
用酶标仪在490 nm波长处测定各孔的吸光值。
1.2.4 炎症因子检测
吸取各组细胞上清液至1.5 mL EP管中,离心(12000g)5 min去除细胞碎片,然后吸取1 mL细胞上清液至新的1.5 mL EP管中,后续按照ELISA试剂盒说明书检测炎症因子INF-γ、IL-6。
1.2.5 实时荧光定量PCR实验
提取细胞的总RNA,测定其浓度,采用逆转录试剂盒合成cDNA,反应总体系为Total RNA 500 ng、5×PrimeScript RT Master Mix 2 μL,补充RNase Free dH2O至10 μL。进行实时荧光定量PCR实验,反应总体系为:2× PowerUp SYBR Green Master Mix 5 μL,正向引物和反向引物浓度为500nM,cDNA模板10 ng,补充ddH2O至10 μL。引物见表1。
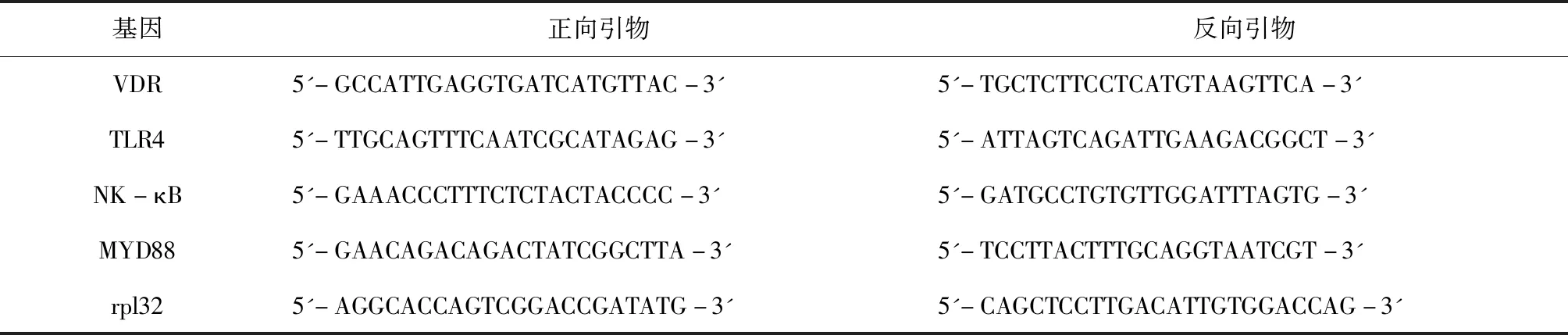
表1 PCR引物Table1 PCR primer
1.2.6 Western blot 实验
用RIPA裂解液提取细胞蛋白,用BCA法测定浓度;之后进行电泳、转膜,用5%脱脂奶粉封闭过夜(4℃)。室温孵育一抗抗体Claudin-1、Occludin和内参抗体GAPDH 2 h,洗膜。室温孵育二抗抗体2 h,洗膜,加入显影液后在显影仪器中曝光显影。
1.3 统计学方法
2 结果
2.1 用MTT法检测细胞生长情况
与空白对照组相比,加入LPS处理24 h的各组细胞存活率均有不同程度下降。在不同浓度1,25D3预处理的各组细胞间随着预处理1,25D3浓度的增加,细胞存活率呈现梯度增长趋势。见表2。
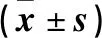
表2 细胞平均存活率及ELISA实验检测细胞上清中IFN-γ和IL-6浓度结果 Table2 Detection of the cell survival rate of IEC-6 by MTT experiment
#:与NC组比较,P<0.05;*:与LPS组比较,P<0.05;▲:与1nM组比较P<0.05;△:与10nM组比较,P<0.05;◆:与100nM组比较,P<0.05
2.2 用ELISA法检测细胞上清液中IL-6、IFN-γ表达情况
与空白对照组相比,LPS组细胞上清液中的IFN-γ和IL-6浓度显著上升(P<0.05)。用不同浓度1,25D3预处理72 h之后的各组细胞的上清液中IFN-γ和IL-6的浓度随着预处理1,25D3浓度的上升而逐渐下降,到达500nM后不再下降。见表2。
2.3 用实时荧光定量PCR情况
用LPS处理后,1,25D3预处理与未预处理各组间VDR、TLR4、MyD88、NF-κB mRNA的表达情况见表3。表3显示,TLR4、MyD88、NF-κB mRNA的表达水平经LPS刺激24 h后显著增高(P<0.05)。
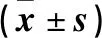
表3 VDR、TLR 4、NF-κB、MyD 88 mRNA的相对表达量 Table3 mRNA relative expression of
#:与NC组比较,P<0.05;*:与LPS组比较,P<0.05;▲:与1nM组比较,P<0.05;△:与10nM组比较,P<0.05;◆:与100nM组比较,P<0.05
2.4 紧密连接蛋白的Western blot结果
结果显示,LPS组紧密连接蛋白Occudin和Claudin-1较空白对照组表达减弱,200nM组紧密连接蛋白较LPS组表达有所增强。见图1。
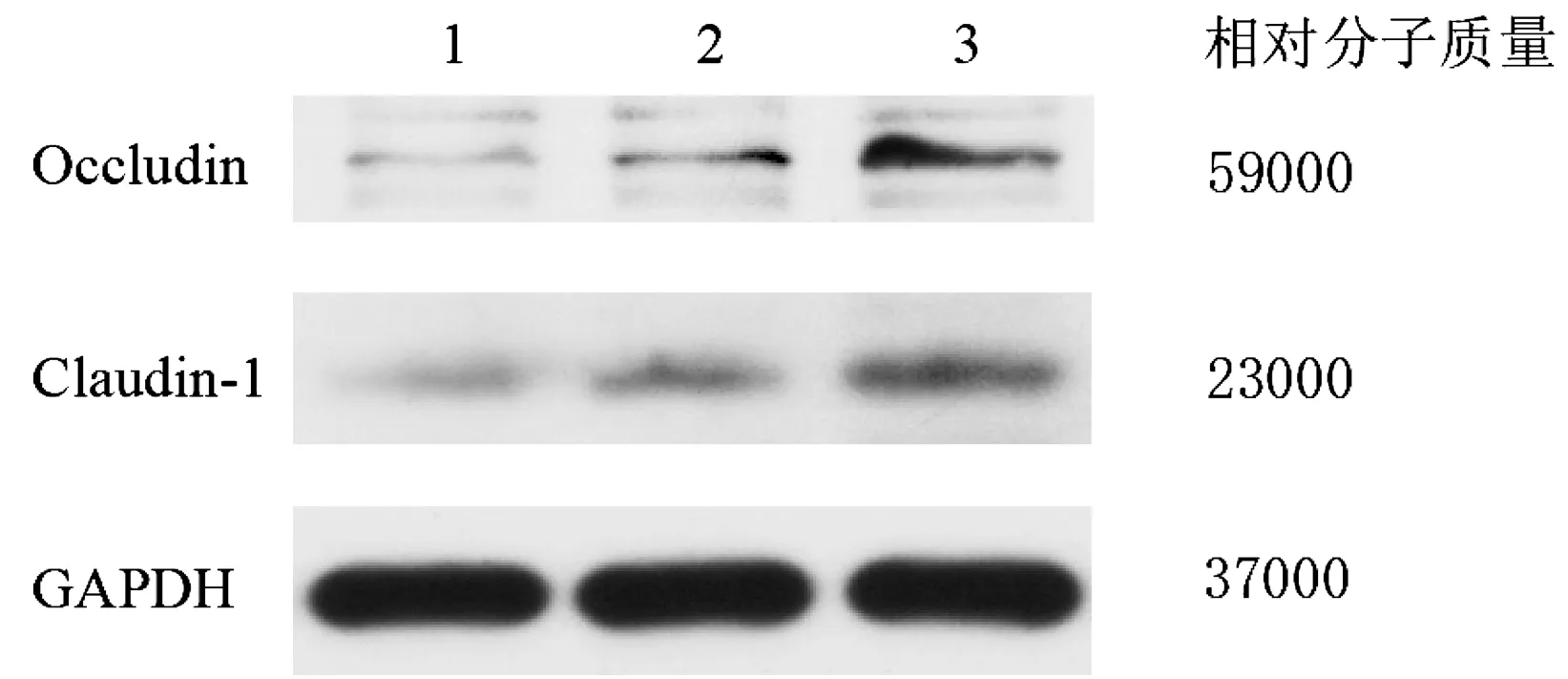
1:LPS组;2:200nM组;3:空白对照组
图1Occludin和Claudin-1蛋白表达图
Figure1The expression of Occludin and Claudin-1protein
3 讨论
本实验结果显示,在IEC-6细胞中,VDR可以通过抑制TLR4/NF-κΒ 信号通路,减少NF-κΒ的表达,从而减轻肠道炎症反应,保护肠粘膜。
炎症因子是反应炎症程度的重要指标,MTT实验可以反映细胞活力。因此本研究在体外用LPS诱导IEC-6细胞后,通过测量细胞上清中炎症因子浓度和细胞活力来验证体外炎症模型是否成功。实验结果显示,用LPS诱导IEC-6细胞成功建立了细胞炎症模型。之后,用1,25D3按照浓度从1nM至500nM预处理72 h,VDR mRNA呈现出梯度增加的趋势。随着VDR的上调,炎症反应得到了抑制,表现在ICE-6细胞分泌的相关炎症因子IFN-γ、IL-6以及TLR4/NK-κB信号通路上相关mRNA较空白对照组显著下降,并且细胞存活率上升。而在不同浓度1,25D3的处理下,根据浓度梯度,呈现出规律性变化。本实验观察到,随着1,25D3预处理浓度上升,对TLR4信号通路的抑制程度逐渐加强。到500nM后,与200nM相比无统计学差异(P>0.05)。我们认为,200nM是对IEC-6细胞的最适浓度。在幼建鲤肠道细胞中,给予1~200 pM 1,25D3,可以调节TLR4/NF-κΒ 信号通路,抑制LPS诱导的肠上皮细胞的炎症反应[5]。而在SKCO15细胞中,5~40nM 1,25D3可以保护紧密连接蛋白[6]。因此,在不同细胞中,1,25D3的有效浓度不同。
维生素D有抑制炎症反应的作用。已有实验证实维生素D在炎症性结肠癌细胞模型中减轻炎症的作用是通过TLR4通路介导的[7]。而VDR的减少会增加炎症风险[8],也会导致紧密连接蛋白Claudin-1、Occludin等的破坏[9,10],其机制是炎症反应激活了TLR4/NF-κB信号通路[11],破坏了肠屏障功能。在血管内皮细胞炎症模型中,上调VDR可以抑制炎症[12]。在溃疡性结肠炎的病人血清中,活性维生素D的浓度与炎症程度呈负相关[13]。在许多文献中也指出,VDR在NF-κB信号通路[14]和肠粘膜屏障的保护中有着至关重要的作用[15],这与本研究中所示紧密连接蛋白Occludin和Claudin-1表达情况相符。
综上所述,本实验初步证实了在IEC-6细胞中通过上调VDR,抑制了MyD88依赖的TLR4/NF-κB信号通路,减轻了炎症反应,从而保护了肠粘膜屏障。本研究仍有一些不足之处,首先,只在IEC-6细胞中做了相关干预,这不能证明VDR在其他肠道上皮细胞中也有相同的作用;其次,只对VDR进行了上调,没有对VDR进行沉默。
