基于不同共溶剂体系对于高电压正极材料LiCoPO4的形貌控制
2019-07-09柯剑煌谢凯韩喻孙巍巍罗世强刘锦锋
柯剑煌, 谢凯, 韩喻, 孙巍巍, 罗世强, 刘锦锋
基于不同共溶剂体系对于高电压正极材料LiCoPO4的形貌控制
柯剑煌, 谢凯, 韩喻, 孙巍巍, 罗世强, 刘锦锋
(国防科技大学 空天科学学院, 材料科学与工程系, 长沙 410073)
水分别与乙醇、乙二醇、二乙二醇混合为共溶剂, 通过溶剂热法制备高电压锂离子电池正极材料LiCoPO4, 研究不同醇类溶剂对于样品的微观形貌和颗粒尺寸的影响。借助X射线衍射、扫描电子显微镜和比表面积测试对样品的成分、晶型、微观形貌和颗粒尺寸进行分析。研究表明, 制备得到的LiCoPO4颗粒平均尺寸大小与醇类溶剂对于前驱体的溶解度差异相一致, 而与溶剂粘度没有明显联系。通过乙二醇/水制备得到的LiCoPO4颗粒呈六边形片状, 平均尺寸最小, 而通过乙醇/水和二乙二醇/水制备得到的LiCoPO4颗粒呈菱形片状形态。此外, 前者结晶度较高且循环性能较好, 0.05下首圈放电容量为130 mAh/g, 20圈后容量保留率为88%。
磷酸钴锂; 溶剂热法; 溶解度; 高电压正极材料; 锂离子电池
锂离子二次电池(LIB)自上世纪90年代初问世以来, 已经经历了近三十年发展, 因具有比能量高、循环性能好、自放电小等优点[1], 在医疗仪器电源、电动汽车(EV)动力电源、宇宙空间技术等各领域得到了广泛应用。现如今, 在众多锂离子电池的正极材料中, 聚阴离子型的正极材料因其优异的循环性能和热稳定性能得到了大量应用。
到目前为止, 人们所研究开发的聚氧阴离子型正极材料LiMPO4主要有LiFePO4(LFP)、LiCoPO4(LCP)、LiMnPO4(LMP)、LiNiPO4(LNP)、Li3V2(PO4)3(LVP)[2]。其中LFP和LMP在橄榄石-磷酸体系中研究得最为深入, 尤其是LFP, 作为最早被发现的橄榄石-磷酸体系正极材料, 目前已经被大量应用于各个领域。而LNP则由于电压工作平台过高(5.2~ 5.4 V)[3-4], 没有合适的电解液体系相匹配, 导致其研究与应用严重受阻。
LCP的理论比容量(170 mAh/g)与LFP (167 mAh/g)基本相当[5], 而工作电压平台相对较高(4.8 V), 所以其理论能量密度(800 Wh/kg)比LFP (578 Wh/kg)[6]高~40%。此外, 与LFP、LMP、LNP相比, LCP的空穴极化子迁移率最快, 即电子电导率最高[7]。与LiCoO2(Co: 60.2wt%)相比, LCP (Co: 36.6wt%)的钴元素含量更低, 导致其材料成本更低[8-9]。但是, 与LFP相似, 纯相LCP的电导率极低[10](~10–9S/cm), 基本属于绝缘体。此外, LCP的工作电压较高(4.8 V), 使得电解液容易分解且与体系内的Co3+发生反应, 从而影响LCP正极材料的电化学性能。
目前主流的解决方案有三种: (1) 对LCP正极材料进行表面包覆, 通过保护正极提高材料充放电性能[11]; (2) 通过Y3+[11]、Mg2+[12]、Mn2+[12-13]、Ni2+[12]、V3+[14]、Fe2+[15]等元素掺杂来提高材料的导电性; (3) 通过制备方法实现对LCP正极材料微观形貌的控制, 从结构上改善LCP的电化学性能。目前用于制备LCP的主流方法为水热/溶剂热法[16-18]、溶胶凝胶法[19-20]、固相反应法[21-22]、多元醇法[23]等, 其中, 水热/溶剂热法在样品的结晶度及微观形貌控制方面有很大优势。Ludwig等[16]通过微波加热溶剂热法, 使用不同共溶剂(水 : 醇类溶剂= 1 : 1(/)), 实现对LCP的微观形貌和颗粒尺寸的有效控制, 醇类溶剂包括乙二醇(EG)、二乙二醇(DEG)、三乙二醇(TEG)、四甘醇(TTEG)、聚乙二醇(PEG)和苯甲醇(BA)。六种LCP样品以0.1电流在3.5~5.2 V范围内的首圈放电容量在121~141 mAh/g。虽然二乙二醇的粘度明显高于乙二醇, 但是所制备得到的样品颗粒尺寸却明显大于后者, 但是作者并没有提出合理的解释。
基于此, 在本研究中, 首先在不同的共溶剂(水:醇类溶剂=1 : 1(/), 醇类溶剂包括乙醇(ET)、乙二醇(EG)及二乙二醇(DEG))中, 使用溶剂热法制备得到不同的片状LCP, 研究其晶体结构、微观形貌以及电化学性能方面的差异。而后结合前人研究, 分析了醇类溶剂在溶剂热法制备LCP过程中的影响。研究表明, 溶剂热法制备LCP的颗粒平均尺寸与所用溶剂粘度并没有严格的对应关系, 在某些体系中, 溶剂的溶解度因素占主导地位。
1 实验方法
1.1 材料的制备
将15 mmol 无水CoSO4(Aladdin, 99.998wt%), H3PO4(Aladdin, AR, ≥85wt%)和LiOH·H2O(Aladdin, AR, ≥95wt%)按照摩尔比1 : 1 : 3分散于60 mL的共溶剂H2O : M=1 : 1 ((/), M= ET, EG, DEG)当中, 并保持50 ℃的水浴加热磁力搅拌。体系多余的锂盐会与硫酸根结合: 3LiOH·H2O+CoSO4+H3PO4→LiCoPO4+ Li2SO4·H2O+5H2O。添加0.15 g抗坏血酸(Aladdin, ≥99.7wt%)作为体系的抗氧化剂, 防止Co2+在前驱液的制备过程中发生氧化形成Co3+。使用浓盐酸将前驱液pH调整至5.5~6.0, 并持续搅拌1 h, 而后转入100 mL聚四氟乙烯反应釜中, 密封后放入恒温鼓风干燥箱中, 以220 ℃反应5 h。待自然冷却后, 用去离子水和无水乙醇分别清洗3次, 而后在80 ℃下真空干燥12 h。将干燥后的样品在Ar气氛中以700 ℃烧结1 h (升温速率为1 ℃/min)。将制备得到的LiCoPO4样品根据所用的共溶剂分别记为: LCP- ET、LCP-EG、LCP-DEG。
1.2 材料表征
采用SIEMENS-500 X射线衍射分析仪(Cu-Kα,=0.154 nm, 扫描范围为2=10°~80°)对产物进行物相分析; 采用Hitachi S-4800型场发射扫描电子显微镜(FESEM)观察粉末的微观形貌和粒径; 采用V-Sorb 2800型BET测试仪分析材料的比表面积。
溶解度测试: 经由1.1所述步骤制备得到蓝色前驱液, 经离心处理后于180 ℃真空干燥24 h得到残留蓝色粉末样品, 称得其质量为i。溶剂溶解度由min(i)/i表示。
1.3 电化学性能测试
以上述实验方法制备得到的LCP作为正极材料、乙炔黑(Timal)作为导电剂、PVDF (Arkema)作为粘结剂、-甲基吡咯烷酮为溶剂, 按质量比7 : 2 : 1 : 40在球磨机中以400 r/min球磨1 h, 而后均匀涂覆在铝箔上, 120 ℃下真空干燥12 h后裁片得到LCP正极片。以金属锂片为负极, 泡沫镍为负极集流体, 1 mol/L LiPF6的碳酸乙烯酯/碳酸甲乙酯(体积比为3 : 7)为电解液, 在充满氩气的手套箱中组装成CR2016型扣式电池。在室温下, 采用LAND CT2001A型多通道充放电测试系统在3.0~5.0 V范围内以0.05的电流进行充放电测试。使用AUTOLAB PGSTAT30型电化学工作站进行循环伏安测试。
2 结果与讨论
2.1 XRD表征
图1为分别以乙醇、乙二醇、二乙二醇作为共溶剂组份制备得到的LCP粉末的XRD图谱。三者的XRD图谱衍射峰位置与标准ICSD卡片(No. 87422)的峰位相一致, 且没有杂质相(如Li3PO4和Co2P)存在。这表明通过溶剂热法制备得到的产物为纯的单相LCP粉末。
在聚阴离子型无机化合物体系内, 样品的XRD图谱中(020)晶面与(200)晶面对应衍射峰强比值(020)/(200)与样品微观形貌有关。当(020)晶面衍射峰更强时, 样品呈片状结构生长趋势更明显; 当(200)晶面衍射峰更强时, 样品呈针状结构生长趋势更明显[24]。三个体系制备得到的LCP正极材料XRD图谱的(020)/(200)值以及晶胞常数和晶胞体积结构如表1所示。
三种溶剂体系下制备得到的LCP正极材料与标准ICSD卡片对应样品的晶胞常数和晶胞体积相差不大, 与Bramnik等[25]和Ludwig等[16]得到的数值基本一致。LCP-EG样品的衍射峰尖锐且强度较强, 背底较为平整, 说明其结晶度比较高。三个样品的(020)/(200)值均较高, 显著高于常规水平, 这说明体系颗粒沿(020)晶面生长的趋势更为明显, 或者说, 体系中存在大量的(020)晶面。这也意味着颗粒在微观形貌上有向片状形态生长的趋势, 这与后文的SEM分析结果相一致。
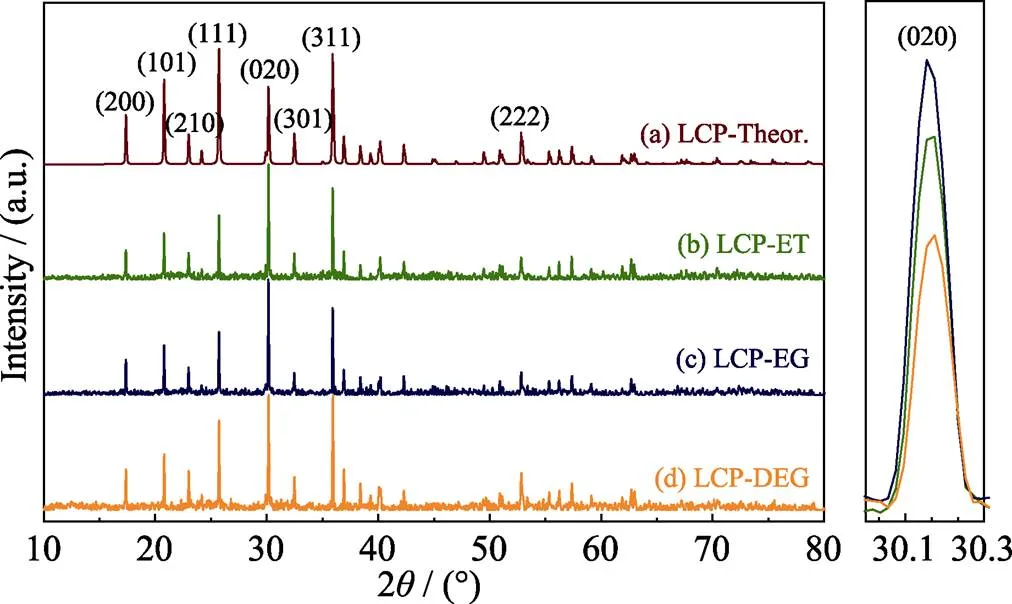
图1 不同溶剂下制得的LCP粉末的XRD图谱
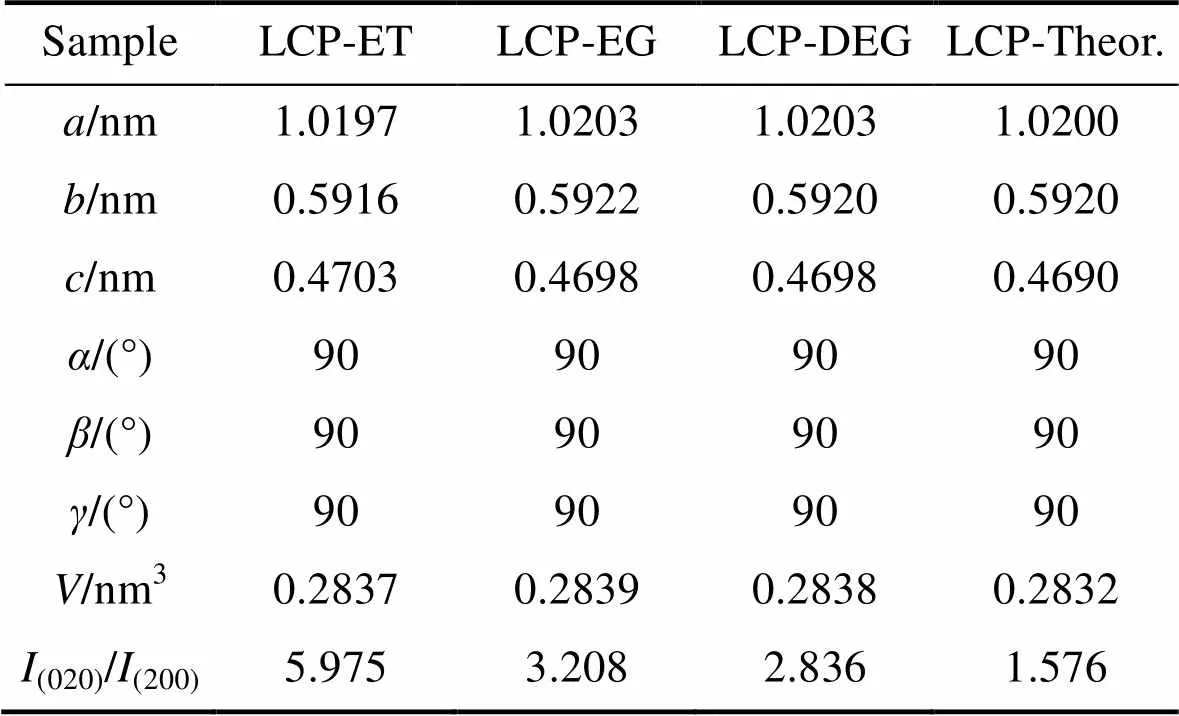
表1 不同溶剂下制得的LCP晶格参数
2.2 材料微观形貌分析
图2为不同溶剂体系中经溶剂热合成法制备得到的LCP粉末样品的扫描电镜照片。其中LCP-ET样品颗粒最大, 平均颗粒尺寸为8 μm×4.7 μm× 2.3 μm; LCP-DEG次之, 平均颗粒尺寸为7.5 μm× 4.5 μm× 1.7 μm; LCP-EG样品颗粒最小, 平均颗粒尺寸为5.5 μm×2.5 μm×1.3 μm。三种样品的平均颗粒尺寸大小对比结果与BET测试结果相一致, 如表2所示。此外, LCP-ET和LCP-DEG样品颗粒呈菱形片状, 而LCP-EG样品颗粒则呈六边形片状, 这与Ludwig等[16]的实验结果相同。关于通过乙二醇制备得到的样品颗粒呈现不同的微观形貌, 考虑可能是由乙二醇分子在高温高压下特殊的键合结果所致, 目前仍无较为完善的理论进行解释。
一般情况下, 比表面积能够客观反映样品的微观颗粒大小以及团聚状态, 同时, 比表面积的大小也决定了样品颗粒与电解液之间的接触面积大小。对于具有极低电导率的高电压正极材料LCP而言, 较高的比表面积对于体系锂离子的传递以及电化学性能的提高具有很大的帮助。但是比表面积较高的同时也就意味着电解液与样品在高电压下的接触反应更加剧烈, 电池的循环稳定性能更差。
从表3可得, DEG的粘度明显更高, 而ET的粘度则与水近似, 相对较低。通过DEG制备得到的LCP-DEG样品颗粒平均尺寸虽然比起LCP-ET更小, 却大于LCP-EG。很明显两者的大小关系并不对应。这说明溶剂的粘度并不会严格对应样品的平均颗粒尺寸, 在Ludwig等[16]的工作中也发现了同样的问题, 但没有给出合理的解释。

图2 不同溶剂下制得的LCP粉末的扫描电镜照片
(a, d) LCP-ET; (b, e) LCP-EG; (c, f) LCP-DEG

表2 三个样品的比表面积测试结果

表3 四种溶剂的物理参数
溶剂溶解度通过称量前驱液中残留未溶解的固相组份质量的方式得到, 具体方法见1.2。分别通过ET、EG、DEG制备得到的前驱液所残留未溶解的固相物质的质量分别为2.0251、1.3291、1.4814 g。相同条件下, 前驱液中的固相悬浊物含量越高, 对应着溶剂的溶解度越低。故而三种溶剂的溶解度对比结果为EG>DEG>ET。这一大小关系与通过三种溶剂制备得到的LCP样品颗粒平均尺寸大小关系相一致。粘度、溶解度与平均颗粒尺寸大小的关系示意图如图3所示。
图4为LCP样品在溶剂热法下形核和晶体长大的示意图。LCP的溶剂热法是一个溶解–再沉淀(均匀形核长大)的过程[26]。均匀混合的蓝色前驱液在高温高压下逐渐溶解(Step1), 大量原料以离子、离子团或分子团的形式存在于共溶剂当中。而后溶液中的离子、离子团或分子团与水分子、溶剂分子之间发生反应[27], 形成具有一定几何构型的聚合体, 即初始核心(Step2)。随着反应时间的延长, 剩余前驱体逐渐溶解, 同时, 体系内热力学稳定性较差的小颗粒也重新溶解, 而大颗粒逐渐长大。颗粒的长大遵循Ostwald熟化机理[28](Step3)。
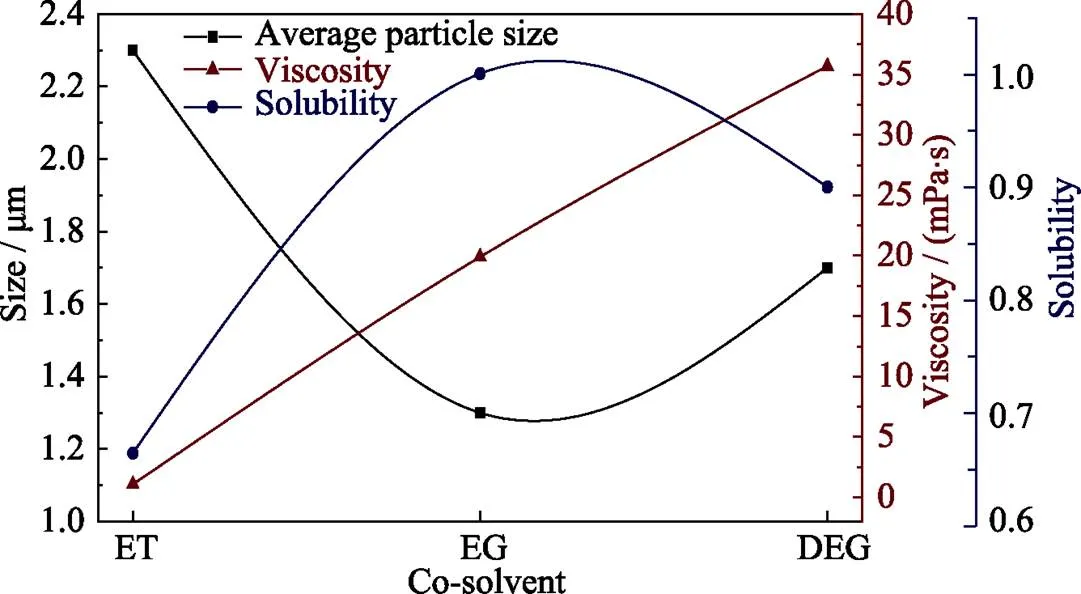
图3 不同溶剂制得的LCP粉末的平均颗粒尺寸与溶剂粘度、溶解度的关系曲线(平均颗粒尺寸以平均颗粒厚度为指标)
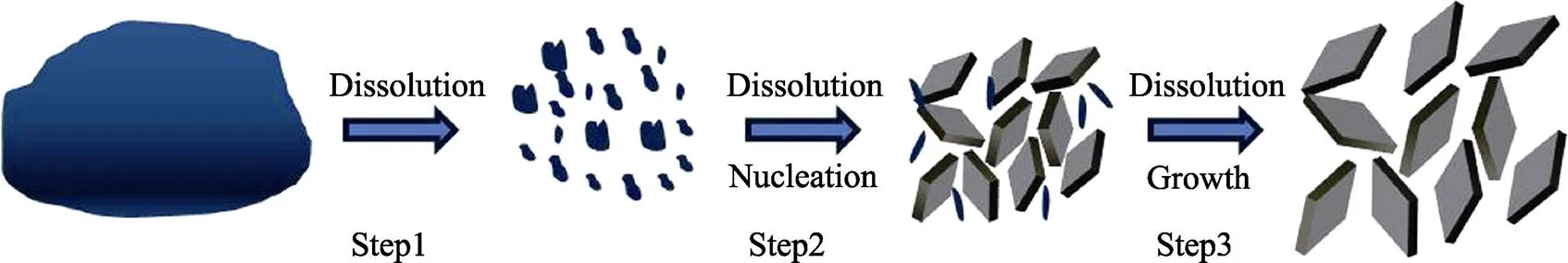
图4 溶剂热条件下LiCoPO4的形核和晶体长大示意图
在样品溶剂热结晶过程满足溶解–再沉淀机理(均匀形核长大)的前提下, 溶剂对于前驱体的溶解度越高会导致体系存在更高的形核率, 这意味着体系在同一时间会产生更多的核心。对于定量的前驱体而言, 体系在同一时间出现更多的核心意味着每个核心所能分配到的物质更少, 最终导致制备得到的样品平均颗粒尺寸更小。这就解释了虽然DEG的粘度明显高于EG, 但是所制备得到的LCP样品平均颗粒尺寸却更大的问题
2.3 电化学性能测试
图5(a)为三种正极材料以0.05电流在3.0~ 5.0 V电压范围内的循环性能测试结果。LCP-ET、LCP-EG、LCP-DEG的首圈放电容量分别为122、130、123 mAh/g。LCP-EG在20次充放电循环后, 放电容量仍能保持在114 mAh/g, 容量保持率为88%, 而LCP-ET和LCP-DEG在20次充放电循环后放电容量分别降到98、95 mAh/g, 容量保持率仅为80%和77%。图5(b)为三种正极材料分别以0.05、0.1、0.2、0.5、1电流(1=167 mAh)在3.0~5.0 V电压范围内的倍率性能测试结果。LCP-EG样品以1电流进行充放电时, 放电容量大致为首圈放电容量的16%, 而LCP-ET和LCP-DEG样品则基本不存在放电容量。从电化学性能测试结果可得LCP-EG对应电池的首圈放电容量以及循环稳定性明显更好, 倍率性能也相对较优。这得益于其良好的结晶性, 更高的比表面积以及更小的平均颗粒尺寸。更小的颗粒尺寸意味着正极混料过程中导电炭黑与材料的接触面积更大, 体系的电子导通通道构建更为完善, 有助于正极材料的氧化还原反应。此外, 更小的颗粒尺寸对应着正极材料与液态电解液之间的接触面积更大, 体系的锂离子导通通道构建更为完善, 有助于正极材料锂离子的脱嵌与嵌入。目前而言, 限制LCP性能发挥的主要因素有两点, 其一为LCP的橄榄石结构所决定的一维锂离子扩散通道[29], 导致了极低的电导率, 使得在充放电过程中电子无法及时传输, 锂离子无法及时脱嵌和嵌入, 这一问题可以通过合理的碳包覆得到一定的缓解; 其二为在LCP正极材料充放电过程的高电压下, 电解液发生氧化分解, 并与正极材料发生反应, 导致体系发生了不可逆变化[30]。

图5 在不同共溶剂下制得的(a) LCP循环性能及(b)倍率性能对比
图6(a)为三种正极材料在3.0~5.0 V电压范围内以0.05电流得到的首圈充放电曲线。在3.8~4.1 V范围内, 三种正极材料在充电过程中皆出现了一个明显的氧化平台, 从而导致首圈充电容量明显高于理论容量(167 mAh/g)。这是由于正极材料LCP处于高电压下在首圈充电过程中与体系的液态电解液之间发生了比较激烈的氧化还原反应, 并且主要以Li2CO3的形式不断累积沉淀在电极表面, 从而形成一层较为稳定的固体电解质界面膜(SEI膜)[31]。然而, 构成SEI膜的主要成分Li2CO3被发现当电压高于4.1~4.2 V时会发生电化学分解, 生成CO2[32-33]。加之橄榄石型LCP在脱锂过程(充电氧化过程)中会出现~8%的晶格体积收缩过程[34], 导致LCP颗粒可能会出现部分裂纹现象, 从而暴露更多的接触面, 促进与电解液的氧化分解过程。故而正极材料LCP在持续的充放电过程中, 体系的电解液会不断地发生氧化分解反应, 并在LCP表面生成不可逆的杂质相, 从而影响LCP容量以及循环稳定性。

图6 (a) 三个样品的首圈充放电曲线; (b) LCP-EG样品在0.05 mV/s速率下的循环伏安曲线
这一持续的电解液氧化分解现象通过LCP-EG样品的CV测试结果得以验证, 如图6(b)所示。LCP- EG样品在首圈CV测试过程中于4.13 V附近出现了一个明显的氧化峰, 且在随后的充电过程中仍然稳定存在。
此外, 图6(a)中三种正极材料都出现了明显的两步氧化(电解液的氧化除外)和两步还原的过程。这是由于在充放电过程中, 即LiCoPO4相与CoPO4相发生转变的过程中, 存在一个稳定的中间相作为两者的过度相, 即为LiCoPO4[35-36]。关于的值, Bramnik等[37-38]通过理论计算得到了为0.7, 即稳定的过渡相为Li0.7CoPO4。
3 结论
本文以乙醇、乙二醇、二乙二醇作为共溶剂组份通过溶剂热合成法制备得到了片状LiCoPO4样品。其中以乙二醇作为共溶剂组分制得的样品颗粒为六方形片状, 而其余两者皆为菱形片状。此外, 样品具有最小的颗粒尺寸和最大的比表面积, 电化学性能较为优异, 在0.05下首圈放电容量为130 mAh/g, 20圈后容量保留率为88%。通过三者颗粒尺寸上的差异分析得到醇类溶剂的粘度并非样品颗粒尺寸的决定性因素。从乙二醇到二乙二醇的溶剂变化中, 溶剂溶解度的影响占据了主导地位。故而, 醇类溶剂对于溶剂热样品微观形貌的影响是由多因素共同决定的。此外, LiCoPO4正极材料在3.8~4.1 V电压范围内存在明显的氧化反应, 这归因于高电压下电解液发生的分解, 且由于SEI膜主要成分Li2CO3的高电压溶解性以及LiCoPO4颗粒因晶格收缩可能产生微裂纹等原因, 电解液的分解在整个充放电过程中都会持续存在, 这在LiCoPO4的循环伏安测试中得到了验证。
[1] 黄可龙, 王兆翔, 刘素琴. 锂离子电池原理与关键技术. 北京: 化学工业出版社, 2008: 8.
[2] PADHI A K, NANJUNDASWAMY K S, GOODENOUGH J B. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries., 1997, 144(4): 1188–1194.
[3] WOLFENSTINE J, ALLEN J. LiNiPO4-LiCoPO4solid solutions as cathodes., 2004, 136(1): 150–153.
[4] WOLFENSTINE J, ALLEN J. Ni3+/Ni2+redox potential in LiNiPO4., 2005, 142(1/2): 389–390.
[5] MAEYOSHI Y, MIYAMOTO S, MUNAKATA H,. Enhanced cycle stability of LiCoPO4by using three-dimensionally ordered macroporous polyimide separator., 2017, 350: 103–108.
[6] DU CHENQIANG, TANG ZHIYUAN, XU QIANG. Research progress in preparing cathode material lithium cobalt phosphate., 2013, 43(5): 293–295.
[7] STROBRIDGE F C, CLEMENT R J, LESKES M,. Identifying the structure of the intermediate, Li2/3CoPO4, formed during electrochemical cycling of LiCoPO4., 2014, 26(21): 6193–6205.
[8] BRUTTI S, PANERO S. Recent advances in the development of LiCoPO4as high voltage cathode material for Li-ion batteries., 2013, 1140: 67–99.
[9] HOWARD W F, SPOTNITZ R M. Theoretical evaluation of high- energy lithium metal phosphate cathode materials in Li-ion batteries., 2007, 165(2): 887–891.
[10] WOLFENSTINE J. Electrical conductivity of doped LiCoPO4., 2006, 158(2): 1431–1435.
[11] 栗欢欢. 新型5V锂离子二次电池正极材料LiCoPO4的制备与改性研究. 天津: 南开大学硕士学位论文, 2009.
[12] KISHORE M V V M S, VARADARAJU U V. Influence of isovalent ion substitution on the electrochemical performance of LiCoPO4., 2005, 40(10): 1705–1712.
[13] LI HUANHUAN, YANG XIAOLIANG, WEI JINPING. Effect of Mn2+doping on electrochemical performance of LiCoPO4., 2008, 14: 210–212.
[14] KREDER K J, MANTHIRAM A. Vanadium-substituted LiCoPO4core with a monolithic LiFePO4shell for high-voltage lithium-ion batteries., 2017, 2(1): 64–69.
[15] JANG I C, SON C G, YANG S M G,. LiFePO4modified Li1.02(Co0.9Fe0.1)0.98PO4cathodes with improved lithium storage properties., 2011, 21(18): 6510–6514.
[16] LUDWIG J, MARINO C, HAERING D,. Morphology- controlled microwave-assisted solvothermal synthesis of high-performance LiCoPO4as a high-voltage cathode material for Li-ion batteries., 2017, 342: 214–223.
[17] WANG F, YANG J, NULI Y N,. Novel hedgehog-like 5 V LiCoPO4positive electrode material for rechargeable lithium battery., 2011, 196(10): 4806–4810.
[18] PENG L, ZHANG X, FANG Z,. General facet-controlled synthesis of single-crystalline {010}-oriented LiMPO4(M=Mn, Fe, Co) nanosheets., 2017, 29(24): 10526– 10533.
[19] NI J P, WANG H B, GAO L J,. A high-performance LiCoPO4/ C core/shell composite for Li-ion batteries., 2012, 70: 349–354.
[20] JAYAPRAKASH N, KALAISELVI N, PERIASAMY P. A preliminary investigation into the new class of lithium intercalating LiNiSiO4cathode material., 2008, 19(2): 025603–1–5.
[21] JIN B, GU H B, KIM K W. Effect of different conductive additives on charge/discharge properties of LiCoPO4/Li batteries., 2007, 12(2): 105–111.
[22] YOSHIDA J, NAKANISHI S, IBA H,. Effect of carbon composite on manganese phosphate particles for lithium ion battery properties., 2011, 48: 389–395.
[23] WANG F, YANG J. Synthesis and electrochemical performance of nano LiCoPO4by polyol method., 2013, 19(6): 585–588.
[24] DOKKO K, KOIZUMI S, NAKANO H,. Particle morphology, crystal orientation, and electrochemical reactivity of LiFePO4synthesized by the hydrothermal method at 443 K., 2007, 17: 4803–4810.
[25] BRAMNIK N N, NIKOLOWSKI K, BAEHTZ C,. Phase transitions occurring upon lithium insertion-extraction of LiCoPO4., 2007, 19(4): 908–915.
[26] WU B R, XU H L, MU D B,. Controlled solvothermal synthesis and electrochemical performance of LiCoPO4submicron single crystals as a cathode material for lithium ion batteries., 2016, 304: 181–188.
[27] 仲维卓. 人工水晶, 2版. 北京: 科学出版社, 1994: 515.
[28] OSTWALD W Z. Über die vermeintliche isomerie des roten und gelben quecksilberoxyds und die oberflächenspannung fester körper., 1900, 34: 495–503.
[29] THACKERAY M. Lithium ion batteries: an unexpected conductor., 2002, 1(2): 81–82.
[30] MANZI J, BRUTTI S. Surface chemistry on LiCoPO4electrodes in lithium cells: SEI formation and self-discharge., 2016, 222: 1839–1846.
[31] AURBACH D, MARKOVSKY B, SALITRA G,. Review on electrode–electrolyte solution interactions, related to cathode materials for Li-ion batteries., 2007, 165(2): 491–499.
[32] JOHNSON L, LI C, LIU Z,. The role of LiO2solubility in O2reduction in aprotic solvents and its consequences for Li-O2batteries., 2014, 6(12): 1091–1099.
[33] FREUNBERGER S A, CHEN Y, DREWETT N E,. The lithium- oxygen battery with ether-based electrolytes., 2011, 50(37): 8609–8613.
[34] BRUTTI S, PANERO S. Recent advances in the development of LiCoPO4as high voltage cathode material for Li-ion batteries., 2013, 1140: 67–99.
[35] NAKAYAMA M, GOTO S, UCHIMOTO Y,. X-ray absorption spectroscopic study on the electronic structure of Li1–xCoPO4electrodes as 4.8 V positive electrodes for rechargeable lithium ion batteries., 2005, 109: 11197–11203.
[36] EHRENBERG H, BRAMNIK N N, SENYSHYN A,. Crystal and magnetic structures of electrochemically delithiated Li1−xCoPO4phases., 2009, 11(1): 18–23.
[37] BRAMNIK N N, BRAMNIK K G, BUHRMESTER T,. Electrochemical and structural study of LiCoPO4-based electrodes., 2004, 8: 558–564.
[38] BRAMNIK N N, BRAMNIK K G, BAEHTZ C,. Study of the effect of different synthesis routes on Li extraction–insertion from LiCoPO4., 2005, 145: 74–81.
Morphology Controlling of the High-voltage Cathode Materials with Different Co-solvents
KE Jian-Huang, XIE Kai, HAN Yu, SUN Wei-Wei, LUO Shi-Qiang, LIU Jin-Feng
(Department of Material Science and Engineering, College of Aeronautics and Astronautics, National University of Defense Technology, Changsha 410073, China)
Cathode material LiCoPO4was synthesized by solvothermal method with a variety of water/alcohol solvent mixtures, including ethanol (ET), ethylene glycol (EG), and diethylene glycol (DEG). Focus of this work was set on the effect of the different alcohol solvent on morphology and particle size of material. Composition, crystal structure, morphology and particle size of the as-prepared samples were characterized by X-ray-diffraction, scanning electron microscopy and specific surface area test. The results show that relationship of the average particle size of the LiCoPO4samples synthesized with different alcohols solvents is in agreement with solubility of solvent for the precursor, but is inconsistent with the viscosity of solvent. Furthermore, LiCoPO4sample synthesized with EG/H2O possesses the smallest particle size, great crystallinity and excellent cycle performance. Its initial discharge specific capacities reaches to 130 mAh/g at 0.05, and it shows a capacity retention of the initial value of 88% in 20th cycle. A variety of shapes are obtained from various co-solvents: hexagonal platelets for LiCoPO4obtained from EG, whereas, square platelets for LiCoPO4from ET/H2O and DEG/H2O.
lithium cobalt phosphate; solvothermal synthesis; solubility; high-voltage cathode; lithium-ion battery
TB911
A
1000-324X(2019)06-0618-07
10.15541/jim20180425
2018-09-13;
2019-01-10
博士后面上基金(2018M33664); 博士后创新人才计划(BX201700103)China Postdoctoral Science Foundation (2018M33664); National Postdoctoral Program for Innovative Talents (BX201700103)
柯剑煌(1994–) , 男, 硕士研究生. E-mail: qwe512993975@163.com
韩喻, 副教授. E-mail: yumihan1981@yahoo.com.cn
