水稻田铁氧化菌的丰度及微生物群落结构组成
2019-07-08狄霖刘玲玲钟志仁黄顾林盛海君王娟娟朱友理
狄霖 刘玲玲 钟志仁 黄顾林 盛海君 王娟娟 朱友理
摘要:水稻土中铁氧化物的存在对于土壤中的重金属离子及有机污染物有较强的吸附固定能力,研究参与其形成的微生物有重要的生态意义。分别采用浓度梯度试管富集培养不同水稻根部土壤中的铁氧化菌,用最大可能数(most probable number,简称MPN)方法计算其丰度;测定土壤主要微生物群落结构,并结合各种土壤理化因素进行多元生态统计分析。结果表明,几种不同肥力的水稻土中可培养的微好氧铁氧化细菌数平均达169万个/g,其丰度与土壤pH值呈正相关,而与其他主要土壤理化性质没有显著相关性。在门的水平上,所测样品中以Proteobacteria(变形菌门)为主要类别,平均占细菌总量的46.35%。在属水平上,则以Nitrospira(硝化螺旋菌属)、Anaeromyxobacter(厌氧黏细菌)、Geobacter(地杆菌属)、Anaerolinea(厌氧绳菌属)等为主,代表性的铁氧化菌Gallionella(披毛菌属)在所有相对丰度中排名第7,达2.2%。总体而言,各种样品的理化性质相近,但是微生物群落的结构差异较大,其分布受到样品理化性质的影响较为复杂。
关键词:水稻土;铁氧化细菌;微生物群落结构;丰度
中图分类号: S182 文献标志码: A 文章编号:1002-1302(2019)10-0296-05
铁(Fe)是地球表面丰度排名第2的金属元素,普遍存在于各种土壤中。铁在自然界中的主要存在形态为二价铁[Fe(Ⅱ)]与三价铁[Fe(Ⅲ)],前者可以通过化学过程与微生物作用,由铁氧化生成Fe(Ⅲ)氧化物[1]。铁的氧化物、氢氧化物在自然界中以多种形态存在,铁氧化物及其氢氧化物具有特殊的电化学性质、较大的比表面积和丰富的—OH功能团,可与多种离子发生吸附-解吸反应,对重金属离子及有机污染物在地表环境中的迁移和沉淀均有重要影响。由微生物活动而产生的铁氧化物,因其巨大的比表面积并可与微生物有机体、各种有机代谢物结合,对土壤中包括重金属在内的多种污染物有较强的吸附能力,在修复、净化污染土壤的研究中受到相当多的关注[2-4]。研究表明,约有50%~90%的铁氧化物是由微生物活动形成的[5-6]。
水稻在农业生产中占有非常重要的地位,水稻田是具有重大经济意义的土壤资源,因其灌溉条件特殊,水稻田中的重金属,特别是砷(As)、镉(Cd)等的污染比其他农田严重,从而严重威胁到粮食安全。研究表明,水稻如果长期生长在淹水环境中,厌氧土壤中大量存在的Fe(Ⅱ)会被水稻根系分泌的氧气、氧化性物质氧化成三价铁并沉积在水稻根表及质外体[7]。这些铁氧化物可以对植物吸收和运输重金属元素起到阻碍作用,其形成过程与环境生态效应已经引起许多研究者的重视[8-9]。关于根表铁膜对养分的富集、吸附和重金属污染的控制问题,已经有较多的报道。如有报道表明,水稻根表铁与镉的吸收有一定的关系[10-12]。研究表明,水稻田中毒性较大的三价砷含量与铁氧化菌数量呈反相关[13]。在微生物氧化鐵的过程中,三价砷[As(Ⅲ)]同时被氧化成五价砷[As(Ⅴ)],从而降低砷的移动性[14]。然而,有关铁氧化菌在不同稻田的分布情况及其受环境因子影响的报道仍较为缺乏。
pH值是决定铁循环的关键因素,在近中性环境且有氧的条件下,化学氧化过程尤为迅速,铁氧化细菌必须与非生物铁氧化过程竞争二价铁源。随着pH值的下降,微生物在铁氧化物形成过程中的作用更加明显。近年来,研究者发现在弱酸性条件(pH值为5~6)下,有一类微生物喜好亚铁源的微氧环境,如湿地植物根际[15-17],并可能在铁氧化过程中起主要作用。关于水稻土铁氧化微生物受pH值影响的研究具有重要意义。此外,铁氧化微生物也会影响土壤微生物的丰度、活性、微生物生物量和微生物群落结构[18-19],而土壤微生物则对土壤肥力的改善起到积极作用。关于水稻土肥力对铁氧化菌的影响尚未见报道。
本研究选择铁元素含量相对较高的水稻田,根据有机质与其他养分含量,将其分为3种不同的肥力,采集水稻根部附近的土壤,测定其细菌群落结构及参与铁氧化过程的主要细菌种类与丰度,旨在比较不同水稻田微生物群落结构与环境因素之间的关系,了解富铁稻田主要微生物的群落结构,从而为进一步明确微生物在铁氧化物生成及重金属吸附过程中的作用提供理论参考。
1 材料与方法
1.1 样品采集
水稻土样品于2016年10月25日采自镇江市丹徒区(位于31°42′00″N~32°12′0″N,119°0′0″E~119°4′0″E范围内的区域)。该区水稻田多为水稻土,由于灌水和季节性的降水,使地下水位反复升降,造成土壤干湿交替频繁,氧化和还原过程不断更替,耕作层含铁量极高,红棕色铁锈常见于水稻根表与近表层土壤。在本样区选择6块水稻田(编号为S1~S6),其中S3、S5为低肥力地块,S1、S4为中肥力地块,S2、S6为高肥力地块。每块田采用五点法取水稻根附近0~10 cm土层的样品,混匀,再抽取3个重复的样品。每个土壤样品分为3个部分保存,一部分保存在冷却箱内,用于铁细菌的培养与丰度的测定,另外一部分用于DNA分离及测序的样品立刻用干冰冷冻保存,其他土壤则风干保存,用于常规理化性质的测定。
1.2 微好氧铁氧化细菌的富集培养与最大可能数(most probable number,简称MPN)的测定
微好氧铁氧化细菌生长速度较慢,且对氧气、营养浓度的要求较高。采用改进的半固态梯度管(15 mL)进行培养。该系统由2个部分组成:试管的底部为FeS与同体积的改良MWMM培养基的混合物,并添加1%琼脂糖;试管上部为半固态,含MWMM、Wolfe维生素与矿质元素以及0.15%琼脂糖。在做准备培养制备梯度试管时,将上、下部分别高压灭菌后,先在试管中加入1 mL热的FeS与MWMM混合培养基,待其冷却凝固。在上部培养基中于灭菌前先加入最终浓度为 5 mmol/L 的碳酸氢钠,高压灭菌后冷却至50 ℃左右,用过滤无菌的二氧化碳、氮气混合气体(体积比为3 ∶ 7)吹气,调节培养基的pH值至 5.5~6.0,加入维生素与矿质元素。等底部含亚铁的培养基凝固后,在每个试管中加入9 mL上部培养基。待浓度梯度试管准备好后,冷藏24 h即可接种。将土壤按1~10倍浓度梯度依次稀释到0.9% NaCl溶液中。根据经验,该细菌在环境中的数量不超过108倍稀释液,所以将土壤稀释到109倍液。取约10 μL稀释液接种,空白对照用 10 μL 0.9% NaCl溶液替代,每个浓度、每种培养基重复3次。将接种好的试管于25 ℃培养室中进行无光照培养。当上层培养基出现膜状橙红色的铁氧化物条带,则表示有细菌生长,同时用显微镜观察验证细菌的生长情况。
1.3 土壤微生物群落的结构分析
称取0.3 g样品用于DNA分析,采用PowerSoil DNA提取试剂盒提取DNA。采用通用细菌引物515F、806R扩增16S rRNA基因的V4区片段。PCR产物经检验合格后,通过Hiseq2500平台(美国Illumina公司)进行测序。去除Barcode及引物序列后,通过Qiime软件对初始序列进行过滤与质量控制,再利用Uparse软件(Uparse v7.0.1001)对所有样品进行聚类。用RDP Classifier(Version 2.2)方法与GreenGene数据库进行物种注释分析,得到不同分类水平的比例。
1.4 样品理化指标分析
理化指标的分析方法参照《土壤农化分析》。土壤pH值采用pH计法测定,水土比为2.5 mL ∶ 1 g。土壤有机质含量采用重铬酸钾容量法-外加热法测定;全氮含量采用凯氏法测定;速效磷含量采用0.5 mol/L NaHCO3浸提-钼锑抗分光光度法测定;速效钾含量采用1.0 mol/L NH4OAc浸提-火焰光度法测定。土壤有效重金属浓度用0.05 mol/L DTPA(二乙基三胺五乙酸)提取,再用原子吸收法测定。土壤中生物有效铁浓度用 0.5 mol/L HCl提取,再用啉啡罗琳方法测定[20]。
1.5 数据分析
数据图表的生成用Excel 2010。单因素方差分析用OriginPro 9软件,样品间差异分析用Fisher最小显著性差异法(LSD),其中P<0.05表示差异显著。用生态统计分析软件Canoco 5.0来分析样品微生物群落结构与环境因素的相关性。
2 结果与分析
2.1 土壤理化性状
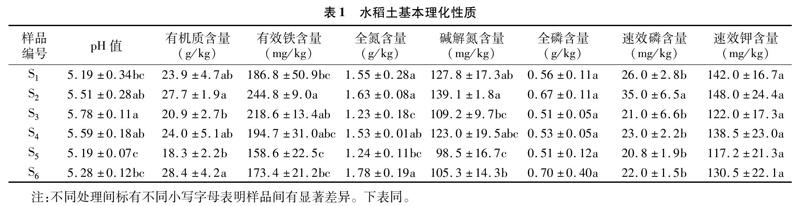
从表1可以看出,所测樣点土壤的pH值介于5.1~5.8之间,均为弱酸性。土壤有机质含量为18.3~27.7 mg/kg,其中样品S2的含量显著高于S3、S5的含量。各处理样品的总铁含量均较高,有效铁含量最高达244.8 mg/kg,且部分样点之间差异显著。样品全氮含量平均为1.49 g/kg。碱解氮含量平均为 117.2 mg/kg,占总氮的10%左右,除了样品S5的含量较低(98.5 mg/kg),S2最高(139.1 mg/kg),其余水稻土的碱解氮含量差异不明显。土壤速效磷含量平均为 24.6 mg/kg,速效钾含量平均为133.0 mg/kg,大部分样品间差异不显著。
2.2 水稻根部可培养铁氧化细菌的丰度
如图1所示,利用浓度梯度试管培养的方法,6个水稻土样品均有微好氧铁氧化细菌生长,平均数量为1.69×106个/g。其中S3、S4处理的铁氧化细菌丰度明显高于S1、S2处理,分别达到3.04×106、3.2×106个/g,而S5、S6处理则介于其中,与其他样品间的差异不大。铁氧化细菌的数量与土壤pH值呈正相关(Pearson相关系数为0.9,r2=0.81)。而铁细菌丰度与土壤有效铁浓度之间无相关性,也不受其他土壤性质如有机质、氮磷钾含量等的影响。
2.3 水稻根系微生物群落的结构分析
从图2-a可以看出,在门的水平上,所有样品中Proteobacteria(变形菌门)为主要成分,平均占总细菌总量的46.35%。其他重要细菌包括Acidobacteria(酸杆菌门)、Chloroflexi(绿弯菌门)、Planctomycetes(浮霉菌门)等。各样品的细菌组成在门级上有所差异,虽然上述细菌在所有样品中均被检测到,但是其所占比例差异悬殊,其中样品S2中绿弯菌门所占比例远高于其他样品的总和。
对样品的16S序列进行进一步分析发现,在细菌属级水平上,各样品的差异更大(图2-b)。总的来说,Nitrospira(硝化螺旋菌属)、Anaeromyxobacter(厌氧黏细菌属)、Geobacter(地杆菌属)、Anaerolinea(厌氧绳菌属)、Rhodoplanes(红游动菌属)等为主要的细菌种类。主要代表性铁氧化菌Gallionella(披毛菌属)在所有测定序列中相对丰度排名第7,达2.2%;主要代表性铁还原菌地杆菌属则约占总序列的7.3%。
2.4 不同处理下水稻根部土壤的重金属含量
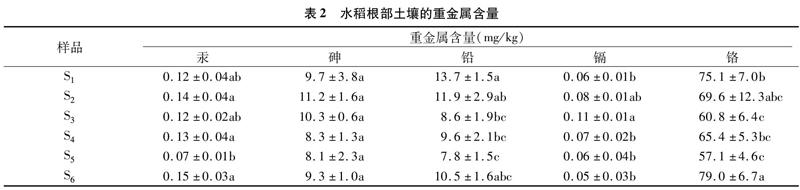
由表2可以看出,铬含量在所有金属中最高,平均达到67.83 mg/kg,其次为铅,含量为7.8~13.7 mg/kg。样品平均砷含量为9.48 mg/kg,而平均汞含量则为 0.12 mg/kg。土壤镉含量介于0.05~0.11 mg/kg之间,平均为 0.07 mg/kg。总体而言,不同样品的重金属含量之间差异较小,只有样品S5的含铬量明显低于其他样品。
2.5 环境因素对水稻土微生物结构的影响
采用冗余分析(redundancy analysis,简称RDA)对不同样点的细菌群落结构与部分环境因素之间的关系进行分析。由图3可见,样品S3、S5、S6的细菌群落结构在门级水平上较为相似,其他样点间的差异则较大。图3中的前2个轴线(横向、纵向)可分别解释总变化45.7%中的28.3%,说明分析结果比较可靠。在各种已知环境因素中,样品S3、S5、S6的细菌群落结构受pH值的影响相对较大,而样品S2的细菌群落组成则与其他养分因子有机质、全氮、速效磷、速效钾等含量的相关性较好,与样品pH值呈反相关。样品S1的细菌群落组成与S4明显不同,且均不受所测环境因子的影响。从RDA分析结果可以推测,土壤的养分供应状况总体上与其细菌群落结构没有显著相关性。
3 讨论与结论
近年来,越来越多的学者们对植物根系,尤其是水稻根系的铁氧化与还原微生物进行了研究。结果表明,微生物在调控环境铁氧化物形成方面起着不可忽视的作用。本研究发现,水稻根部土壤样品中可培养铁氧化菌含量达169万个/g,且高通量测序结果显示,近2%的微生物与铁氧化细菌有关。Weiss等对13个样品25种植物的分析结果表明,铁细菌在湿地植物的根际中普通存在,其平均密度达105 cells/g。铁细菌数量与铁氧化物浓度虽然没有显著的相关性,但是研究者在氧化铁含量最低的地方发现了相对数量最少的铁细菌[21]。本研究并没有发现铁氧化菌的丰度与有效铁含量有关,这一方面可能是由于土壤中有效铁含量较高,远超过铁氧化菌所需;另一方面,土壤氧化态铁与有效铁含量并不是呈正相关关系。今后的试验主要需要测定氧化态铁的含量与形态。
研究者发现,以Gallionella(披毛菌属)为代表的铁氧化菌广泛存在于弱酸性条件下(pH值为5~6)[22]。本试验发现,Gallionella为最主要的变形杆菌之一,此外还有Siderooxydans、Thiobaccillus(硫杆菌属)等铁氧化菌。可培养微好氧化铁氧化菌以及与铁氧化菌相关的16S rRNA基因的拷贝数均与土壤pH值呈显著正相关。可见,在含铁量较高的酸弱性水稻土壤中,随着pH值的升高,土壤中铁氧化细菌的相对丰度也随之提高。而对于由有机质代表的各土壤肥力指标,与所测铁氧化菌的丰度并无相关性。
由于植物根系的呼吸作用,根部各种生理生化过程均比较迅速。铁元素的循环也是一个动态过程 其中铁的氧化和还原总是同时发生的。三价铁的形成,尤其是非结晶态铁,为铁还原菌提供了电子受体。Weiss等发现,香蒲根际近12%的菌群为铁还原细菌,而本试验发现,铁还原菌包括厌氧黏细菌、地杆菌的16S rRNA序列占序列总数的比例较高[23]。根系在生长过程中会产生各种有机物,其中小分子有机酸如乙酸的含量较高,且在淹水条件下其浓度会大幅增加。这些为包括Geobacter spp.在内的铁还原菌的生长创造了有利条件[24]。水稻根尖的泌氧作用使得铁(Ⅱ)被氧化,同时消耗O2,产生厌氧条件。铁还原菌则利用还不稳定的无定形态三价铁与根系附近大量的有机碳源进行三价铁还原,这个循环过程在根的旺盛生长期应该是持续进行的,而在水稻生长发育初期、成熟后期,尤其是在后期,大多数老根开始衰亡腐解,造成局部的强还原状态。前人研究表明,在水稻生长后期,水稻根际铁氧化物与重金属的相关性较小[25]。本试验发现,可培养的铁还原菌总数高于铁氧化菌,可能与样品采集于水稻成熟期有关。如进一步研究不同水稻生长季节根际微区内各种微生物的群落结构与活性,且根据土壤的实际理化性质增加培养基种类,以尽可能覆盖可培养铁细菌的范围,将更有利于解释铁循环进程的速率变化,并更精确地定量微生物在铁氧化物生成过程中的作用。
在水稻根际形成的铁氧化物,由于其特殊的表面物理与化学结构,对环境中各种重金属与有机污染物有较强的吸附作用[3,26],该过程可能会阻止污染进入水稻体内。田间观察结果发现,水稻土中的铁块/斑的数量与分布差异较大。在同一取样点,铁斑的垂直分布也有所不同。此外,总铁氧化微生物的丰度与重金属污染物之间的关联较小。该方面的影响可以通过对土壤剖面不同深度的微生物与重金属的分布情况作进一步探究。
综上所述,本试验结果发现,弱酸性水稻田铁氧化与还原细菌丰度较高,为微生物群落的主要组成部分。尽管不同采样点土壤的理化性质相似,其微生物群落组成却有所差异。各采样点可培养的铁还原细菌丰度略高于铁氧化细菌,这2类微生物含量均与土壤pH值呈正相关,而不受土壤肥力状况及土壤有效铁含量影响。在本试验条件下,土壤中铁氧化细菌丰度与重金属含量之间并无显著相关性。
参考文献:
[1]Lovley Derek R. Dissimilatory Fe(Ⅲ)-and Mn(Ⅳ)-reducing prokaryotes[J]. Prokaryotes,2006,2:635-658.
[2]Fortin D. What biogenic minerals tell us[J]. Science,2004,303(5664):1618-1619.
[3]胡 敏,李芳柏. 土壤微生物铁循环及其环境意义[J]. 土壤学报,2014,51(4):683-698.
[4]傅友强,于智卫,蔡昆争,等. 水稻根表铁膜形成机制及其生态环境效应[J]. 植物营养与肥料学报,2010,16(6):1527-1534.
[5]Neubauer S C,Emerson D,Megonigal J P. Life at the energetic edge:kinetics of circumneutral iron oxidation by lithotrophic iron-oxidizing bacteria isolated from the wetland-plant rhizosphere[J]. Applied and Environmental Microbiology,2002,68(8):3988-3995.
[6]Hu M,Li F B,Lei J,et al. Pyrosequencing revealed highly microbial phylogenetic diversity in ferromanganese nodules from farmland[J]. Environmental Science-Processes & Impacts,2015,17(1):213-224.
[7]楊旭健,傅友强,沈 宏,等. 水稻根表铁膜及其形成的形态、生理及分子机理综述[J]. 生态学杂志,2014,33(8):2235-2244.
[8]Kgel-Knabner I,Amelung W,Cao Z H,et al. Biogeochemistry of paddy soils[J]. Geoderma,2010,157(1):1-14.
[9]邢承华,蔡妙珍,刘 鹏,等. 植物根表铁锰氧化物胶膜的环境生态作用[J]. 生态环境,2006,15(6):1380-1384.
[10]杨俊兴,郭庆军,郑国砥,等. 赤泥条件下水稻根际铁膜形成及镉吸收机理研究[J]. 生态环境学报,2016,25(4):698-704.
[11]刘侯俊,胡向白,张俊伶,等. 水稻根表铁膜吸附镉及植株吸收镉的动态[J]. 应用生态学报,2007,18(2):425-430.
[12]Wang M E,Chen W P,Peng C. Risk assessment of Cd polluted paddy soils in the industrial and township areas in Hunan,Southern China[J]. Chemosphere,2016,144:346-351.
[13]Chen X P,Zhu Y G,Hong M A,et al. Effects of different forms of nitrogen fertilizers on arsenic uptake by rice plants[J]. Environmental Toxicology and Chemistry,2008,27(4):881-887.
[14]王兆苏,王新军,陈学萍,等. 微生物铁氧化作用对砷迁移转化的影响[J]. 环境科学学报,2011,31(2):328-333.
[15]Kato S,Chan C,Itoh T,et al. Functional gene analysis of freshwater iron-rich flocs at circumneutral pH and isolation of a stalk-forming microaerophilic iron-oxidizing bacterium[J]. Applied and Environmental Microbiology,2013,79(17):5283-5290.
[16]Wang J J,Muyzer G,Bodelier P L. Diversity of iron oxidizers in wetland soils revealed by novel 16S rRNA primers targeting Gallionella-related bacteria[J]. ISME Journal,2009,3(6):715-725.
[17]Luedecke C,Reiche M,Eusterhues K,et al. Acid-tolerant microaerophilic Fe(Ⅱ)-oxidizing bacteria promote Fe(Ⅲ)-accumulation in a fen[J]. Environmental Microbiology,2010,12(10):2814-2825.
[18]Chu H Y,Lin X,Fujii T,et al. Soil microbial biomass,dehydrogenase activity,bacterial community structure in response to long-term fertilizer management[J]. Soil Biology & Biochemistry,2007,39(11):2971-2976.
[19]Gu Y F,Zhang X P,Tu S H,et al. Soil microbial biomass,crop yields,and bacterial community structure as affected by long-term fertilizer treatments under wheat-rice cropping[J]. European Journal of Soil Biology,2009,45(3):239-246.
[20]Kostka J E,Luther G W. Partitioning and speciation of solid-phase iron in salt-marsh sediments[J]. Geochimica Et Cosmochimica Acta,1994,58(7):1701-1710.
[21]Weiss J V,Emerson D,Backer S M,et al. Enumeration of Fe(Ⅱ)-oxidizing and Fe(Ⅲ)-reducing bacteria in the root zone of wetland plants:implications for a rhizosphere iron cycle[J]. Biogeochemistry,2003,64(1):77-96.
[22]Fru E C,Piccinelli P,Fortin D. Insights into the global microbial community structure associated with iron oxyhydroxide minerals deposited in the aerobic biogeosphere[J]. Geomicrobiology Journal,2012,29(7):587-610.
[23]Weiss J V,Emerson D,Backer S M,et al. Enumeration of Fe(Ⅱ)-oxidizing and Fe(Ⅲ)-reducing bacteria in the root zone of wetland plants:implications for a rhizosphere iron cycle[J]. Biogeochemistry,2003,64(1):77-96.
[24]Lovley D R. Environmental microbe-metal interactions[M]. Washington DC:ASM Press,2000:3-30.
[25]胡 瑩,黄益宗,黄艳超,等. 不同生育期水稻根表铁膜的形成及其对水稻吸收和转运Cd的影响[J]. 农业环境科学学报,2013,32(3):432-437.
[26]刘文菊,朱永官. 湿地植物根表的铁锰氧化物膜[J]. 生态学报,2005,25(2):358-363.
