不同吸血时段蜱粪便蛋白组学比较分析
2019-07-06杨苗苗周勇志龚海燕张厚双周金林
杨苗苗,周勇志,曹 杰,龚海燕,张厚双,周金林
(1.中国农业科学院上海兽医研究所,上海 200241;2.上海师范大学生命与环境科学学院,上海200234)
蜱和蜱传播疾病一直是影响公众健康的重大问题[1]。目前,伴随常规灭蜱方法而出现的环境污染、食品安全和蜱的抗药性等问题日益彰显。因此,筛选可行的抗原候选分子,开发针对它们的疫苗,已成为控制蜱的重要途径[2]。蜱的消化与生长发育及其繁殖密切相关,而粪便蛋白成分则是反映蜱消化的重要指标。本研究旨在通过LC-MS/MS蛋白组学方法,分析镰形扇头蜱不同吸血时段粪便中的蛋白质成份,进一步了解蜱的血液消化特征,筛选可用于蜱疫苗研发的潜在蛋白质抗原[3-5]。
1 材料与方法
1.1 蜱的饲养和粪便的收集将镰形扇头蜱成蜱分为3组,每组雌蜱60只、雄蜱30只,分别接种到3只家兔的耳部。接种前将耳朵的兔毛剃掉,并将耳袋套在兔子耳朵上,耳朵的一端与兔耳基部用缝线固定。将蜱放入固定好的耳袋迅速用胶带封口。兔子常规饲养,每日检查耳袋中蜱的吸血情况,采用真空抽吸泵分别收集蜱吸血d4、d8 的粪便,去除兔子皮屑、兔毛及其他杂物,转移至EP管中备用,并做好标记。d4 分别标记为F4.1、F4.2、F4.3;d8分别标记为F8.1、F8.2、F8.3。
1.2 蛋白质的定量取适量粪便样品,分别加入200 μL SDT裂解液,振荡器匀浆,沸水浴10 min。超声破碎(100 W,10 次,每次10 s),沸水浴15 min。14 000×g离心 30 min,取上清。BCA 法进行蛋白质定量。
1.3 蛋白质的 SDS-PAGE分析每组各取20 μg样品,5∶1 的体积比加入 5×上样缓冲液,沸水浴 8 min,14 000×g离心 10 min,取上清,进行12%SDS-PAGE电泳。电泳条件:恒流,15 mA,电泳时间60 min。
1.4 蛋白质的FASP( filter-aided sumple preparation,FASP)酶解分别从每份样品中称取150 μg,加入DTT至终浓度为100 mmol/L,沸水浴5 min,冷却至室温。加入 200 μL 尿素缓冲液(8 mol/L尿素,150 mmmol/L Tris-HCl,pH8.0)混匀,转入30 kd超滤离心管,12 000×g离心15 min。加入200 μL尿素缓冲液,14 000×g离心15 min,弃滤液。加入100 μL吲哚-3-乙酸溶液(50 mmol/L吲哚-3-乙酸溶液加入到尿素缓冲液中),600 r/min 振荡1 min,避光室温30 min,12 000×g离心10 min。加入100 μL尿素缓冲液,12 000×g离心10 min,重复2次。加入100 μLNH4HCO3缓冲液,12 000×g离心10 min,重复2次。加入40 μLTrypsin 缓冲液(3 μgTrypsin 加入到4 μLNH4HCO3缓冲液),600 r/min 振荡1 min,37℃放置16~18 h。换新收集管,12 000×g离心10 min,收集滤液,滤液C18-SD Extraction Disk Cartridge 脱盐处理,OD280定量。
1.5 酶解产物的 LC-MS/MS分析按照定量结果各取2 μg酶解后产物进行LC-MS/MS分析,每个样品进样1次。采用纳升流速 HPLC 液相系统 EASY-nLC1000 进行分离。液相A液为0.1%甲酸乙腈水溶液(乙腈为 2%),B液为0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱Thermo EASY column SC200 150 μm*100 mm(RP-C 18)以100%的 A液平衡。样品由自动进样器上样到经色谱柱进行分离,流速为400 nL/min。相关液相梯度如下:0~100 min,B液线性梯度从0%到45%;100~108 min,B液线性梯度从45%到100%;108~120 min,B 液维持在100%。酶解产物经毛细管高效液相色谱分离后用 Q-Exactive 质谱仪(Thermo Finnigan)进行质谱分析。分析时长:120 min,检测方式:正离子,母离子扫描范围:300~1800 m/z,多肽和多肽的碎片的质量电荷比按照下列方法采集:每次全扫描(full scan)后采集20个碎片图谱(MS2 scan,HCD)。MS1在M/Z 200时分辨率为70 000,MS2在M/Z200时分辨率为17 500。
1.6 Maxquant的非标记分6个LC-MS/MS原始文件导入Maxquant 软件(版本号 1.3.0.5)进行查库,数据库是肩突硬蜱的基因组和Ixodidae硬蜱属的所有蛋白(http://www.uniprot.org/),并进行非标定量分析。
1.7 Perseus 的统计学和生物信息学分析Maxquant所得的查库文件使用 Perseus 软件(1、3、0、4)进行分析,并对吸血d4和d8粪便进行差异蛋白分析。
2 结果
2.1 蛋白质浓度测定采用BCA 法对样本蛋白质进行定量,结果显示,每组样品的蛋白浓度为0.622~1.006 μg/μL(表1)。

表1 样品蛋白质浓度信息Table 1 Information of sample protein concentration
2.2 SDS-PAGE分析电泳结果显示,样品条带分离清晰,蛋白提取效果良好。粪便中存在一组复杂的蛋白质,分子量主要集中于20~150 kDa,在略大于25 kDa、50~75 kDa、75 ~100 kDa之间各有一明显条带(图1)。
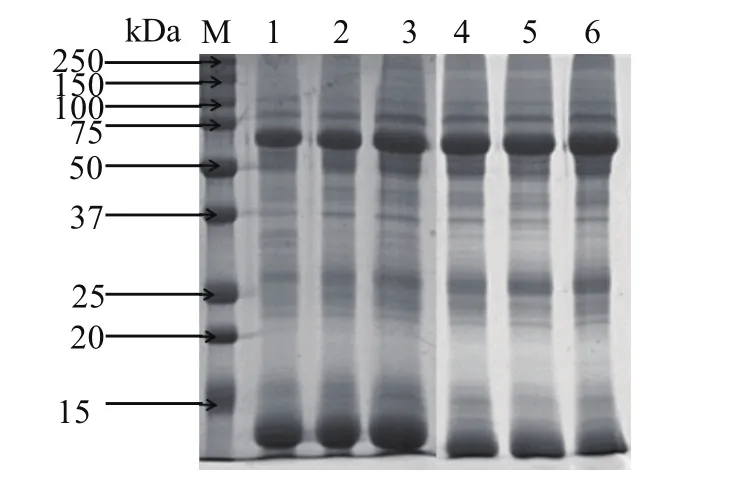
图1 吸血后成蜱粪便样品的SDS-PAGE电泳结果Fig.1 SDS-PAGE of samples from tick after sucking blood
2.3 肽段 OD280测定经吸光值OD280测定计算,样品肽段浓度范围为1.8 ~2.8 μg/mL,具体见表2.

表 2 肽段 OD280 值Table 2 OD280 values of peptide
2.4 蛋白质鉴定及定量结果对吸血d4、d8蜱粪便蛋白进行LC-MS/MS 质谱鉴定,发现存在蜱源肽段数628个、蛋白质总数196个;兔源肽段数6173个、蛋白质总数659个。吸血d4、d8的蜱粪便中均被检测到的蜱源蛋白189种,仅存在于吸血d4蜱源蛋白1种,仅存在于吸血d8蜱源蛋白6种。吸血d4、d8的蜱粪便中均检测到的兔源蛋白626种,仅存在于d4兔源蛋白10种,仅存在于d8兔源蛋白23种。
2.5 蛋白质显著性分析将F8组与F4组分别进行表达差异 T test分析,P<0.05为差异具有显著统计学意义。
蛋白质鉴定及定量、LC-MS/MS 质谱鉴定结果显示,共鉴定蜱源蛋白196种、兔源蛋白659种[6]。其中吸血d4与吸血d8相对比,发现蜱源差异蛋白(筛选标准Ratio> +/-1.2)17种:13种蛋白表达上调,4种蛋白表达下调。在蜱源蛋白生物学进程分析结果中,经蛋白质定量分析最终得到具有统计意义的蛋白质11个,其中表达上调的蛋白质10个,表达下调的蛋白质1个(表3)。差异表达蛋白质主要参与物质的合成及运输,有机物的代谢,应激反应,生物过程的调节,细胞发育,分化细胞组分的合成,基因表达等主要过程。
发现兔源差异蛋白49种:32种蛋白表达上调,17种蛋白表达下调。对兔源蛋白生物学进程分析结果中,经蛋白质定量分析最终得到具有统计意义的蛋白质16个,其中表达上调的蛋白质11个,表达下调的蛋白质5个(表4)。差异表达蛋白质主要参与组成细胞的结构成分,核酸的转录翻译,物质的合成、运输及有机物的代谢,能量的代谢,抗凝血等主要过程以及作为具有调节功能的激素[7]。
3 讨论
对蜱源差异蛋白分析发现参与生物过程的差异蛋白有6种:6-磷酸葡萄糖酸脱氢酶、酰基-CoA合成酶(片段)、无脑回畸形-1同源物、肌动蛋白相关蛋白2 / 3复合体亚基2, 34 kDa、Rab GDP解离抑制剂、甘油醛-3-磷酸脱氢酶。甘油醛-3-磷酸脱氢酶、6-磷酸葡萄糖酸脱氢酶、酰基-CoA合成酶(片段)、ATP-柠檬酸裂解酶、磷脂酶A2等参与到有机物代谢过程;无脑回畸形-1同源物、雌性特异性组胺结合蛋白2在应激反应方面发挥重要作用,酰基-CoA合成酶(片段)、ATP-柠檬酸裂解酶在生物合成上有重要的作用,肌动蛋白相关蛋白2 / 3复合体亚基 2.3 kDa、踝蛋白等蛋白是细胞骨架的基本组成部分。
对兔源差异蛋白分析发现细胞结构成分有6种:兔内质蛋白、角蛋白、I型细胞骨架17、Na(+)/H(+)交换调节因子NHE-RF1、兔胶原蛋白α-2(I)链、兔脂多糖结合蛋白。兔延伸因子1-2、腺苷酸合成酶同工酶2、兔核心异型组蛋白H2A、兔酪蛋白激酶II的α亚基等参与到核酸的转录翻译过程;兔苹果酸脱氢酶、兔内质蛋白、皮质类固醇结合球蛋白在物质的合成、运输及有机物的代谢方面发挥重要作用;PAPS合酶1、兔组蛋白H2A、腺苷酸合成酶同工酶2、S-(羟甲基)谷胱甘肽脱氢酶、磷酸甘油酸变位酶在能量的代谢中有重要的作用;血小板活化因子乙酰水解酶IB亚基α参与抗凝血过程。

表3 具有统计学意义蜱源差异蛋白Table 3 Statistically significant difference tick-derived proteins

表4 具有统计学意义兔源差异蛋白Table 4 Statistically significant difference rabbit-derived proteins
镰形扇头蜱雌性成蜱在宿主内寄生时,一般前期为慢速吸血期,6 d后进入快速吸血期。根据蛋白组学结果显示,F8组雌性特异性组胺结合蛋白2表达下调,该蛋白在逃避或抵抗宿主防御反应方面发挥重大作用[8],这与蜱叮咬诱发宿主免疫反应时,蜱会分泌相应物质来干扰宿主反应这一现象符合。6-磷酸葡萄糖酸脱氢酶、酰基-CoA合成酶(片段)、ATP-柠檬酸裂解酶、磷脂酶A2、甘油醛-3-磷酸脱氢酶等与能量产生相关的酶在F8组中上调[9],表明快速饱血期蜱的消化活动明显增强。血红素脂蛋白具有转运蛋白活性,脂质通过一些物质如转运蛋白或孔隙定向运动进入细胞内[10-11]。Rab-GDP解离抑制剂作为囊泡运输重要参与者,特异性促进囊泡与靶膜上的对接,进而参与细胞内物质运输途径[12]。以上三类蛋白在蜱吸血d8粪便中的排出量明显上升,可能为蜱卵细胞的形成提供物质基础。
饱血雌蜱比吸血雌蜱大几十倍甚至上百倍,蜱进入快速饱血期开始快速大量吸取宿主血液,并暂时存储于蜱中肠组织。蜱作为一种寄生性节肢动物,宿主血液以胞吞的方式进入到蜱消化细胞进行消化分解[13],在蜱粪便中检测到的蛋白是未消化的成分,所以,粪便中某种蛋白含量的上调从某种程度上意味着蜱对该蛋白的消化吸收减少。由于蜱吸血d8中肠内血液含量远远高于d8,因此一些蛋白消化不完全随粪便排出。对下调蛋白分析可以发现,兔脂多糖结合蛋白、兔皮质类固醇结合球蛋白、S-(羟甲基)谷胱甘肽脱氢酶、胶原蛋白α-2(I)链、兔磷酸甘油酸变位酶有明显下调,表明蜱在该阶段对其吸收率增高。考虑到是因为雌蜱吸血后期大量卵的生成,这些蛋白在进入蜱体内可能一部分被消化吸收重新合成为自身营养物质供机体利用(如兔脂多糖结合蛋白),另一部分直接转化为自身成分发挥其功能。具体机制仍待进一步探究。
本研究提取蜱不同吸血时段粪便中存在的蛋白,并对差异蛋白进行了生物学分析。尽管获取的数据还远远不足,但是这些蛋白的探究无疑为蜱消化方面的研究丰富了数据,同时对雌蜱而言,消化的最重要意义在于繁殖产卵,差异蛋白的功能,为抗蜱研究提供了一个思路。
