盘尾丝虫ASP1蛋白佐剂活性区不同标签融合表达与佐剂活性比较
2019-07-06卢会鹏张晓凯李洋洋张鑫宇夏晓莉孙怀昌
胡 威,卢会鹏,张晓凯,李洋洋,张鑫宇,夏晓莉,孙怀昌,2
(1.扬州大学兽医学院 江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;2.江苏农牧科技职业学院,泰州225300)
重组亚单位疫苗安全性好,但免疫原性较差,需与适当免疫佐剂配合使用才能取得良好免疫效果。现有免疫佐剂主要有油佐剂和水佐剂,其中油佐剂诱导抗体产生较慢,应激反应较大,但抗体维持时间较长;水佐剂诱导抗体产生快,应激反应较小,但抗体维持时间较短。这些传统免疫佐剂一般只能增强体液免疫应答[1],因此迫切需要研制能诱导全面免疫应答的新型免疫佐剂。
盘尾丝虫(Onchocerca volvulus,Ov)第三期幼虫活化相关分泌蛋白(activation-associated secreted protein 1,ASP-1)具有很强的免疫佐剂活性[2-3]。将重组Ov-ASP-1与卵清蛋白、人免疫缺陷病毒(Human immunodeficiency virus,HIV)或SARS冠状病毒重组亚单位疫苗进行动物免疫试验,结果显示不仅能促进平衡的Th1/Th2抗体应答,而且能增强向Th1偏移的细胞免疫应答[4]。将重组Ov-ASP-1与低剂量流感病毒灭活疫苗免疫小鼠,不仅能显著加强和加速抗体应答,还能加强交叉免疫保护[5]。将Ov-ASP-1的PR-1佐剂活性区与卵清蛋白、乙型肝炎病毒表面抗原、HIV抗原肽免疫小鼠,不仅能刺激抗原特异抗体产生,而且能刺激脾细胞产生γ干扰素和IL-6等细胞因子[6]。然而这些重组大肠杆菌表达的Ov-ASP-1均为不溶性包涵体,不仅需要进行复杂的变性/复性处理,而且需使用价格较贵的亲和层析柱进行纯化,作为兽用免疫佐剂使用时受到很大限制。
类弹性蛋白多肽(elastin-like polypeptide,ELP)是根据体内弹性蛋白五肽重复序列(如VPGXG)合成的多肽聚合物,具有温度敏感的可逆相变特性,在低于相变温度下呈可溶状态,在高于相变温度下呈凝聚状态,因此其融合蛋白可通过简单的相变循环纯化[7-8]。同时,ELP也具有一定的免疫佐剂作用[9]。ELK16等自聚肽能在细菌内或液体中自动聚集成蛋白凝聚物,其融合蛋白可用离心洗涤法纯化,纯化效率与亲和层析法接近[10]。本研究将Ov-ASP-1佐剂活性区PR-1分别与ELP、ELK16和His标签进行融合表达,与传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)重组VP2蛋白进行动物免疫试验,旨在探索不同纯化标签对PR-1免疫佐剂活性的影响,同时为IBDV新型亚单位疫苗佐剂研制提供参考。
1 材料和方法
1.1 材料ELK16自聚肽和ELP融合表达载体pETP16P[10]和pET-ELP[8]由本实验室构建和保存;His标签蛋白纯化试剂盒购自康为世纪公司;烟草蚀纹病毒(Tobacco etch virus,TEV)蛋白酶活性包涵体由本实验室制备[11];RPMI 1640细胞培养液购自美国GE公司;细胞因子ELISA试剂盒购自武汉酶免生物公司;SPF级Balb/c小鼠购自扬州大学比较医学中心。
1.2 重组载体构建用网上在线软件JAVA Codon Adaption Tool,将IBDV VP2基因片段[12]优化成大肠杆菌偏爱密码子序列,5'端引入TEV蛋白酶切位点,序列由上海生工生物公司合成。用限制酶SalI和XhoI将VP2编码序列插入pET-ELP载体,重组载体命名为ELP-VP2。将上海生工生物公司合成的ASP-1的PR-1功能区[6]编码序列分别插入pET-P16P、pETELP和pET-30a载体的SalI/NotI位点,获得的重组载体命名为pELK-PR1、pELP-PR1和pET-PR1。
1.3 重组蛋白表达分别将重组质粒pELP-VP2、pELK-PR1、pELP-PR1和pET-PR1转化BL21(DE3)大肠杆菌感受态细胞,37℃振荡培养过夜。按1∶100比例接种500 mL卡那霉素(50 μg/mL)2×YT培养基,37℃振荡培养至OD600=0.6,加入终浓度为0.2 mmol/L IPTG,37℃诱导表达6 h。4℃、
4000 ×g离心10 min,收集菌体,用1/10体积菌体裂解液或PBS重悬,然后用JNBIO高压细胞破碎仪破碎3次(1300 pa),4℃、12 000 ×g离心10 min,收集上清。加入终浓度为0.5%聚乙烯亚胺(polyethylenimine,PEI)混匀,4℃、14 000 ×g离心10 min,离心收集上清用于重组蛋白纯化。
1.4 重组蛋白纯化ELP融合蛋白的相变循环按文献[8] 进行,纯化ELP-VP2融合蛋白的相变温度为26℃,氯化钠浓度为1.5 mol/L;纯化ELP-PR1融合蛋白的相变温度为26℃,用0.4 mol/L硫酸铵和1 mol/L尿素进行。孵育10 min后,室温、12 000 ×g离心5 min,沉淀用预冷PBS重悬,冰浴30 min,4℃、12 000 ×g离心10 min去除不溶性杂蛋白,必要时重复1次相变循环。ELK-PR1融合蛋白纯化按文献[10-11] 进行,将高压破碎菌液在4℃、12 000 ×g离心10 min,沉淀蛋白先用洗涤液1(50 mmol/L Tris-HCl、50 mmol/LNaCl、2 mol/L尿素、1% Triton X-100、1 mmol/LEDTA、3 mmol/LDTT, pH 8.0)离心洗涤2次(4℃、1000 ×g离心10 min),再用洗涤液2(50 mmol/LTris-HCl、50 mmol/L NaCl、0.5% Triton X-100, pH 7.2)离心洗涤3次,最后用1%Triton X-114抽提去除内毒素,PBS离心洗涤2次后备用。His-PR1融合蛋白的纯化按照康为世纪His标签蛋白纯化试剂盒说明书进行。
1.5 ELP标签切除ELP-VP2融合蛋白标签切除按文献[11] 进行,沉淀的融合蛋白先用预冷TEV蛋白酶反应液4℃复溶,按1∶30 μg比例与TEV蛋白酶活性包涵体混合,30℃孵育6 h;4℃、12 000 ×g离心10 min,去除蛋白酶活性包涵体,上清液加入2 mol/L氯化钠在26℃条件下再次相变循环,离心去除ELP蛋白沉淀,上清液用PBS透析1次。
1.6 小鼠免疫将20只6周龄Balb/c小鼠随机分为5组,每组4只,分别为VP2、VP2+IFA(不完全弗氏佐剂)、VP2+ ELP-PR1、VP2+ELK-PR1和VP2+His-PR1免疫组,免疫途径为腿部肌肉注射,抗原用量为20μg/只,所用3种PR-1融合蛋白摩尔浓度相同,His-PR1用量为10μg/只,ELP-PR1用量为26.6 μg/只,ELK-PR1用量为12.4μg/只,首免后2周加强免疫1次。首免后每周眶下静脉丛采血分离血清,-80℃冻存备用。
1.7 免疫小鼠抗体检测免疫小鼠血清的VP2特异IgG、IgG1和IgG2c用间接ELISA检测,包被抗原为纯化VP2重组蛋白(5 μg/mL),4℃包被过夜,PBST(含0.1%Tween-20的PBS,pH7.4)洗板3次;封闭液为含5%脱脂乳粉的PBST,37℃封闭1 h;PBST洗板3次,各孔依次加入连续倍比稀释(从1∶100开始)的免疫小鼠血清,37℃作用1 h;PBST洗板3次,加入酶标羊抗鼠IgG、IgG1或IgG2c,37℃作用1 h;PBST洗板3次,每孔加入100 μL显色液,室温避光显色20 min,加入50 μL终止液终止反应。以空白孔调零,用全波长酶标仪测定每孔OD450值,将P/N ≥ 2.1判为阳性,P/N < 1.5判为阴性。
1.8 免疫小鼠细胞因子检测初免后28 d采血分离血清,按照细胞因子检测ELISA试剂盒说明书测定免疫小鼠血清的IFN-γ、TNF-α、IL-6和IL-10浓度,每个样品设3次重复,计算平均值(x)及标准误(s)。
2 结果
2.1 重组VP2蛋白表达与纯化将ELP-VP2重组载体转化BL21(DE3)大肠杆菌感受态细胞,用0.2 mmol/L IPTG在37℃条件下诱导6 h。SDS-PAGE分析显示表达的ELP-VP2融合蛋白为66.6 kDa,与预期相符,经过2次相变循环纯化的融合蛋白纯度为95%;用TEV蛋白酶活性包涵体切除ELP标签,再次相变循环回收的重组VP2蛋白为预期的13 kDa,纯度为95%(图1)。
2.2 PR-1融合蛋白的表达与纯化分别将His-PR1、ELK-PR1和ELP-PR1融合表达载体转化BL21(DE3)大肠杆菌感受态细胞,用0.2 mmol/L IPTG在37℃诱导6 h,SDS-PAGE分析显示表达的His-PR1、ELK-PR1、ELP-PR1融合蛋白分别为预期的23、28、60 kDa(图2)。其中,His-PR1融合蛋白为不溶性包涵体表达,在变性条件下用镍亲和柱纯化;ELK-PR1融合蛋白为活性包涵体表达,用离心洗涤法纯化;ELP-PR1融合蛋白为可溶性表达,用相变循环纯化(表1)。

图1 ELP-VP2融合蛋白表达、纯化与标签切除Fig.1 Expression, purification and tag cleavage of ELPVP2 fusion protein
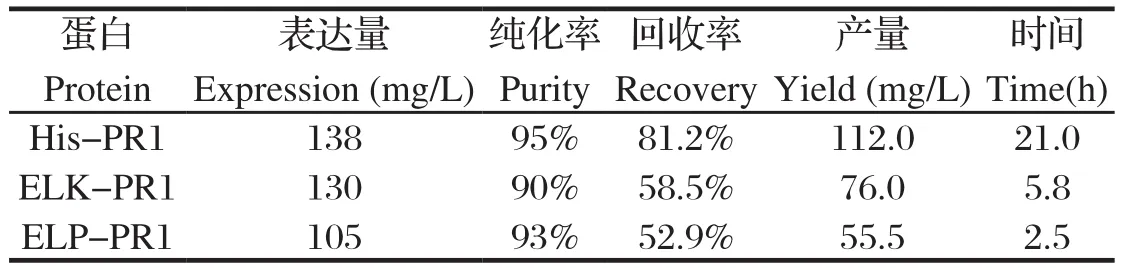
表1 三种PR-1融合蛋白的纯化指标Table 1 Purification performance of three PR-1 fusion proteins
2.3 免疫小鼠抗体水平检测在初次免疫后第1周和第4周,对5个实验组小鼠采血分离血清,以重组VP2蛋白为检测抗原,用间接ELISA检测抗原特异性IgG、IgG1和IgG2c。在初免后d7,His-PR1佐剂组总IgG水平与VP2免疫对照组差异具有显著统计学意义(P<0.05),IFA、ELK-PR1和ELP+PR1佐剂组差异具有极显著统计学意义(P<0.01),其中ELP+PR1佐剂组总IgG水平最高;His-PR1和IFA佐剂组的IgG1水平与VP2免疫对照组差异不具有显著统计学意义,ELP-PR1佐剂组差异具有显著统计学意义,ELK-PR1佐剂组差异具有极显著统计学意义;4个佐剂组的IgG2c水平与VP2免疫对照组差异具有极显著统计学意义,其中ELP-PR1佐剂组的IgG2c水平最高(图3)。在初免后28 d,4个佐剂组的总IgG水平与VP2免疫对照组差异具有极显著统计学意义,其中ELP-PR1佐剂组总IgG水平最高;His-PR1佐剂组的IgG1水平与VP2免疫对照组差异具有显著统计学意义,其他3个佐剂组差异具有极显著统计学意义;4个佐剂组的IgG2c水平与VP2免疫对照组差异具有极显著统计学意义,其中ELP-PR1佐剂组IgG2c水平最高(图4)。

图2 三个PR-1融合蛋白的表达及纯化Fig.2 Expression and purification of thee PR-1 fusion proteins
2.4 小鼠血清细胞因子检测在初免后28 d采血分离血清,用ELISA试剂盒检测细胞因子浓度。与VP2免疫组对照相比,ELP-PR1佐剂组的IFN-γ水平差异具有极显著统计学意义,其他3个佐剂组差异不具备显著统计学意义(图5A);与VP2免疫对照组相比,ELK-PR1佐剂组的IL-6水平差异具备显著统计学意义,ELP-PR1佐剂组差异具有极显著统计学意义,ELK-PR1和His-PR1佐剂组差异不具备显著统计学意义(图5B);与VP2免疫对照组相比,ELP-PR1免疫组的IL-10水平差异具有极显著统计学意义,其他3个佐剂组差异具备显著统计学意义(图5C);与VP2免疫对照组相比,IFA佐剂组的TNF-α水平差异不具备显著统计学意义,其他3个佐剂组差异具有极显著统计学意义(图5D)。

图3 免疫小鼠的VP2特异抗体检测(初免后d7)Fig. 3 Detection of VP2-specific antibody response in mice on day 7 after immunization

图4 免疫小鼠的VP2特异抗体检测(初免后d28)Fig. 4 Detection of VP2-specific antibody response in mice on day 28 after immunization
3 讨论
重组蛋白和合成肽等亚单位疫苗安全性较好,但免疫原性较差,需与适当佐剂配合使用。铝盐和油乳剂等传统免疫佐剂可以加强疫苗抗原的体液免疫应答,但不能形成有效的细胞免疫。Toll样受体(toll-like receptor,TLR)等模式识别受体(pattern recognition receptor,PRR)可以激活抗原提呈细胞和促炎性细胞因子产生,在先天性和获得性免疫应答中发挥重要作用,因此TLR是一种具有很大应用前景的新型免疫佐剂[13]。Ov-ASP-1是TLR2和TLR4的配体,具有很强的免疫佐剂活性,活性区位于核心致病性相关-1(PR-1)结构域[6]。重组大肠杆菌表达的PR-1不仅对卵清蛋白和乙肝表面抗原等具有体液免疫增强作用,还能诱导细胞免疫应答[6],但其表达产物需用镍亲和柱纯化,成本较高,难以规模化制备,在兽医临床使用中受到限制。ELP是根据体内弹性蛋白重复序列合成的多聚体,具有免疫原低、体内相容性好等优点,已作为药物传送载体和组织工程材料被研究人员进行开发。更为重要的是,ELP具有温度敏感的可逆相变特性,其融合蛋白可用简单的相变循环纯化,是近年来快速发展的重组蛋白纯化标签[8]。本研究中,ELP-PR1融合蛋白纯化可以在2.5 h内完成,纯化蛋白的纯度高达93%,与镍亲和层析纯化His-PR1融合蛋白的效率(95%)接近。亲和层析纯化His-PR1融合蛋白的回收率和产量高于ELP-PR1融合蛋白,但需用价格较贵的镍亲和层析柱,而且纯化过程需时长达21 h,而ELP-PR1融合蛋白的纯化仅需氯化钠等常规化学试剂和离心机等简单设备。ELK16等自聚肽能自动聚集成活性包涵体,因此其融合蛋白也可用简单的离心洗涤法纯化[10-11],这在本研究中得到进一步验证。

图5 免疫小鼠血清细胞因子检测Fig.5 Detection of cytokines in immunized mouse serum
自然环境中IBDV广泛存在,疫苗使用非常普遍,所以难以找到适合免疫应答研究的非免疫雏鸡或鸡胚,即使是非免疫雏鸡或鸡胚也不能保证无IBDV母源抗体存在。SPF雏鸡不仅来源受限、价格较贵,试验过程中也容易受到IBDV污染而导致试验失败。小鼠为IBDV非易感动物,SPF小鼠不仅来源方便,试验过程中也不会受到IBDV污染。因此,本研究分别将3种PR-1融合蛋白与IBDV重组VP2抗原进行小鼠免疫试验,以便对重组VP2抗原的免疫原性及其所需免疫佐剂进行初步评价。
初免后7 d,3个PR-1佐剂组VP2特异IgG滴度较VP2免疫对照组均有显著提高,其中ELP-PR1佐剂组升高最显著,ELK-PR1佐剂组与IFA佐剂组相当,His-PR1佐剂组较差。在初免后28 d,3个PR-1佐剂组VP2特异IgG滴度均进一步升高,但抗体水平变化相似。除抗原特异性IgG1滴度不同程度升高外,3个PR-1佐剂组的IgG2c水平也有显著升高,进一步证明Ov-ASP-1的PR-1结构域不仅能诱导平衡的Th1/Th2应答,还能将免疫应答向Th1偏移。在3个融合标签中,ELP不仅分子量最大(55 kDa),还能在体内形成颗粒样结构,可能是ELP-PR1佐剂活性较强的原因所在。His标签分子量最小(0.5 kDa),加之PR-1分子量也较小(16 kDa),His-PR1免疫佐剂活性较低可能与其降解速度较快有关。
细胞因子包括Th1和Th2类细胞因子,前者代表性细胞因子主要包括IL-6、IFN-γ和TNF-α,主要参与细胞免疫调节;后者代表性细胞因子主要有IL-4和IL-10,主要参与体液免疫调节[14]。在3个PR-1佐剂组中,ELP-PR1对IL-6、IL-10、IFN-γ和TNF-α四种细胞因子产生的刺激作用均较强,可能与其自身免疫佐剂活性有关。ELK-PR1 对IL-6、IL-10和TNF-α产生的刺激作用较强,而His-PR1对IL-10和TNF-α产生的刺激作用较强。研究结果不仅证明PR-1能刺激Th1和Th2细胞因子产生,而且提示不同融合标签对PR-1刺激产生的细胞因子种类可以产生影响。
