蔬菜土传病原菌三重PCR检测体系的建立与应用
2019-07-06刘芮池程有普柴阿丽石延霞谢学文帕提古丽李宝聚
刘芮池,程有普,柴阿丽,石延霞,谢学文,帕提古丽,李宝聚
(1中国农业科学院蔬菜花卉研究所,北京 100081;2天津农学院园艺园林学院,天津300384;3新疆农业科学院园艺作物研究所,乌鲁木齐 830091)
0 引言
【研究意义】瓜果腐霉(Pythium aphanidermatum)隶属卵菌门,是一种重要的土传病原菌,通常侵染幼苗的根和种子,造成大量死苗[1]。尖镰孢(Fusarium oxysporum)是一种世界性分布的土传病原菌,引起维管束病害,近几年来蔬菜枯萎病发生面积逐年扩大[2-3]。大丽轮枝菌(Verticillium dahliae)可侵染大豆、番茄、茄子、马铃薯等,引发黄萎病、根腐病、茎基腐病等,目前尚无有效防治手段[4]。由于这 3种病原菌引起的病害症状与其他植物病害相似度高,尤其病害初期症状不明显,仅靠肉眼不能准确判断病害种类。而防治不同病原菌所用药剂不同,错误的诊断导致用药及防治失败,所以在病害潜伏期或发病初期作出准确诊断,有利于及时采取针对性防治措施,减少损失[5-7]。因此,对于上述3种侵染蔬菜的土传病原菌,亟需建立科学、准确、快速、高通量的检测方法。【前人研究进展】传统的病害诊断依赖于病害症状的观察和病原菌的分离与鉴定,但病害的症状观察需要典型症状出现才可准确判断,病原菌的分离培养易受环境、培养条件等影响,操作复杂,耗时长,不能满足高通量、快速的检测要求,不利于大规模样品的分析鉴定[8-12]。随着分子生物学的飞速发展,已有许多成熟的技术可用于植物病原菌的检测。THOMAS等[13]利用腐霉菌的18S rRNA基因保守区域,设计特异性引物 Pyth712Fwd/Pyth1758Rev对腐霉菌属进行了普通PCR检测;加拿大地区的大豆生产受腐霉菌影响严重,MARCHAND等[14]于 2010—2012年采集土壤样本,对分离出的腐霉菌进行PCR扩增和测序以鉴定不同的腐霉菌物种;GEISER等[15]采用引物EF1/EF2扩增TEF基因区域以鉴定镰孢菌;RAHJOO等[16]于2004—2005年在伊朗11个地区分离出191株镰孢菌,通过TEF区域特异性引物VER1/2和PRO1/2进行PCR扩增,鉴定结果显示分别为尖镰孢、层出镰孢(F. proliferatum)和黄色镰孢(F. culmorum);LI等[17]设计了引物NMS1/NMS2用于轮枝菌属的鉴定;BRESSAN等[18]通过ITS区域建立了一种快速、特异的PCR检测方法用于土壤中大丽轮枝菌的检测,检测灵敏度为4 fg。【本研究切入点】针对多种土传病原菌的多重PCR检测技术的研究鲜有报道。针对田间多种病原菌复合侵染问题,建立3种土传病原菌的多重PCR体系,同时检测多种病原菌,提高检测效率,为病害防治赢得时间。【拟解决的关键问题】筛选适宜的检测引物,优化多重PCR检测体系,建立能够同时检测蔬菜瓜果腐霉、尖镰孢和大丽轮枝菌的多重PCR检测方法,提高病原菌检测效率,为病害的诊断提供技术支持。
1 材料与方法
试验于2017年12月至2018年12月在中国农业科学院蔬菜花卉研究所完成。
1.1 试验材料
供试菌株由中国农业科学院蔬菜花卉研究所蔬菜病害综合防治课题组提供,其中瓜果腐霉、尖镰孢、大丽轮枝菌为检测病菌(表1)。
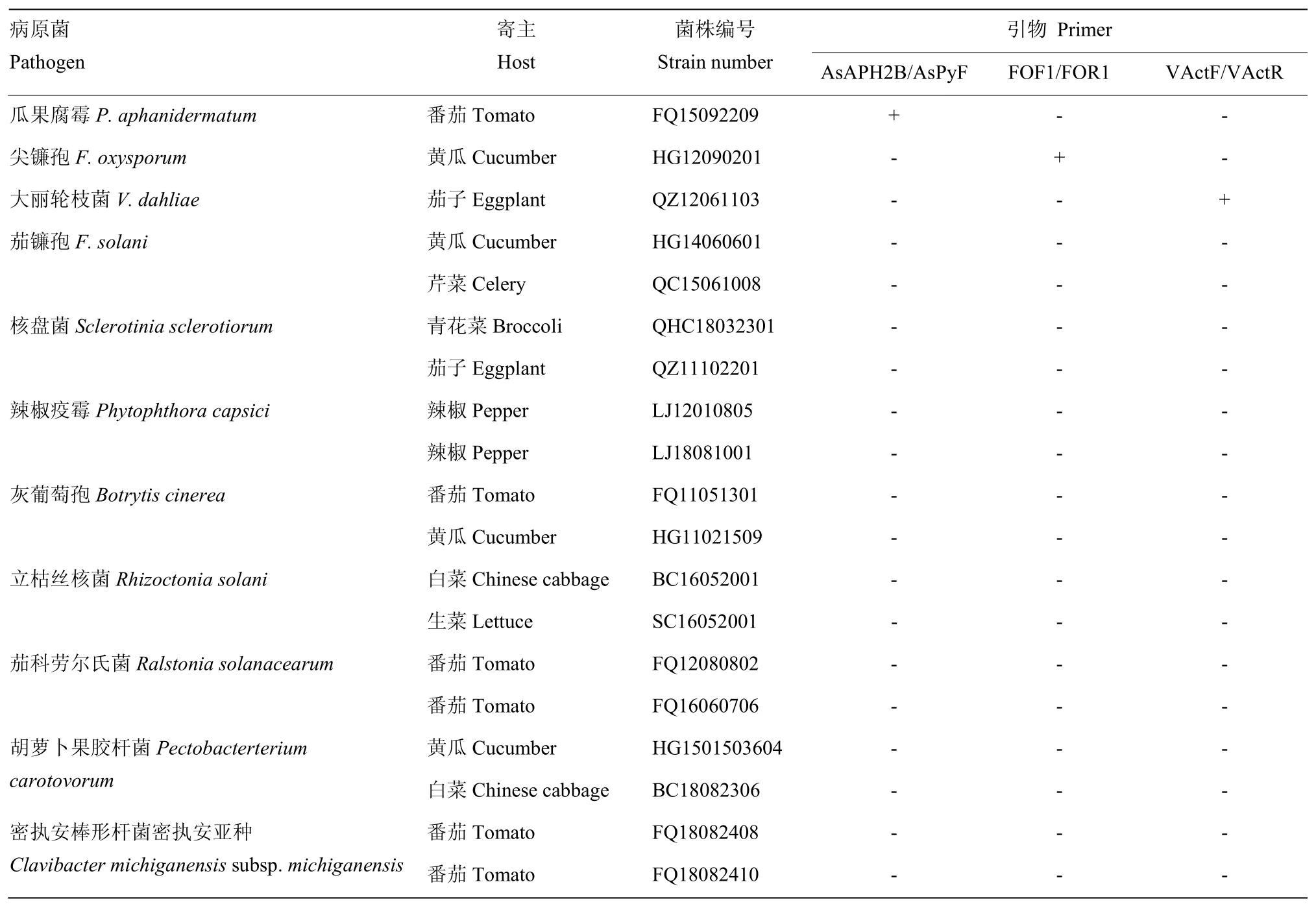
表1 供试菌株Table 1 The strains used in the test
1.2 基因组DNA的提取
取适量冻干菌丝样品,采用CTAB法提取病原菌基因组DNA,-20℃保存备用。
1.3 多重PCR引物组合
检索国内外关于瓜果腐霉、尖镰孢、大丽轮枝菌的分子检测报道,选取可能组合的引物。瓜果腐霉采用 ASANO等[19]设计的特异引物 AsAPH2B/AsPyF;尖镰孢引物采用FOF1/FOR1[20];大丽轮枝菌采用引物VActF/VActR[21]。
通过NCBI网站对引物组进行BLAST比对,检测这3对引物之间相似度是否符合组成多重PCR的条件,设计试验进一步验证。引物由北京博迈德生物技术有限公司合成(表2)。
1.4 多重PCR体系的建立
对影响三重 PCR体系的重要因素进行优化。58—65℃之间设计梯度PCR反应程序,共58、58.7、59.6、60.8、62.4、63.7、64.5、65℃ 8个梯度;引物AsAPH2B/AsPyF 浓度设定 0.12、0.16 和 0.20 μmol·L-13个梯度,引物 FOF1/FOR1浓度设定 0.16、0.20和0.24 μmol·L-13个梯度,引物VActF/VActR浓度设定0.24、0.28和 0.32 μmol·L-13个梯度;3个延伸时间分别设为30 s、45 s、1 min;3个循环次数分别设为30、35、40次。
PCR仪进行扩增,反应结束后取5 μL扩增产物进行琼脂糖凝胶电泳,使用 Bio-rad凝胶成像系统照相。结果按照病原菌扩增的特异性和敏感性,即条带的强弱、杂带的有无等进行综合评价。
1.5 阳性样品扩增产物的测序及分析
对阳性样品的扩增产物进行双向测序,并在GenBank中进行BLAST分析,以验证PCR的特异性。
1.6 三重PCR反应特异性检测
选取瓜果腐霉、尖镰孢、大丽轮枝菌基因组DNA等量混合均匀,分别以辣椒疫霉、立枯丝核菌、核盘菌等16株蔬菜土传病原菌基因组DNA为对照,利用优化好的三重PCR反应条件进行三重PCR检测,检验该体系的特异性。

表2 供试引物Table 2 The primers used in the test
1.7 三重PCR反应灵敏度检测
将瓜果腐霉、尖镰孢、大丽轮枝菌基因组 DNA模板浓度设置为 10、1、10-1、10-2、10-3、10-4和 10-5ng·μL-1,使用优化后的三重 PCR反应条件进行 PCR扩增,取5 μL扩增产物进行琼脂糖凝胶电泳,凝胶成像系统照相。分别检测单一病原菌及混合病原菌的反应灵敏度。
1.8 三重PCR检测体系的稳定性
为检验体系的稳定性和可重复性,分别使用北京博迈德生物技术有限公司的2×Taq Master PCR Mix和大连宝生物工程有限公司的TaKaRa Taq酶进行三重 PCR 反应。其中 TaKaRa Taq(5 units/μL)0.125 μL,10×PCR Buffer 2.5 μL,dNTP Mixture(各 2.5 mmol·L-1)2 μL,其他条件相同。两种反应体系均分别使用 AerisTM型(新加坡艺思高科技有限公司)和C1000 TouchTM型(赛默飞世尔科技有限公司)的热循环仪进行扩增[22]。
1.9 人工模拟接种基质中病原菌的检测
1.9.1 人工模拟带菌基质制备 将瓜果腐霉、尖镰孢、大丽轮枝菌菌株分别接种于OA和PDA平板,25℃恒温培养10 d,收集瓜果腐霉菌丝,称重,制成终浓度为10 mg·mL-1的菌丝悬液,10倍梯度稀释,将100 mL菌悬液加入到100 g无菌基质中,分别制备成浓度为 10、1、10-1、10-2、10-3、10-4、10-5mg·g-1的模拟带菌基质[23]。用灭菌刷刷下尖镰孢和大丽轮枝菌平板上的孢子,分别配成浓度为106个孢子/mL悬浮液,10倍梯度稀释。将 100 mL菌悬液加入到100 g无菌基质中,分别制备成浓度为108、107、106、105、104、103、102个孢子/mL的模拟带菌基质。将分别带有 3种病原菌的基质等比混合制成混合带菌基质。在每100 g模拟带菌土中随机抽取1 g土样,冷冻干燥备用[24]。
1.9.2 带菌基质中 DNA的提取 采用 Fast DNA SPIN Kit for Soil(美国MP Biomedicals土壤基因组DNA提取试剂盒)对基质进行基因组DNA的提取,-20℃保存。
1.9.3 三重 PCR检测人工模拟带菌基质 以不同浓度模拟带菌基质总DNA为模板,使用优化的三重PCR方法检测模拟的带菌基质,确定该引物对基质中病原菌分生孢子的检测灵敏度。
1.10 三重PCR体系的应用
田间采集根腐病、枯萎病及黄萎病病害根茎样本35份,土壤样本149份,其中根围土壤取自距发病植株根围2 mm,深5—10 cm的土壤,过筛去除杂物,取0.5 g根围土壤提取基因组DNA,提取病组织和根围土壤基因组DNA,并采用优化后的多重PCR反应体系进行检测,同时进行病原菌分离培养,以验证该三重PCR检测体系。
2 结果
2.1 三重PCR反应体系的建立
通过对退火温度、引物浓度组合、延伸时间和循环次数的优化,最终确定三重PCR反应体系(总体积为 25 μL):2×Taq Master PCR Mix 12.5 μL,10 μmol·L-1的引 物 AsAPH2B/AsPyF、FOF1/FOR1、VActF/VActR 分别为 0.3、0.4、0.6 μL,模板各 1 μL,补加ddH2O至25 μL。反应程序:94℃预变性5 min;94℃变性30 s,60.8℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min(图1)。
2.2 阳性样品扩增产物的测序及分析
采用优化后的三重PCR检测体系对瓜果腐霉、尖镰孢和大丽轮枝菌进行扩增,扩增产物经克隆测序后,通过GenBank上BLAST比对,同源性均达到99%,因此确定扩增产物均为目标菌株(表3)。

图1 三重PCR退火温度优化Fig. 1 Optimization of the annealing temperature for triplex PCR

表3 扩增产物比对结果Table 3 The results of PCR products
2.3 三重PCR反应特异性检测
按照优化后的反应条件,引物AsAPH2B/AsPyF、FOF1/FOR1和VActF/VActR同时扩增出瓜果腐霉、尖镰孢和大丽轮枝菌的基因组 DNA,获得 163、328和530 bp的特异条带,而其他蔬菜病原菌都没有特异条带(图2)。

图2 三重PCR特异性检测Fig. 2 The specific detection of triplex PCR
2.4 三重PCR检测体系的灵敏度
三重PCR体系中,3对引物扩增单个模板能够检测到 10-2ng·μL-1的瓜果腐霉、尖镰孢和 10-1ng·μL-1大丽轮枝菌基因组DNA,同时扩增3个模板的灵敏度为 10-1ng·μL-1(图 3、图 4)。

图3 三重PCR检测单一病原菌的灵敏度Fig. 3 The sensitivity of triplex PCR for detection of DNA from a single pathogen

图4 三重PCR检测灵敏度Fig. 4 The sensitivity of triplex PCR detection
2.5 三重PCR检测体系的稳定性
采用大连宝生物工程有限公司和北京博迈德生物技术有限公司生产的Taq酶,PCR仪采用赛默飞世尔科技有限公司的C1000 TouchTM和新加坡艺思高科技有限公司的AerisTM热循环仪,以3种病原菌的基因组DNA为模板,进行三重PCR检测。结果显示,均可以扩增出3种病原菌的特异性目的片段(图5)。因此,所建立的三重PCR反应体系稳定,可用于瓜果腐霉、尖镰孢和大丽轮枝菌的快速诊断。
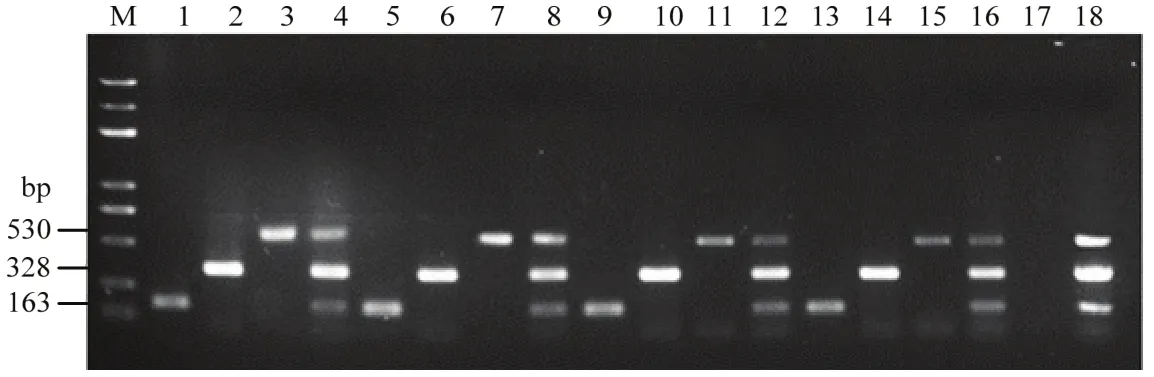
图5 三重PCR体系稳定性检测Fig. 5 The stability detection of triplex PCR system
2.6 人工模拟接种基质检测
利用三重PCR方法对瓜果腐霉模拟带菌基质、尖镰孢模拟带菌基质、大丽轮枝菌模拟带菌基质、混合带菌基质和未加菌基质进行定量检测,结果显示对瓜果腐霉的检测灵敏度为10-2mg菌丝/g,尖镰孢检测灵敏度为106个孢子/g,大丽轮枝菌的检测灵敏度为105个孢子/g;混合体系下对于尖镰孢和大丽轮枝菌的检测灵敏度为106个孢子/g,对瓜果腐霉的灵敏度是10-2mg菌丝/g;而未加菌的基质DNA中未检测到(图6)。因此,所建立的三重PCR反应体系可应用于基质中瓜果腐霉、尖镰孢和大丽轮枝菌的检测。
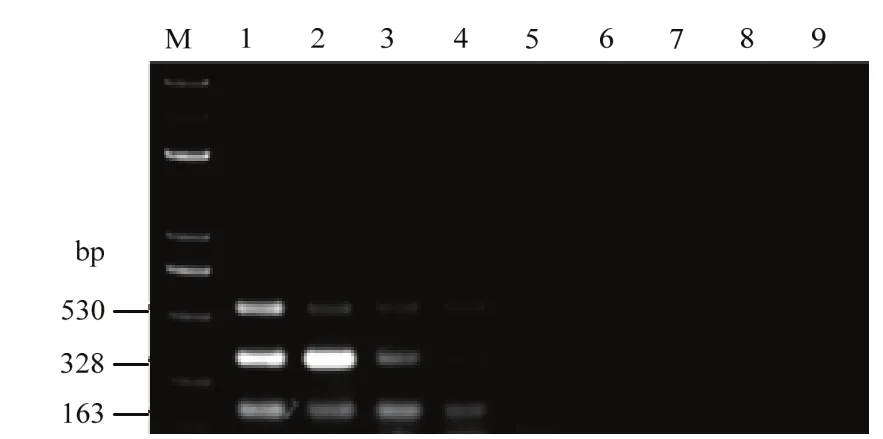
图6 模拟带菌基质三重PCR检测灵敏度Fig. 6 Sensitivity of triplex PCR detection in artificially inoculated substrate
2.7 三重PCR体系的应用
分别从35份病组织和149份土壤中提取基因组DNA,进行三重PCR检测。结果显示4份病组织中检测到大丽轮枝菌,3份病组织中检测到瓜果腐霉,18份病组织中检测到尖镰孢,10份病组织中未检测到目标菌,病菌检出率为71.43%,检测结果与病害症状及分离培养结果吻合;在土壤检测中19份土壤检测到大丽轮枝菌,22份土壤检测到尖镰孢,30份土壤检测到瓜果腐霉,78份土壤中未检测到目标菌,检测结果与分离培养结果吻合(表 4)。由此可见,通过对蔬菜病组织及其根围土壤进行三重PCR检测,可进行田间蔬菜瓜果腐霉、尖镰孢和大丽轮枝菌的快速诊断。

表4 不同地区病害样本三重PCR检测Table 4 Identification of diseases samples in different areas by triplex PCR
3 讨论
我国蔬菜生产种苗需求量超过6 800亿株/年,育苗基质需求量大[25],由于育苗基质原料来源复杂,基质生产未能实现标准化,由基质带菌引起的蔬菜土传病害大面积发生问题时有发生,造成严重的经济损失。2015年渭南市大荔、临渭等西瓜产区种植户使用育苗基质培育西瓜苗后造成80%以上秧苗叶片发黄、根茎 部 腐 烂 ( http://bbs.hsw.cn/read-htm-tid-7334210-displayMode-1.html);2017年8月,河南省崇召村菜农购买的育苗基质带菌,造成白菜、西兰花等蔬菜叶片大面积发黄、枯萎(http://www.cfvin.com/n/2017/08/24/164307287466.shtml)。因此,为防止基质带菌引起土传病害发生和传播,基质出厂前的带菌检测非常重要。目前国内对蔬菜土传病原菌的多重PCR体系报道较少,大多为在植株发病后根据病情对相应的病原菌进行普通PCR检测,但此种方法不能提前发现基质中的病原菌,具有滞后性,且每次只能检测一种病原菌,而病原菌复合侵染情况在田间普遍存在,因此能够同时检测多种病原菌的多重 PCR技术具有较大的应用价值。
多重PCR是在同一PCR体系里加入多对特异性引物,体系复杂,因素影响多,所以多重PCR反应体系建立较难。其中引物的选择直接影响PCR扩增的特异性与灵敏度,同时要防止引物相互配对,又要能够区分扩增片段大小。因此,需要选择适合长度的引物序列,从而获得最优的检测灵敏度和特异性以及各目标片段扩增均一性[26-27]。目前国际上关于瓜果腐霉、尖镰孢和大丽轮枝菌的分子检测研究较多[12-17],但同时检测这3种病原菌的多重PCR尚未见报道。根据多重PCR引物设计原则,本研究在参考大量文献引物的基础上,通过NCBI网站进行引物组BLAST比对,筛选出适用于多重PCR的引物组合,成功建立了对瓜果腐霉、尖镰孢和大丽轮枝菌进行检测的三重PCR检测体系。该体系降低了检测过程的复杂性和成本,节省时间并提高了检测的准确性,在混合 DNA下检测灵敏度为10-1ng·μL-1,与何宛芹等[28]根据EF-1α基因设计引物建立的镰孢菌四重 PCR检测体系灵敏度一致。孙娟等[29]建立了能够同步检测棉花黄萎病菌、枯萎病菌和炭疽病菌的三重 PCR检测体系,灵敏度为1.06 ng·μL-1,其灵敏度低于本研究所建立的三重PCR检测体系。
另外,本研究建立的三重PCR检测体系可用于基质中病原菌的检测,做到了预防病害发生,满足当前生产需要。同时,克服了土壤检测中病原菌含量少、杂质多等弊端,每克土壤中含有 106个孢子即可被检测到。土壤微生物总 DNA的富集和提取是该检测手段实际应用中的关键问题,仍需进一步深入研究。本研究建立的三重 PCR体系可以在早期准确地检测出田间蔬菜病株根围土壤中的瓜果腐霉、尖镰孢和大丽轮枝菌,在病害潜伏期和发病初期就能对3种病害进行快速诊断,从而有效预防和控制蔬菜病害,具有较高的应用价值。
4 结论
通过引物筛选组合和条件优化,建立了可同时检测瓜果腐霉、尖镰孢和大丽轮枝菌3种蔬菜重要病原菌的三重PCR体系。该体系具有灵敏度高、稳定性和重复性好的特点,能够快速、准确地检测田间病株及其根围土壤中的瓜果腐霉、尖镰孢、大丽轮枝菌,为蔬菜土传病害的早期预防和流行监测提供了有效的技术手段。
