分子标记辅助离体叶片接种鉴定甜瓜蔓枯病极端抗感单株
2019-07-04任琴琴鲁秀梅柯思佳钱春桃
任琴琴 鲁秀梅 柯思佳 钱春桃


摘 要: 为了构建抗感基因池,快速准确筛选抗感单株,进行抗蔓枯病基因的精细定位,加速育种进程,采用分子标记辅助离体叶片接种鉴定,筛选极端抗感单株。研究结果表明,利用甜瓜F2群体的96株植株,接种5 d后快速准确筛选到抗感单株分别为17株和15株,抗感植株的离体叶片接种鉴定与分子标记筛选的相关系数分别达0.85和0.68。
关键词: 甜瓜;蔓枯病;分子标记;离体叶片;接种鉴定
In vitro leaf inoculation combing with molecular marker selection to identify extreme resistance and susceptibility of melon to gummy stem blight
REN Qinqin,LU Xiumei,KE Sijia,QIAN Chuntao
(State Key Laboratory of Crop Genetics and Germplasm Enhancement,College of Horticulture, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China)
Abstract: In order to rapidly and accurately screen resistant plants, gene pools of resistant and susceptible were constructed to fine map resistance genes to gummy stem blight , aiming to accelerate the breeding process.In this study, in vitro leaf inoculation combing with molecular marker-assisted selection was performed to identify extreme resistant plants. Results have shown that 96 indivduals of melon F2 population were used to screen rapidly and accurately 17 resitant plants and 15 susceptible plants 5 days after inoculation. The resistance and susceptible correlation coefficients of in vitro leaf inoculation identification and molecular marker screening results were 0.85 and 0.68, respectively.
Key words: Melon; Gummy stem blight; Molecular marker; In vitro leaf; Inoculation identification
甜瓜是世界上十大水果之一,營养丰富,深受消费者的喜爱。蔓枯病是限制甜瓜优质、高产的主要病害之一。在我国浙江、江苏、河南、甘肃、新疆等地均有蔓枯病爆发,而且呈逐年加重趋势[1],筛选抗蔓枯病资源和培育抗蔓枯病品种具有重要意义[2]。常规育种周期长,常依赖于育种家的经验和机遇,带有很大的盲目性和机遇性,而分子标记可以提高育种效率。
‘PI 420145是葫芦科甜瓜属甜瓜种质资源,起源于日本,经研究发现属于高抗蔓枯病的甜瓜材料,在江苏一带地区栽培,综合性状优良;抗性遗传规律为单个显性基因控制[3-4],同时,Wolukau等[4-5]利用感病亲本‘PI 5136170和抗病‘PI 420145,构建F2群体,苗期活体接种鉴定,筛选到抗感植株,采用BSA分析和AFLP引物进行分子标记,筛选得到4个与其所含抗病基因Gsb-6连锁的AFLP标记,但由于存在遗传距离较远,筛选率低。因此需筛选抗感单株、构建抗感基因池,需更进一步的抗蔓枯病基因的精细定位,加速抗蔓枯病育种进程。
对现有的种质资源进行抗性鉴定是建立抗感基因池的前提。目前,国内对甜瓜蔓枯病的抗性鉴定多采用苗期接种鉴定[6],多项研究表明,苗期接种鉴定易受温度、湿度等环境条件的影响,且单一鉴定方法常造成鉴定结果不稳定,不能完全反应材料的抗性程度[7];此外,苗期接种发病周期长、成本高,植株接种后无法进行后续的生长研究使用,对甜瓜蔓枯病鉴定的准确性有一定影响[8-9]。而采用离体接种鉴定具有准确、快速、筛选量大、受外界环境条件影响较小等优点[10]。因此,利用致病性极强的蔓枯病原菌,以抗病材料‘PI 420145、感病材料‘白皮脆及杂交F2群体进行分子标记辅助离体叶片接种方法鉴定,更快、更精确地筛选到抗感单株,构建抗感基因池,提高育种效率。
1 材料与方法
1.1 材料
试验于2018年8—10月在南京农业大学白马基地网室进行,8月1日播种,8月20日定植,9月5日取第3片展开的真叶进行离体叶片接种鉴定,9月10日统计病情。试验所用材料:感病材料‘白皮脆、抗病材料‘PI 420145以及‘白皮脆与‘PI 420145杂交所得的F2代,感病材料和抗病材料分别由新疆农业科学院和葫芦科作物遗传与种质创新试验室提供,均由葫芦科作物遗传与种质创新试验室连续多代自交保存。试验所用蔓枯病病原菌由江苏省农科院提供,经葫芦科作物遗传与种质创新试验室分离纯化并保存的DBJSJY2菌株。
1.2 蔓枯病菌培养
参照Li[11]的方法,诱导蔓枯病菌产生分生孢子:选取纯性蔓枯病原菌DBJSJY2,接种试验前,将蔓枯病菌DBJSJY2接种到PDA培养基上(土豆200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 L),26~28 ℃条件下暗培养1周。
1.3 离体叶片菌丝块接种
接种方法参照Wang等[12]方法稍作改动:取甜瓜植株展开的第3或第4片真叶(保留叶柄),用无菌水冲洗干净,晾干后放置到铺有2层滤纸的培养皿中。统一采用直径为0.5 cm的灭菌打孔器切取菌丝块,接种到甜瓜叶片的中央,每个叶片接种1个菌丝块,将培养皿放在光照培养箱中培养,培养温度(26±1) ℃,16 h光照/8 h黑暗,相对湿度90%~95%。培养5 d后,测量病原菌的扩展半径,分析甜瓜对病原菌侵染的敏感性。
叶片侵染病情分级标准如下,1级:扩展半径<1.8 cm,2级:1.8 cm≤扩展半径<2.3 cm,3级:2.3 cm≤扩展半径<2.8 cm,4级:2.8 cm≤扩展半径<3.3 cm,5级:扩展半径≥3.3 cm。其中,1级为高抗(HR),2级为抗(R),3级为中抗(MR),4級为感(S),5级为高感(HS)。
1.4 分子标记辅助筛选
待植株长至3叶1心时,取甜瓜幼嫩叶片0.8~1.0 g于2.0 mL的离心管中,浸入液氮研磨成粉末,采用改良CTAB法[13]提取DNA。选用Wolukau[5]等筛选的分子标记进行蔓枯病抗性筛选鉴定(表1)。
用于检测抗病基因Gsb-6由葫芦科作物遗传与种质创新试验室设计,由南京擎科生物科技有限公司合成(表1)。PCR程序总反应体系为20 ?L(包括10×buffer 10.0 ?L,10 ?mol·L-1前后引物各1.0 ?L,30 ng·?L-1模板DNA 1.0 ?L,ddH2O 7.0 ?L)。扩增反应在TaKaRa PCR仪中进行。反应条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 80 s,40个循环;72 ℃延伸 5 min。PCR产物在聚丙烯酰胺凝胶上电泳,采用银染方法检测。
1.5 数据分析
采用Microsoft Office Excel 2003和SPSS 20.0软件对试验数据进行统计、相关性分析和卡方值检验。
2 结果与分析
2.1 蔓枯病分子标记辅助鉴定
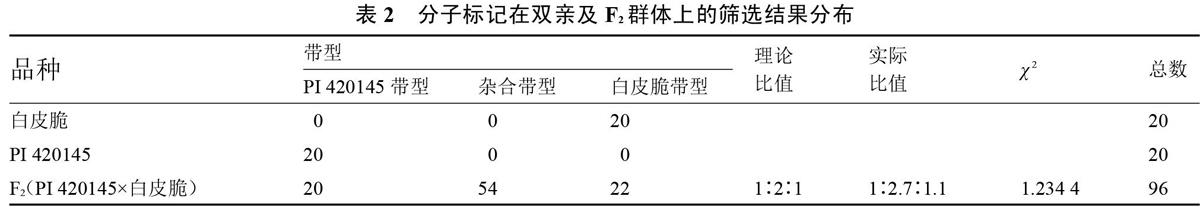
对亲本及F2群体的96株植株进行筛选(表2),20株亲本‘白皮脆‘PI 420145各扩增出20条‘白皮脆带型和20条‘PI 420145带型。F2群体中,20株扩增出‘PI 420145带型,54株扩增出杂合带型,22株扩增出‘白皮脆带型。由此可知,共筛选到20株纯合抗性植株,分离比为1∶2.7∶1.1,经卡平方检验,χ 2=1.234 4<χ0.05,1=3.84,分离比近似接近1∶2∶1,与Wolukau等[4]的研究结果一致。
2.2 蔓枯病抗性离体叶片接种鉴定分析
对两亲本进行离体叶片接种发现(图1),抗感品种的病斑大小和扩展速度不同。接种第5天后,20株‘白皮脆全表现为感病,扩展半径在3.07 cm到4.05 cm不等,其中12株感病植株的病情级别为4级,8株高感植株的病情级别为5级;20株‘PI 420145鉴定结果全表现为抗病,扩展半径在1.45 cm到2.1 cm不等,10株高抗植株的病情级别为1级,10株抗病植株的病情级别为2级。
进一步对分子标记筛选到的20株抗性植株和22株感病植株进行离体叶片接种鉴定,结果见表3、表4。经测量发现,抗感植株菌丝侵染扩展范围差异明显,抗性级别从1级到5级不等,扩展半径从1.5 cm到3.9 cm不等。其中,20株抗病植株中,筛出高抗、抗、中抗植株分别有8株、9株、3株;22株感病植株中,筛选出感病、高感植株分别有7株、15株。
2.3 分子标记辅助筛选与离体叶片接种方法相关性分析
表2、表3、表4结果显示,利用分子标记筛选到20株纯合抗性植株和22株感病植株;筛选到极端高抗、高感植株分别为17和15株,抗感分子标记辅助筛选与离体叶片接种鉴定结果的相关系数分别为到0.85和0.68。由此可见,分子标记筛选与离体叶片接种鉴定是高度相关的。
3 讨论与结论
人工接种鉴定是筛选抗蔓枯病资源的重要组成部分,为构建抗感基因池,筛选抗感单株,是甜瓜抗病性育种的前提。离体接种鉴定具有在空间有限的条件下,短时间内大量快速准确鉴定抗感材料,而且不易受环境条件的影响[14],并已在菜瓜、甜瓜、黄瓜、西瓜等园艺作物上被广泛运用于蔓枯病、叶斑病、黑星病、炭疽病等的抗性鉴定[15-16]。姚协丰、张永兵等[16-17]研究表明,感病材料离体叶片接种蔓枯病菌后,有不同程度的扩展;而在抗病材料中,没有被侵染的现象。在本试验中,感病材料离体接种后结果与此相一致;而在抗病材料中,与张永兵等[16]的研究结果不一致,离体接种后也有不同程度的侵染;这可能与研究所用的抗性材料抗性、培养条件、病原菌不同有关。张艳苓等[18]研究发现,苗期人工接种鉴定与成株期田间鉴定存在显著差异,下一步对离体叶片接种鉴定的扩展速率及不同时期发病率进行研究。
利用分子标记辅助筛选抗病基因的可靠性主要取决于分子标记与基因的连锁距离,即连锁距离越近,辅助选择的准确性越高[19-20]。本研究中所用的分子标记与抗病基因Gsb-6的遗传连锁距离为2.0 cM,但存在筛选率低的问题,因此需进一步的进行抗蔓枯病的进行定位。本试验中,利用抗蔓枯病基因Gsb-6在F2群体的96株植株中共筛选到20株纯合抗性植株,54株杂合抗病植株,22株感病植株,利用离体叶片接种鉴定,高抗性植株和高感植株的筛选率分别达到85%和68%,与宋茂兴等[21]的研究结果一致。
本研究结果表明,利用分子标记辅助甜瓜蔓枯病离体叶片接种鉴定具有发病快,缩短检测周期,接种5 d后就可得到鉴定结果;同时节省空间,降低试验成本;同时植株离体接种后还可进行后续的研究使用,操作简便等优势。因此,利用分子标记辅助离体叶片接种快速准确地筛选抗感抗感单株,构建抗感基因池,加速抗蔓枯病基因精细定位的进程,为甜瓜极端抗感基因池的筛选鉴定提供一条新的研究思路。
参考文献
[1] 李英.瓜类蔓枯病菌的生物学特性和黄瓜抗病资源的筛选[D].南京:南京农业大学,2007.
[2] 毕研飞,徐兵划,郭静,等.分子标记辅助甜瓜抗蔓枯病基因聚合及‘白皮脆品种改良[J].南京农业大学学报,2015,38(3):375-380.
[3] WOLUKAU J N,ZHOU X H,LI Y,et al.Resistance to gummy stem blight in melon (Cucumis melo L.) germplasm and inheritance of resistance from plant introductions 157076,420145,and 323498[J].Hortscience A Publication of the American Society for Horticultural Science,2007,42(2):215-221.
[4] WOLUKAU J N.甜瓜抗蔓枯病的遺传学、系统发生学和分子标记的研究[D].南京:南京农业大学,2007.
[5] WOLUKAU J N,ZHOU X,CHEN J F.Identification of amplified fragment length polymorphism markers linked to gummy stem blight (Didymella bryoniae) resistance in melon (Cusumis melo L.) PI 420145[J].HortScience,2009,44(1):32-34.
[6] 张学军,郭丽霞,马新力,等.甜瓜种质资源抗霜霉病和蔓枯病苗期筛选与评价[J].中国瓜菜,2014,27(S1):38-40.
[7] 林代福.应用离体接种技术鉴定稻瘟病菌生理小种[J].植物保护,1998,24(4):29-30.
[8] ZHANG Y P,KYLE M,ANAGNOSTOU K,et al.Screening melon (Cucumis melo) for resistance to gummy stem blight in the greenhouse and field[J].Hortscience A Publication of the American Society for Horticultural Science,1997,32(1):117-121.
[9] FRANTZ J D,JAHN M M.Five independent loci each control monogenic resistance to gummy stem blight in melon (Cucumis melo L.)[J].Theoretical & Applied Genetics,2004,108(6):1033-1038.
[10] 何文兰,宋玉立,张忠山,等.用小麦离体叶段鉴定抗白粉病性的方法[J].作物学报,1998,24(6):916-918.
[11] LI P F,REN R S,YAO X F,et al.Identification and characterization of the causal agent of gummy stem blight from muskmelon and watermelon in east China[J].Journal of Phytopathology,2015,163(4):314-319.
[12] WANG H,HWANG S F,CHANG K F,et al.Characterization of ascochyta isolates and susceptibility of pea cultivars to the ascochyta disease complex in alberta[J].Plant Pathology,2000,49(5):540-545.
[13] SUN X M,CHEN X,DENG Z X,et al.A CTAB-assisted hydrothermal orientation growth of ZnO nanorods[J].Materials Chemistry & Physics,2003,78(1):99-104.
[14] 张彪,黄军艳,刘胜毅,等.大豆灰斑病菌菌丝块离体叶接种快速鉴定方法的建立[J].安徽农业科学,2011,39(21):12714-12718.
[15] 文生仓,王鸣.西瓜炭疽病人工接种鉴定的新方法──离体叶接种和AD评价法[J].西北农业大学学报,1994(1):17-22.
[16] 张永兵,王登明,张聪,等.甜瓜蔓枯病离体接种方法初步研究[J].新疆农业科学,2009,46(3):521-525.
[17] 姚协丰,徐锦华,李苹芳,等.菜瓜蔓枯病苗期抗性鉴定方法比较[J].中国瓜菜,2017,30(2):11-14.
[18] 张艳苓,卜崇兴,李谦盛,等.网纹甜瓜苗期和成株期蔓枯病抗性的鉴定和相关性[J].上海农业学报,2006,22(4):83-85.
[19] ZALAPA J E,STAUB J E,MCCREIGHT J D,et al.Detection of QTL for yield-related traits using recombinant inbred lines derived from exotic and elite US western shipping melon germplasm[J].Theoretical and Applied Genetics,2007,114(7):1185-1201.
[20] PALOMARES-RIUS F J,VIRUEL M A,YUSTE-LISBONA F J,et al.Simple sequence repeat markers linked to QTL for resistance to watermelon mosaic virus in melon[J].Theoretical & Applied Genetics,2011,123(7):1207-1214.
[21] 宋茂兴,瞿会,闫伟,等.2个玉米抗矮花叶病分子标记的有效性评价[J].植物遗传资源学报,2016,17(3):555-561.
