不同形貌升华氧化钼的还原动力学研究
2019-07-04杨秦莉卜春阳崔玉青
杨秦莉,庄 飞,席 莎,卜春阳,崔玉青,何 凯
(金堆城钼业股份有限公司技术中心,陕西 西安 710077)
0 引 言
三氧化钼既是制备金属钼、钼合金及钼化合物的原料,也在催化剂、高效阻燃抑烟剂、医药等领域有着广泛的应用[1]。工业化批量生产高纯三氧化钼的传统方法是焙烧—氨浸—热解法,大多制备出的是微米级[2]。而实验室制备方法有沉淀法、水热法、化学气相沉积法、凝胶法等,这些方法制备的MoO3形貌多样,有纤维状、片状、棒状、球形等,一般为纳米级[3-4]。本文以自制升华炉生产的纳米级MoO3为原料,研究不同形貌的氢还原动力学,以期对升华法生产的不同氧化钼的还原性能有初步了解,为今后大规模用升华法生产MoO3制备超细钼粉提供理论指导。
1 实验原料与方法
1.1 实验原料
实验原料采用不同升华和冷凝工艺生产的2种不同的MoO3,1#MoO3为厚薄片状,松装密度0.14 g/cm3; 2#MoO3为纤维状、少量球形,松装密度0.22 g/cm3。图1、图2分别为不同形貌升华氧化钼的形貌和XRD。

图1 不同升华MoO3的形貌
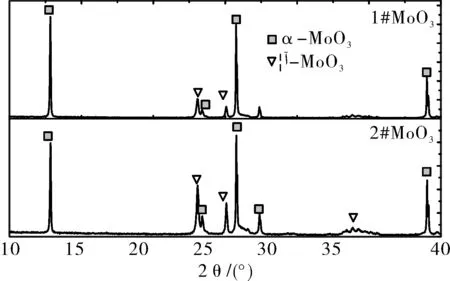
图2 不同升华MoO3的XRD分析
1.2 实验方法
采用热重分析仪进行不同形貌升华氧化钼的H2还原过程分析。首先将升华氧化钼放入氧化铝坩埚内,然后将此坩埚放入热重分析仪中固定位置,通入氩气,排出反应器内的空气;一定时间后切换还原气体,升温速率β分别为3 ℃/min、5 ℃/min和10 ℃/min,H2流量为60 mL/min,样品质量为30 mg,最终温度为900 ℃。反应结束后,再用氩气切换还原气体,直至样品完全冷却后,关闭氩气,取出样品。
2 结果与讨论
2.1 不同形貌升华氧化钼的变温热分析
将两种不同形貌升华氧化钼,分别以3 ℃/min、5 ℃/min、10 ℃/min为升温速率进行热分析,升温速率为3 ℃/min下的不同形貌升华氧化钼TG-DTA曲线图见图3,将TG曲线进行微分,得到和普通氧化钼的DTG曲线对比图见图4,不同升温速率的 DTG曲线见图5。
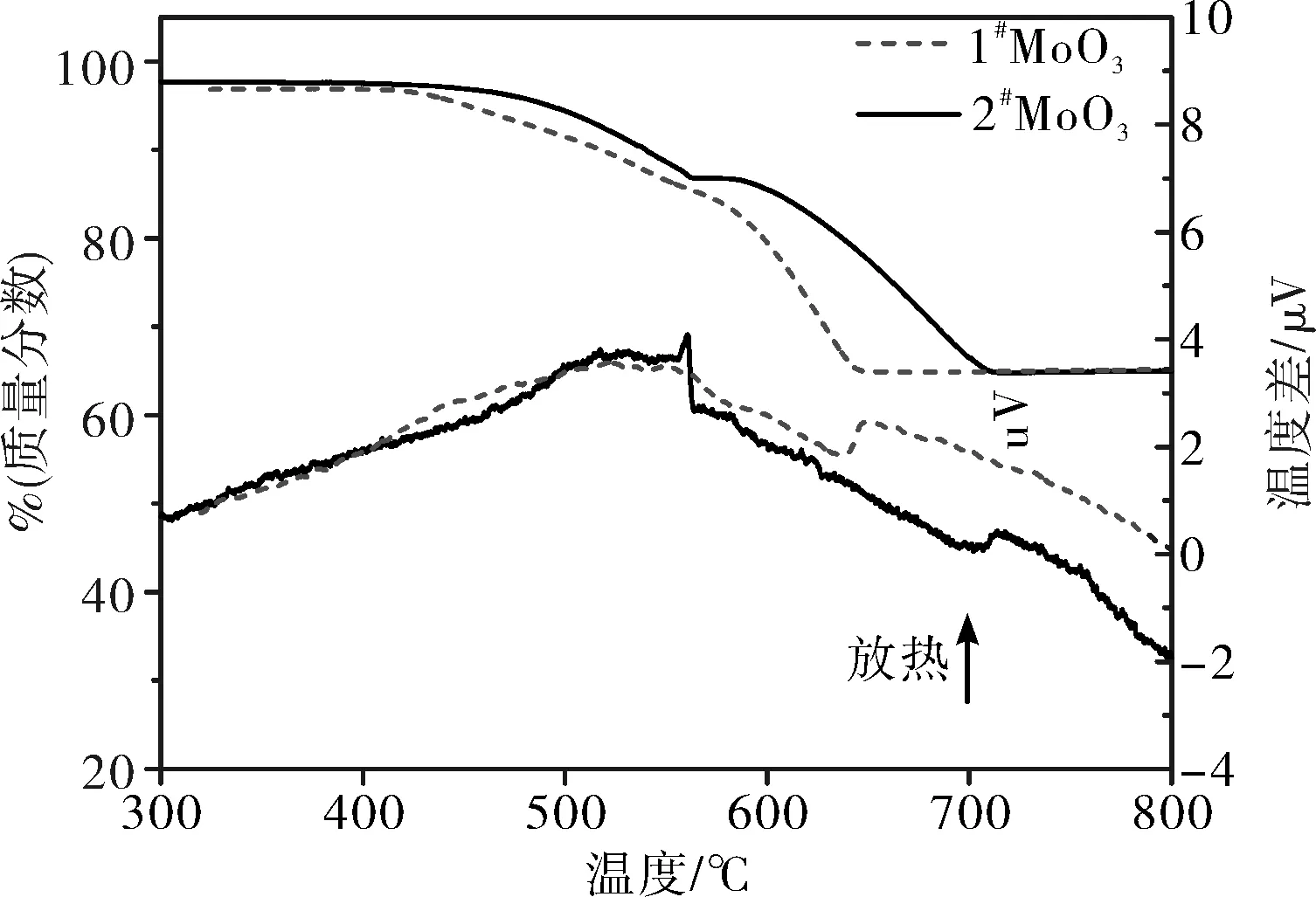
图3 升华MoO3的TG-DTA曲线图
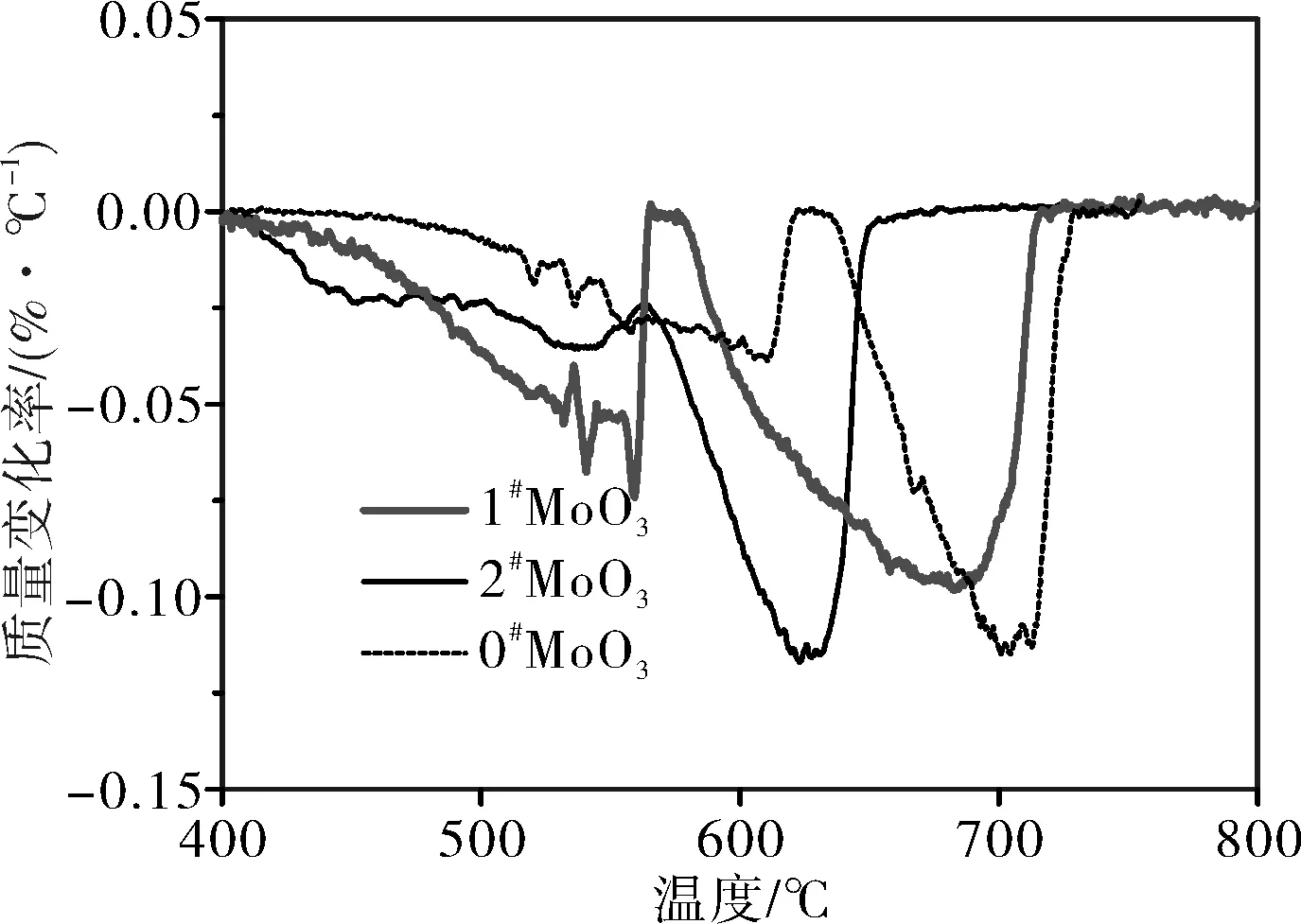
图4 升华MoO3和普通氧化钼的DTG曲线图
由图3中可以看出:氧化钼还原分为2段, TG中有明显的2个台阶,即为MoO3的2段还原;DTA的2个峰值,其中第一个峰为放热峰,是MoO3和氢气反应脱掉一个氧生成MoO2的过程。第二峰为吸热峰,是MoO2脱掉2个氧生成Mo的过程。虽然两种升华氧化钼还原反应的温度范围不一致,但最终总失重率基本达到35%,原料的Mo含量在65%左右,说明还原完全。
由图4和DTA曲线知,一段还原起始反应温度普通氧化钼(0#)500 ℃左右,终止温度630 ℃。而升华氧化钼起始反应温度400 ℃,终止560 ℃;二段还原反应同样升华氧化钼的起终温度都低于普通氧化钼(0#)。说明升华氧化钼相对较容易还原。主要原因是升华氧化钼的颗粒尺寸小,表面活性大,需要的能量低,因此容易被还原。
2种不同形貌升华钼的两段还原反应有差异。一段还原反应1#MoO3和2#MoO3反应起止温度几乎相同但失重速率有差异,480 ℃以前 1#MoO3失重速率明显高于2#MoO3,480 ℃以后1#MoO3失重速率明显低于2#MoO3。分析原因认为 2#MoO3有球状和纤维状,球状的为β-MoO3,其热力学稳定性相对较差,需要先转变为α-MoO3[5]再和氢气进行还原反应,因此,480 ℃以前失重速率较慢。而480 ℃以后纤维状的α-MoO3已经开始反应,它的颗粒尺寸细而长,故而反应相对加快。1#MoO3为大小颗粒均匀的片状,480 ℃以前物料表面开始反应,反应速度较快,当进行到物料层下部时,因为片状粉末透气性差,且氢气渗入和水蒸气逸出都相对较困难故而反应速度减慢。
二段还原反应明显2#MoO3失重曲线向右偏移,说明2#MoO3生成的MoO2需要比1#MoO2更高的还原温度。分析可能是原料的形貌和粒度遗传性导致了生成的MoO2物理指标有差异,进而使两者还原所需的温度有差异。
随着升温速率的逐渐增大,2种升华氧化钼的 DTG曲线都向右偏移,失重速率最大值的峰顶温度都升高,DTG曲线得到的峰顶温度Tp见表2。不同升温速率下峰顶温度相差80 ℃左右,这主要是因为升温速率越大,会使炉膛与样品之间的温度差越大,样品颗粒内外的温差变大,样品颗粒外部温度高,内部温度低,颗粒内部的水蒸气逸出慢,导致了还原反应的进程减慢。相同升温速率下,2种不同氧化钼一段还原反应速率最快的峰顶温度1#MoO3比2#MoO3高10 ℃左右,相差较小。而二段反应峰顶温度1#MoO3比2#MoO3低70 ℃左右,相差相对较大。
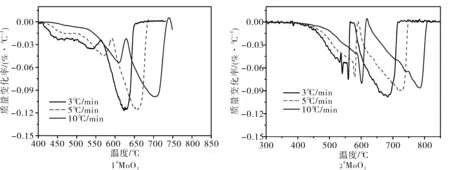
图5 两种不同氧化钼的DTG曲线
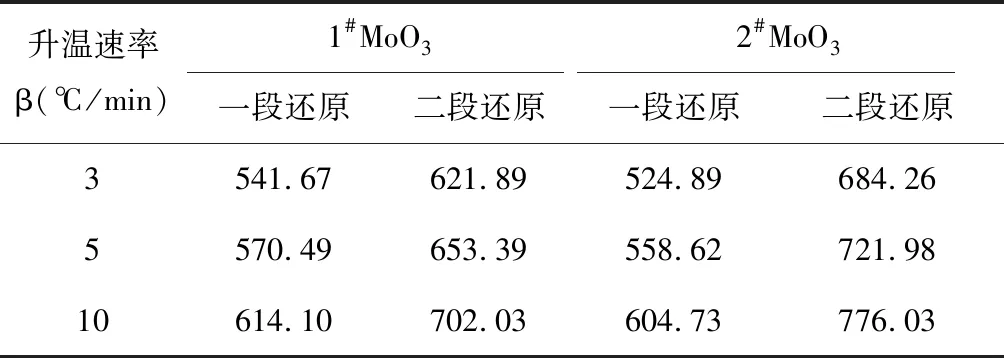
表2 不同升温速率下两种氧化钼的峰顶温度 ℃
2.2 不同形貌升华氧化钼的热力学参数计算
采用线性升温控制程序时,非等温线性升温条件下的动力学方程为:
式中:T为温度(K);β为升温速率(K/min);f(α)为分形式的反应机理函数;A为指前因子(1/min); R为普适气体常量(8.314 J/mol·K);E为反应活化能(kJ/mol)。
由于Flynn-Wall-Ozawa法(简称FWO法)(积分法)和Kissinger法(微分法)不涉及反应机理函数,与其他方法相比,避免了因反应函数的假设不同而可能带来的误差,所以热分析动力学曲线用这两种方法分析[5]。
FWO法公式
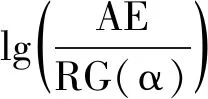
Kissinger公式:
根据表2的峰顶温度,再分别按照FWO法和 kissinger法对不同升华MoO3的一段和二段还原进行动力学参数计算,结果见表3。
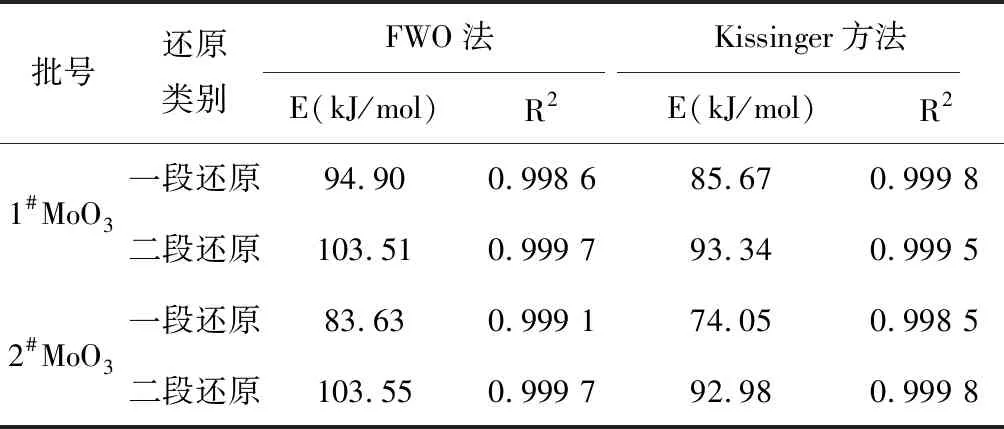
表3 两种不同方法计算的动力学参数
表3中,两种方法计算出的表观活化能均为一段还原中2种MoO3的表观活化能,1#较2#高,二段还原的表观活化能几乎相同。说明一段还原中1#MoO3较2#MoO3所需的能量要大,还原温度相对较高。两种方法计算的活化能接近,说明用这两种方法计算升华氧化钼的热力学参数可行。将这两种方法活化能进行平均可得到:1#MoO3的一段表观活化能为89.26 kJ/mol,二段表观活化能为103.53 kJ/mol。2#MoO3的一段表观活化能79.86 kJ/mol,二段表观活化能为93.16 kJ/mol。2#MoO3比1#MoO3的一段还原表观活化能低,这也符合活化能越低,反应速率越快的原理;二段还原表观活化能与文献[5]获得的值(104.36 kJ/mol)相近。
3 结 论
(1)不同形貌升华氧化钼粒度小,相同升温速率下,一段起止还原温度均为400 ℃和560 ℃,比普通氧化钼的起止还原温度分别低出100 ℃和70 ℃左右。
(2)两种不同形貌升华氧化钼反应失重速率有差异。480 ℃前 1#MoO3失重速率高于2#MoO3, 480 ℃后1#MoO3失重速率低于2#MoO3。二段还原反应1#MoO3的反应温度较2#MoO3低。
(3)通过用Flynn-Wall-Ozawa和Kissinger动力学分析方法计算2种不同形貌升华氧化钼的一段平均表观活化能,1#MoO3为89.26 kJ/mol,2#MoO3为79.86 kJ/mol,而二段表观活化能1#MoO3平均为103.53 kJ/mol,2#MoO3为93.16 kJ/mol。
