尼莫地平对邻苯二甲酸二丁酯所致小鼠学习记忆障碍的拮抗作用
2019-07-04陈谦学田道锋刘宝辉
王 龙,葛 剑,陈谦学,田道锋,刘宝辉,晏 彪
(1. 武汉大学人民医院神经外科,湖北 武汉 430060;2. 武警湖北总队医院神经外科,湖北 武汉 430061;3. 湖北科技学院基础医学院,湖北 咸宁 437100)
学习能力障碍(learning disability,LD)常出现在儿童期,又称儿童学习困难,最近美国《精神障碍诊断与统计手册(第五版)》将其定义为神经发育障碍,是世界各国普遍存在并引起广泛关注的儿童疾病之一。有研究指出[1],约3%的神经发育障碍是由环境污染物暴露直接引起,另有25%是由广泛界定的环境因素与遗传易感性之间的相互作用导致。邻苯二甲酸二丁酯(dibutyl phthalate,DBP)作为一类典型的具有神经毒性的持久性有机污染物,可通过日常饮食、吸入和皮肤接触等途径影响儿童的学习、记忆能力[2-3]。Cho等[2]的流行病学研究提示,DBP暴露可明显降低小学生的学习成绩和智商。一些研究证实,孕期DBP暴露可持续诱发儿童的LD[3]。Wojtowicz等[4]研究揭示,DBP暴露所致儿童LD的关键在于:DBP可通过孕妇胎盘和婴幼儿血脑屏障,导致脑海马神经元凋亡,但其机制有待进一步阐明。
细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)主要包括ERK1和ERK2,与细胞凋亡、细胞增殖等重要生理过程存在联系[5],ERK1/2通路活化可能参与DBP诱导的海马神经元凋亡。有资料显示[6],ERK1/2通路活化涉及的内源性细胞凋亡与线粒体通透性增加(胞内Ca2+增加)、细胞色素C(cytochrome C,Cyt C)释放、caspase-3的激活密切相关。尼莫地平(nimodipine,Nim)作为第2代二氢吡啶类Ca2+拮抗剂,在脑相关疾病治疗中具有较大的临床应用价值。近年资料表明[7],Nim对神经元有直接作用,具有神经和精神药理活性,可保护和促进记忆、智力恢复,但目前尚未见报道Nim对DBP所致学习记忆障碍的作用。本实验拟探究Nim对DBP所致KM小鼠学习记忆障碍的拮抗作用及其可能机制。
1 材料与方法
1.1 试剂与仪器DBP(纯度≥99.6%,货号84742)、Nim (纯度≥98%,货号N149)、Hoechst 33258荧光染料,均购自美国Sigma-Aldrich;TUNEL细胞凋亡原位试剂盒(南京凯基生物技术公司);钙调蛋白(calmodulin,CaM)、钙/钙调素依赖性蛋白激酶II(calcium/calmodulin dependent protein kinase II,CaMKII)、蛋白激酶C(protein kinase C,PKC)、Cyt C、caspase-3酶联免疫试剂盒,均购自美国eBioscience;β-actin抗体(Abcam公司,货号ab37168);ERK(货号4695)、p-ERK(货号4370)抗体,均购自国CST。EthoVision XT Version 12.0实验动物神经行为记录仪(荷兰Noldus);蛋白电泳及转膜系统(美国Bio-Rad);凝胶成像及分析系统(英国Syngene);RM2245切片机(德国LEICA);BX53显微镜(日本Olympus);ELx800酶标仪(美国Bio-Tek)。
1.2 实验动物SPF级♂KM小鼠,体质量(18±1)g,购自湖北省实验动物研究中心,许可证号:SYXK(鄂)2015-0052。所有小鼠均饲养于SPF级标准动物房内,提供自由饮食,房间温度保持在(20~25) ℃,湿度为50%~70%,光照/黑暗周期为12 h。
1.3 实验分组与处理36只KM小鼠随机分成4组:对照组、50 mg·kg-1DBP组、2 mg·kg-1Nim组、50 mg·kg-1DBP+2 mg·kg-1Nim组(DBP+Nim)。DBP先用Tween 80助溶,再用生理盐水稀释至终浓度,DBP剂量及灌胃给药途径参考Yan等报道[8],Nim剂量及腹腔给药途径参考Karande等报道[9]。给药处理如下:实验期间每天上午固定时间给药,DBP组小鼠每天灌胃50 mg·kg-1DBP 1次,给药体积为10 mL·kg-1,连续给药28 d;DBP+Nim组小鼠每天腹腔注射2 mg·kg-1Nim 1次,30 min后再灌胃给予50 mg·kg-1DBP,连续给药28 d。
1.4 指标与方法
1.4.1Morris水迷宫(morris water maze, MWM)实验 MWM实验选用直径为100 cm圆桶形水箱,水深20 cm,水温控制范围(23±1)℃,逃逸平台位于SW象限的正中央,距离水面0.5 cm。小鼠的游泳轨迹等数据由水池正上方的摄像机记录,影像数据记录传入计算机,通过EthoVision软件分析。小鼠于给药d 22~26进行水迷宫定向航行训练,d 27为遗忘期,d 28撤掉平台后,进行空间探索实验,检测小鼠寻找目标平台的时间,记为逃逸潜伏期(s)。
1.4.2脑海马CA1区切片病理学观察 实验取材的脑海马组织用4%多聚甲醛固定,常规脱水,石腊包埋切片,进行苏木精-伊红(HE)染色和Nissl染色,显微镜下观察脑海马组织CA1的病理变化,拍片(×400倍)。
1.4.3脑海马CA1区Hoechst 33258荧光染色 脑海马组织CA1区切片经工作浓度为5 mg·L-1Hoechst 33258荧光染液,染色5 min,用PBS水洗两遍后,置于荧光显微镜下观察,拍片(×200倍)。
1.4.4脑海马CA1区TUNEL染色 脑海马组织CA1区切片用二甲苯浸洗2次,每次5 min,脱蜡后用梯度乙醇(100%、95%、90%、80%、70%)至水,经蛋白酶K工作液(20 mg·L-1) 在室温下处理15 min,PBS漂洗2次;加50 μL TUNEL反应混合液(阴性对照组仅加50 μL荧光素标记的dUTP液)于标本上,暗湿盒中37 ℃孵育60 min。PBS漂洗后,加100 μL DAB混合液(50 μL DAB+50 μL DAB底物缓冲液+50 μL H2O2+950 μL三蒸水)10 min显色,荧光显微镜下观察,拍片(×200倍)。
1.4.5Western blot检测脑海马ERK、p-ERK蛋白表达 脑海马用预冷的PBS缓冲液漂洗2~3次,去除血污,剪成小块置于匀浆器中。加入10倍于组织体积的蛋白提取试剂,冰浴彻底匀浆。将匀浆液转移至离心管中,振荡。冰浴30 min,期间用移液器反复吹打,确保匀浆液完全裂解。4 ℃、12 000 r·min-1离心5 min,收集上清,即为总蛋白溶液,测定样品蛋白浓度。10% SDS-PAGE电泳分离蛋白,转至PVDF膜上,加一抗封闭缓冲液室温封闭1 h,再分别加入一抗4 ℃过夜。用TBST洗膜3次,每次5 min,再加入二抗,室温孵育30 min,ECL显影。胶片扫描后,用AlphaEaseFC软件分析目标带的光密度值。
1.4.6脑海马CaM、CaMKII、PKC、Cyt C及caspase-3水平的检测 小鼠经称重后,取脑海马组织置于预冷PBS(pH 7.4)中漂洗,滤纸拭干,称重后置于匀浆器中,加预冷的PBS制成10%匀浆液,4 ℃、10 000×g离心10 min后取上清,待检。取脑海马组织匀浆上清液,按照ELISA试剂盒说明,测定CaM、CaMKII、PKC、Cyt C及caspase-3水平。
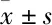
2 结果
2.1 Nim改善DBP对小鼠学习记忆的影响与对照组比较,50 mg·kg-1DBP组小鼠的潜伏期明显上升(P<0.05);与50 mg·kg-1DBP组比较,DBP+Nim组小鼠的潜伏期有一定程度下降。小鼠60 s内寻找逃逸平台的游泳轨迹热点见Fig 1,DBP组小鼠的轨迹较少出现在目标象限,游泳路径没有目的性,且无规律;而DBP+Nim组小鼠在目标象限的轨迹有所增加。
2.2 Nim降低DBP暴露后小鼠脑海马的Ca2+水平各组小鼠脑海马组织的CaM、CaMKII及PKC水平可反映胞内Ca2+水平。Tab 1结果显示,与对照组比较,DBP组小鼠脑海马CaM、CaMKII水平下降,PKC水平上升,差异均有统计学意义(P<0.01)。与DBP组比较,DBP+Nim组小鼠脑海马组织中CaM、CaMKII水平明显上升(P<0.01,P<0.05),PKC水平明显下降(P<0.05)。
Fig 1 Heatmap and latency of Morris water maze test of mice in different treatment groups
A: Control group; B: 50 mg·kg-1DBP group; C: 2 mg·kg-1Nim group; D: DBP+Nim group; E: Latency of Morris water maze test.
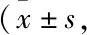
Tab 1 Levels of CaM, CaMKII and PKC in hippocampus of KM mice in different treatment groups n=9)
**P<0.01vscontrol;#P<0.05vsDBP
2.3 Nim降低DBP暴露后小鼠脑海马p-ERK1/2的表达ERK未活化时分布在细胞质内,活化形式磷酸化ERK1/2 (p-ERK1/2)转位到核内,p-ERK1/2是ERK通路活化的主要标志。如Fig 2所示,各组小鼠脑海马ERK表达未见明显变化;与对照组比较,DBP组小鼠脑海马p-ERK表达水平明显上调(P<0.01);与DBP组比较,DBP+Nim组小鼠脑海马p-ERK1/2表达量下降 (P<0.05)。
2.4 Nim减轻DBP暴露后小鼠脑海马CA1神经细胞的损伤脑系数的结果见Tab 2,与对照组比较,DBP组小鼠脑系数明显降低(P<0.05),经Nim处理后,DBP+Nim组小鼠脑系数有一定程度增加。Fig 3的HE染色结果显示,对照组小鼠脑海马CA1区的锥体神经细胞形态保持完好,呈多角形且排列整齐,边缘清晰;DBP组小鼠脑海马出现了损伤特征,锥体细胞肿胀变形,顶状树突变短或消失;经Nim处理后,DBP+Nim组小鼠脑海马锥体细胞虽仍表现出一定程度的损伤,但组织病理学的改变如肿胀变形、顶状树突变短或消失等损伤细胞的数量明显减少。Nissl染色结果显示,与对照组比较,DBP组小鼠脑海马神经细胞内Nissl小体大量缺失,细胞结构受到一定程度的破坏;经Nim处理后,DBP+Nim组Nissl小体缺失的现象在给予Nim保护后有所缓解。
Fig 2 ERK and p-ERK1/2 expression levels in hippocampus of KM mice in different treatment groups by Western blot n=3)
*P<0.05,**P<0.01vscontrol;#P<0.05vsDBP
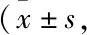
Tab 2 Brain coefficient of KM mice in different treatment groups n=9)
*P<0.05vscontrol
2.5 Nim拮抗DBP所致小鼠脑海马CA1神经细胞的凋亡由Tab 3可知,与对照组比较,DBP组小鼠脑海马Cyt C、caspase-3水平明显上升(P<0.01);经Nim处理后,与DBP组比较,DBP+Nim组小鼠脑海马Cyt C、caspase-3水平明显下降(P<0.05)。Fig 4的Hoechst 33258染色结果显示,DBP组小鼠脑海马细胞核或细胞质内可见浓染致密的颗粒块状荧光,数量明显多于对照组,且荧光强度有明显性增加;经Nim处理后,DBP+Nim组小鼠脑海马CA1区荧光强度有所减弱。Fig 5的TUNEL染色结果显示,DBP组小鼠脑海马CA1区带有TUNEL荧光标记的神经元,其数量明显多于对照组;经Nim处理后,与DBP组比较,DBP+Nim组小鼠脑海马CA1区凋亡细胞数量有一定程度减少,凋亡水平明显降低。
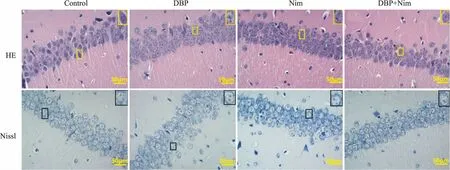
Fig 3 Hippocampal CA1 of KM mice in different treatment groups by HE and Nissl staining (×400)
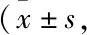
Tab 3 Levels of Cyt C and caspase-3 in hippocampus of KM mice in different treatment groups n=9)
**P<0.01vscontrol;#P<0.05vsDBP
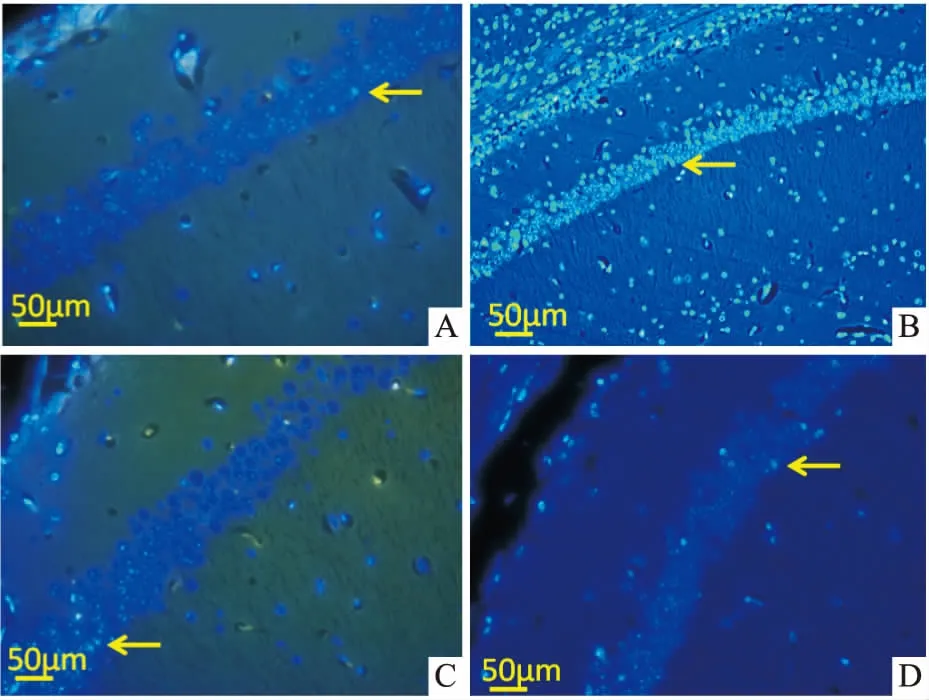
Fig 4 Hippocampal CA1 of KM mice in different treatment groups by Hoechst 33258 fluorescence staining (×200)
A: Control group; B: 50 mg·kg-1DBP group; C: 2 mg·kg-1Nim group; D: DBP+Nim group. Yellow arrow: dense granular and massive fluorescence was seen in the nucleus or cytoplasm.
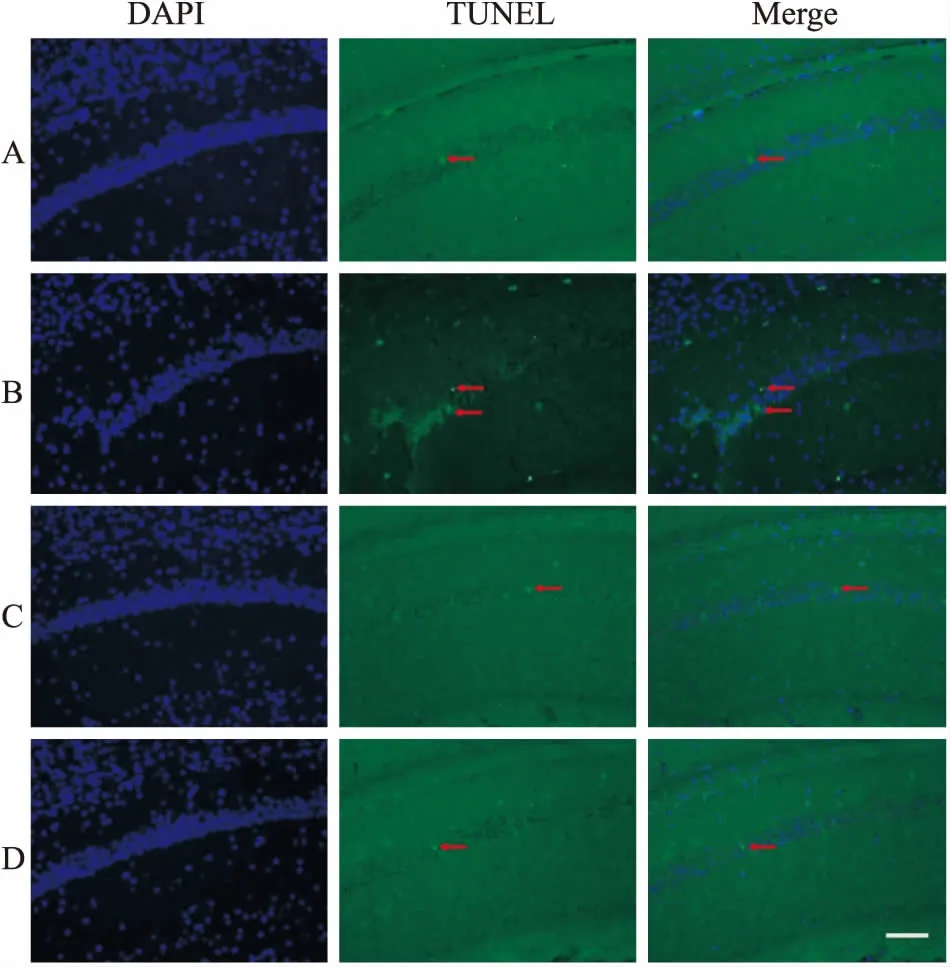
Fig 5 Hippocampal CA1 of KM mice in different treatment groups by TUNEL staining (scale bar=50 μm)
A: Control group; B: 50 mg·kg-1DBP group; C: 2 mg·kg-1Nim group; D: DBP+Nim group. Red arrow: apoptotic cells with TUNEL-labeled (green).
3 讨论
细胞凋亡在神经元发育过程中起重要作用,凋亡缺陷可能是各种神经退行性疾病的基础。大脑是接受外源刺激的一个重要靶器官,而海马是学习和记忆的关键功能区,海马神经元的损伤、凋亡以及信号通路的激活等,在导致LD过程中起重要作用[10]。既往研究表明[6],细胞内钙离子浓度的升高是细胞发生凋亡的一个重要条件。另有研究报道[7],Nim是一种L型钙通道拮抗剂,能减少病理状态下过度的Ca2+,可明显减轻受试动物的空间学习记忆障碍,抑制海马CA1区神经元的丢失。本实验结果表明,DBP可增加Ca2+浓度,激活PKC-ERK1/2通路,导致KM小鼠脑海马组织CA1区神经元细胞发生凋亡,而Nim作为Ca2+拮抗剂可减少Ca2+浓度,从而抑制ERK1/2通路的活化,降低DBP对KM小鼠脑组织CA1区神经元的损伤及凋亡,具有一定的神经保护作用。
体内外研究均显示[11],胞内Ca2+浓度与细胞凋亡密切相关。CaM是细胞内一种钙结合蛋白,能敏感地捕获Ca2+,每4个Ca2+可被一分子CaM结合;当胞内游离的Ca2+浓度增加,无活性的CaM结合Ca2+而被活化,激活相关靶蛋白,从而参与介导细胞凋亡、细胞短期和长期记忆等生命活动。CaMKII广泛分布在神经组织中,在海马内约占蛋白总量的1%~2%,它的主要作用是能感受突触后钙离子水平的变化,维持突触可塑性和发挥学习记忆功能。PKC是G蛋白偶联受体系统中的效应物,在未受刺激的细胞中,PKC主要分布在细胞质中,呈非活性构象;一旦有第二信使如Ca2+的存在,PKC将成为膜结合的酶,一方面它能激活细胞质中的酶如ERK1/2,参与生化反应的调控,同时也能作用于细胞核中的转录因子,参与基因表达的调控,在细胞的转录激活等方面具有重要作用。本研究结果显示,50 mg·kg-1DBP组小鼠脑组织CaM、CaMKII含量明显降低,同时PKC水平增加,提示DBP可致细胞内Ca2+浓度增加,这与蒋昀等[12]报道一致。
ERK1/2通路活化与中枢神经系统的海马组织神经细胞的凋亡有重要关联[13]。Zhai等[13]指出,ERK1/2参与海马突触可塑性的形成,在学习记忆过程中起重要作用。另一方面,ERK1/2通路可被细胞内钙离子信号所激活,直接参与内源性细胞凋亡过程。本实验结果表明,50 mg·kg-1DBP组小鼠脑海马组织p-ERK1/2蛋白表达水平明显高于对照组,提示DBP可激活ERK1/2通路。
研究证实[14],Cyt C释放是早期凋亡发生的重要事件,caspase-3是介导细胞凋亡过程中的关键执行分子,两者水平可反映早期细胞凋亡程度。本实验结果表明,50 mg·kg-1DBP组小鼠脑海马组织Cyt C、caspase-3含量明显高于对照组;HE与Nissl染色结果也显示,50 mg·kg-1DBP组小鼠脑海马组织CA1区锥体神经元出现了损伤,伴有Nissl小体缺失。根据Hoechst 33258以及TUNEL荧光结果进一步显示,DBP暴露后,小鼠脑海马组织CA1区的细胞凋亡水平明显升高。以上结果提示,DBP暴露可激活caspase-3细胞凋亡途径,导致小鼠脑组织神经细胞的损伤及凋亡。
脑海马CA1区的病理学改变与小鼠神经行为学的变化密切相关,MWM实验主要用于测试实验动物对空间位置感和方向感(空间定位)的学习记忆能力。本实验MWM的结果表明,50 mg·kg-1DBP组小鼠的逃逸潜伏期明显高于对照组,出现在目标象限的游泳轨迹较少,而经Nim处理后,DBP+Nim组小鼠的学习记忆能力有一定程度改善。其他动物实验表明,Nim可通过抑制胞内Ca2+浓度的增加,下调全脑放疗后细胞凋亡,减轻迟发性认知功能障碍,对记忆障碍有改善作用[15]。本实验结果提示,Nim可能在一定程度上拮抗DBP引起的胞内Ca2+浓度的增加,缓解DBP诱导的脑海马CA1区神经细胞损伤,从而发挥神经保护作用。
综上所述,DBP暴露可影响小鼠脑海马神经细胞内Ca2+相关蛋白,上调p-ERK1/2表达,诱发或加重小鼠的学习记忆障碍。Nim作为一种选择型钙拮抗剂,能改善DBP所致小鼠的学习记忆下降,或与其可拮抗胞内Ca2+浓度增加,降低DBP暴露后小鼠脑组织p-ERK1/2、caspase-3水平有关。
(致谢:本实验动物给药操作在湖北科技学院基础医学院完成,感谢暨南大学中医学院陈刚教授的指导。)
