黄瓜叶片可产生胞质脂滴
2019-07-03张超越孙悦宸李萌薛梦伟刘淑美吴成红王守箐刘林
张超越 孙悦宸 李萌 薛梦伟 刘淑美 吴成红 王守箐 刘林

摘 要: 胞质脂滴通常在生殖器官中产生,用透射电子显微技术研究黄瓜叶片能否产生胞质脂滴,哪种类型的细胞能产生脂滴,以为黄瓜叶片脂滴的开发研究提供参考。结果表明,幼叶、成熟叶和衰老叶都含有胞质脂滴,即黄瓜叶片发育各阶段均能产生胞质脂滴。幼叶中,表皮细胞、叶肉细胞和维管组织细胞都含有少量胞质脂滴;成熟叶中,以叶肉细胞中胞质脂滴较多;老叶中,叶肉细胞、维管薄壁细胞和伴胞都产生胞质脂滴,以伴胞中最多。老叶叶肉细胞中胞质脂滴向液泡内转移,显示胞质脂滴通过细胞自噬途径降解。
关键词: 黄瓜; 叶片; 胞质脂滴
Cucumber leaf blades produce cytosolic lipids
ZHANG Chaoyue, SUN Yuechen, LI Meng, XUE Mengwei, LIU Shumei, WU Chenghong, WANG Shouqing, LIU Lin
(College of Pharmacy, Linyi University, Linyi 276005, Shandong, China)
Abstract: It is well known that cytosolic lipid droplets are produced in reproductive organs or tissues. Leaf blades of cucumber were examined by means of transmission electron microscopy, with the aim to understand whether there is occurrence of cytosolic lipid droplets, and what types of cells produce cytosolic lipid droplets. There were cytosolic lipid droplets in young,mature,and aged leaves,suggesting that cucumber leaf blades could produce cytosolic lipid droplets during all developmental stages. Cytosolic lipid droplets in young leaf blades occurred in epidermal cells,mesophyll cells,and vascular parenchyma cells. Cytosolic lipid droplets in mature leaves were present mainly in mesophyll cells. Cytosolic lipid droplets in aged leaves occurred in mesophyll cells,vascular parenchyma cells,and companion cells. Cytosolic lipid droplets in aging leaves moved to the vacuole,suggesting they underwent degradation through autophagy pathway.
Key words:Cucumber; Leaf; Cytosolic lipid droplet
脂滴是由磷脂单分子层膜包围而成的囊泡状细胞器,囊泡内积累甘油酯和其他脂溶性分子,如类胡萝卜素和维生素E,囊泡表面结合有多种蛋白质[1-3]。所有植物都能产生脂滴,是食用油和工业用油的重要来源,也是再生能源,与人类生活关系极为密切,因此受到广泛重视。植物脂滴分两类,细胞质中的脂滴为胞质脂滴,叶绿体内的脂滴为质体小球[4]。叶绿体内,中性脂和其他脂溶性化合物在类囊体膜两小叶之间积累,形成小球体,小球体脱离类囊体进入基质成为质体小球[5]。叶绿体外膜局部区域两小叶之间积累中性脂,形成小球体,小球体脱离外膜进入细胞质而成为胞质脂滴[6]。内质网局部区域两小叶之间积累中性脂,形成小球体,小球体脱离内质网进入细胞质而成为胞质脂滴[7]。胞质脂滴是生物膜脂成分前体及细胞代谢能源的贮藏库[4],还参与植物发育、激素代谢、胁迫响应、信号转导等多种生物学过程[2-4]。目前已鉴定出多种脂滴相关蛋白[8],这些蛋白的鉴定促进了对脂滴发生和功能的认识[1-3],但对胞质脂滴发生的普遍性及细胞特异性还鲜有报道[8],这些方面的信息不仅是胞质脂滴生物学功能研究的基础,也为脂滴商业开发提供参考。植物果实、种子等生殖器官可以积累大量胞质脂滴,成为食用油和工业用油的來源,而对营养器官产生胞质脂滴的研究还非常有限,例如,目前仅发现少数种类植物叶片内产生胞质脂滴[9-11]。在这些植物叶片中,胞质脂滴发生的细胞特异性很强,例如,Lersten等[9]在71种植物叶片中观察到胞质脂滴,都出现在叶肉细胞内;Kwiatkowska等[12-13]以及Huang等[14]观察到天门冬目植物叶片产生胞质脂滴,都出现在表皮细胞内,不过至今还没有维管束细胞产生胞质脂滴的报道。上述胞质脂滴发生的细胞特异性与一种基于脂滴相关蛋白鉴定结果的推测相矛盾,这一推测认为植物任何细胞都有合成胞质脂滴的装置[11]。此外,叶片发育可分为幼期、成熟期和衰老期等3个阶段,关于胞质脂滴产生的时期和阶段也还鲜有报道。
黄瓜是常见瓜类作物,茎和叶尚没有商业用途。考虑到叶片脂滴具有潜在的开发价值,针对能否产生胞质脂滴、脂滴发生有无细胞特异性以及脂滴发生与叶片发育有无相关性,对黄瓜不同发育阶段的叶片进行了透射电子显微观察,为进一步研究脂滴发生与黄瓜生理、产量和品质的关系奠定基础。
1 材料与方法
1.1 材料
供试黄瓜为‘锦丰2号,由临沂市种子公司提供,2017年3月育苗, 4月移栽到临沂大学教学科研基地,常规栽培和管理,7月取样,间隔5 d取样1次,共取3次。每次于晴天11:00从长势良好植株选择刚开始扩展的幼叶2片、充分伸展的成熟叶2片、暗绿色衰老叶2片(叶绿素下降到成熟叶的70%左右,分光光度法测定),从每叶片剪下0.5 cm×1.0 cm大小2片,立即浸入2%戊二醛固定液(0.05 mol·L-1磷酸缓冲液配制,pH 6.8),同一发育阶段的4小片置于同一容器。后续工作在临沂大学药用植物学实验室完成。
1.2 透射电子显微技术
每次取样后尽快将样品带回实验室,在实验室内进一步切成小于1 mm×1 mm的小片。在2% 戊二醛溶液中固定4 h后,再用1%四氧化锇溶液(0.05 mol·L-1磷酸缓冲液配制,pH 6.8)固定4 h。固定完成后,用梯度酒精脱水,包埋于Embed-812树脂中,制成包埋块。将各次各发育阶段样品包埋块用钻石刀切片,厚度60 nm。切片用醋酸铀和柠檬酸铅电子染色,Jeol 1220透射电子显微镜下观察。
2 结果与分析
2.1 幼叶中的胞质脂滴
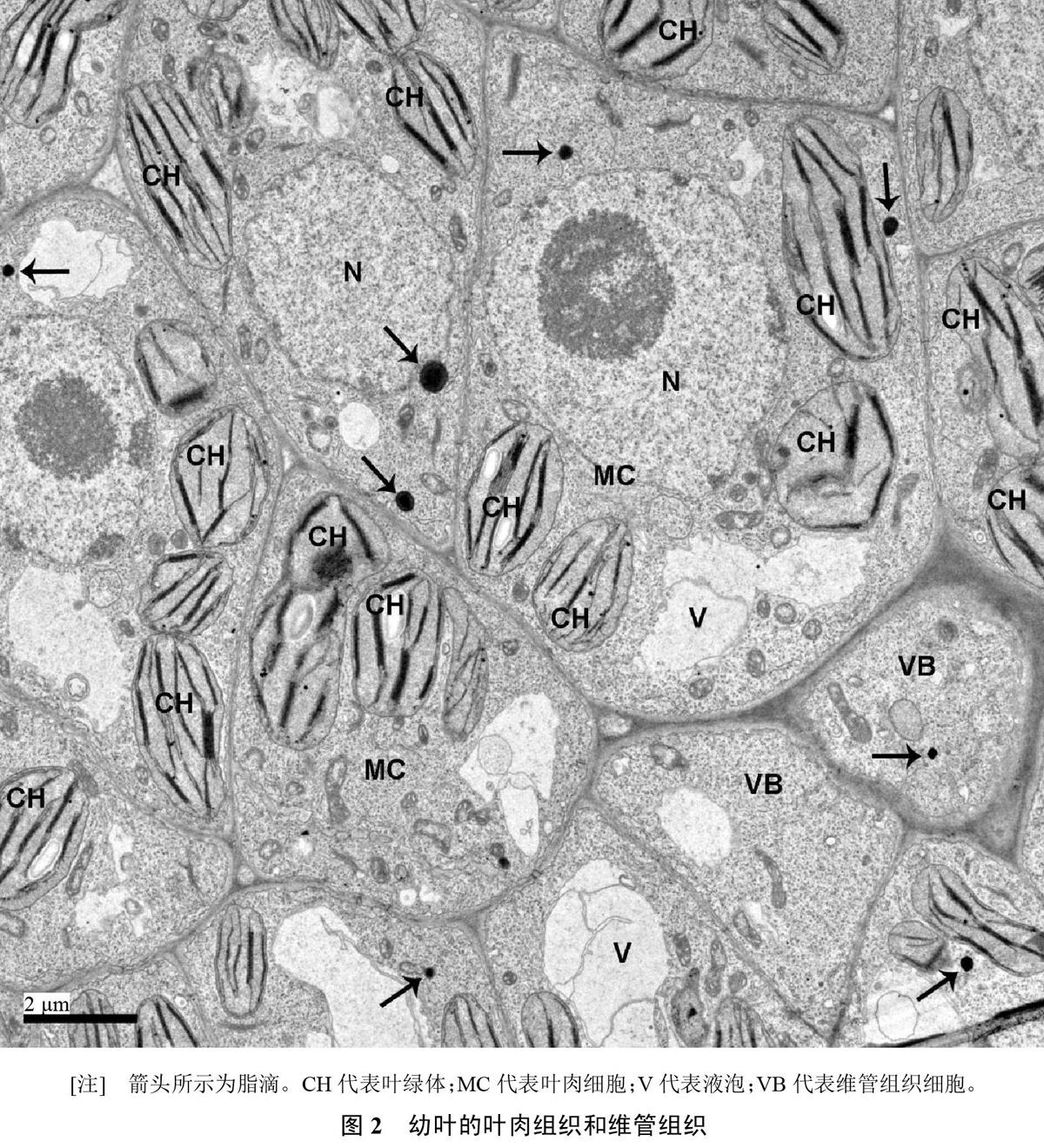
幼叶表皮细胞含有大液泡,液泡约占细胞体积的一半,细胞核较大,叶绿体较小,类囊体较少。细胞质中有胞质脂滴,每一细胞切片上可观察到1~2个胞质脂滴,直径0.2~0.4 ?m(图1)。叶肉细胞的液泡尚小,细胞质浓,细胞核较大,叶绿体较少且体积小,类囊体和基粒都较少,积累少量淀粉,但淀粉粒很小。含有胞质脂滴,每细胞切片上可见1~2个,但叶肉组织切片上只有部分细胞可见胞质脂滴,直径0.2~0.4 ?m(图2)。维管组织正在分化,尚没有成熟的木质部和韧皮部。维管组织细胞中可见胞质脂滴,但数量不多,直径约0.3 ?m(图2)。综合上述观察,幼叶产生胞质脂滴,脂滴发生在表皮细胞、叶肉细胞和维管组织细胞中,每细胞切片上可见1~2个,且叶片横切面上仅部分细胞可见胞质脂滴,因此胞质脂滴数量不多。
2.2 成熟叶片中的胞质脂滴
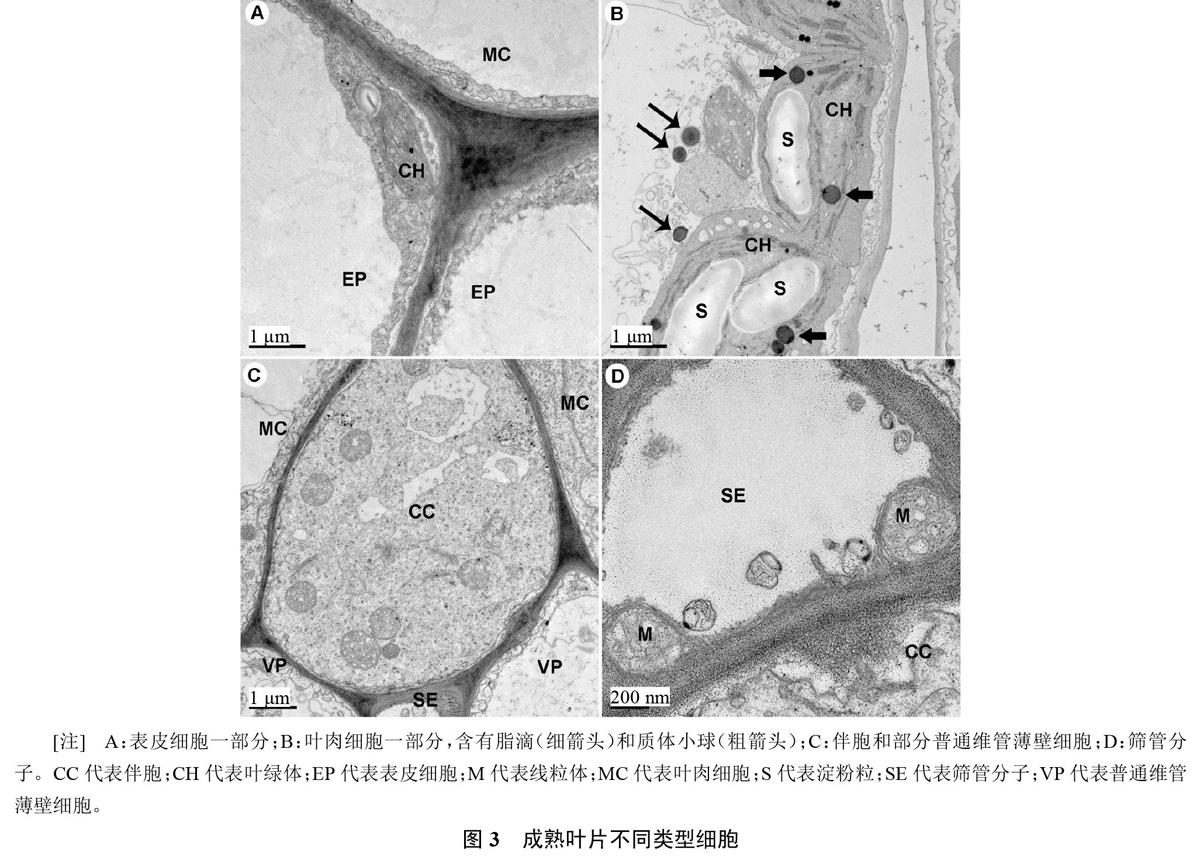
成熟叶片表皮细胞和叶肉细胞高度液泡化,液泡占据细胞绝大部分体积。表皮细胞的细胞质呈一薄层,厚0.3~1.0 ?m(图3-A),胞质脂滴极少观察到。但叶肉细胞所含胞质脂滴较多,形态与质体小球类似,直径约0.5 ?m。胞质脂滴与线粒体、过氧化物酶体和叶绿体非常接近(图3-B)。维管薄壁细胞包括细胞质很浓的伴胞、高度液泡化的普通薄壁细胞(图3-C)以及高度特化的筛管分子(图3-D),这些细胞都基本不含胞质脂滴。显然,成熟叶片以叶肉细胞所含胞质脂滴较多。
2.3 老叶中的胞质脂滴
衰老叶表皮细胞的细胞质更少,细胞质贴着细胞壁,仅约0.2 ?m厚,为叶绿体厚度的1/5(图4-A),极少观察到胞质脂滴。叶肉细胞含有较多胞质脂滴,直径0.1~1.2 ?m,向液泡内运动,进入液泡内部(图4-B,图5)。此外,叶绿体中的质体小球有向外转移的趋势(图4-C、D),转移到叶绿体外成为胞质脂滴。维管组织中的胞质脂滴明显增多(图5),特别是伴胞中,伴胞切片可见较多胞质脂滴,直径约0.5 ?m。普通维管薄壁细胞和筛管分子中都出现了胞质脂滴。
3 讨论与结论
3.1 黄瓜叶发育各阶段均产生胞质脂滴,但不大量积累
本研究结果表明,黄瓜叶片能够产生胞质脂滴,且不管是幼叶、成熟叶还是老叶,各发育阶段均能产生,显然胞质脂滴发生对叶片发育阶段没有依赖性。
植物叶片胞质脂滴的发生可能有多方面生物学意义,作为生物膜脂成分前体及细胞代谢能的贮藏场所[4],参与发育、代谢、胁迫响应、信号转导等生物学过程[2]。研究表明,叶片遭受温度或干旱胁迫时会产生胞质脂滴[10,15],受到病原微生物侵染时也会产生胞质脂滴[16]。另一种观点认为,叶片发育过程中遇到胁迫时,细胞内膜系统受到损伤而产生脂肪酸,脂肪酸游离在细胞内对细胞有毒性,因此,如果游离脂肪酸在细胞内积累,势必对蛋白质分子造成伤害,从而影响各种生理生化活动的正常进行,而当这些有毒的脂肪酸分子转化为中性脂储存在脂滴中,就产生了解毒效果,达到了保护细胞的目的[8]。黄瓜叶片在正常生长条件下也会产生胞质脂滴,脂滴的产生可能是黄瓜的遗传特征。根据上述讨论,黄瓜叶片胞质脂滴发生很可能参与叶片的发育、代谢和胁迫响应,但其抗病作用及其他生理功能尚需进一步研究。
黄瓜幼叶的各种类型细胞中均容易观察到胞质脂滴,成熟叶片的叶肉细胞中容易观察到脂滴,老叶除表皮细胞外,其他类型细胞均有较多脂滴,特别是维管组织细胞中明显较多,显然,各种类型细胞中的脂滴发生量与叶片发育阶段有一定的关系,叶片衰老可能诱导维管组织中的胞质脂滴增多。虽然老叶中胞质脂滴增多,但脂滴并没有大量积累,这与存在脂滴降解途径有关。老叶叶肉细胞中,胞质脂滴进入液泡,这是细胞自噬,脂滴在液泡中被降解。由于脂滴通过细胞自噬途径降解,因而胞质脂滴不会大量积累。脂滴通過自噬途径降解的现象在西瓜叶片中也有发生[17]。脂滴通过自噬途径降解的现象可能也发生在黄瓜叶片的其他类型细胞中,致使所有细胞都不积累大量胞质脂滴。叶片内,脂滴通过自噬途径的降解,降解产物最终转化成可通过韧皮部运输的小分子蔗糖[18],蔗糖转移到生长旺盛的部位如果实和生长点,为果实生长和新器官产生提供营养,显然胞质脂滴的产生和降解对黄瓜产量和品质会有积极影响,不过这种相关性还需要进一步研究。
黄瓜叶片每细胞切片含有1至数个胞质脂滴,显然黄瓜叶片中的胞质脂滴积累水平不高。植物叶片胞质脂滴的积累水平可通过基因工程手段提高,有研究表明,细胞中的胞质脂滴积累与脂肪酸浓度之间存在动态平衡,若提高脂肪酸浓度,就可以增加脂滴的积累[8]。例如,Yurchenko等[19]通过基因工程手段提高拟南芥叶中的脂肪酸合成能力,提高脂肪浓度,胞质脂滴数量明显增多;Slocombe等[20]通过基因工程技术抑制脂肪酸降解途径,细胞中的脂肪水平提高,结果胞质脂滴数量增加10倍之多。因此,要想提高黄瓜叶中的脂滴积累水平,从理论上有可行性。
3.2 黃瓜叶片不同类型的细胞都能产生胞质脂滴
黄瓜叶胞质脂滴出现在表皮细胞、叶肉细胞和维管薄壁细胞中,表明各种类型的细胞均能产生胞质脂滴,这与过去在其他植物中的观察结果不同。Lersten 等[9]在71种植物叶中观察到胞质脂滴,都无一例外地出现在叶肉细胞中;而Kwiatkowska等[12-13]和Huang等[14]在天门冬目植物中发现,叶片中的胞质脂滴均出现在表皮细胞中。黄瓜叶片胞质脂滴发生在表皮、叶肉和维管组织中,显然黄瓜叶片产生胞质脂滴的细胞类型较多,即胞质脂滴发生没有明显的细胞特异性。根据对胞质脂滴相关蛋白的研究,Pyc等[11]提出,植物任何细胞都有合成胞质脂滴的装置,黄瓜叶片胞质脂滴发生的普遍性与之一致,即黄瓜叶片各种类型细胞都具有产生胞质脂滴的能力。
参考文献
[1] THIAM A R,JR R V F,WALTHER T C.The biophysics and cell biology of lipid droplets[J].Nature Reviews Molecular Cell Biology,2013,14(12):775-786.
[2] THIAM A R,BELLER M.The why,when and how of lipid droplet diversity[J].Journal of Cell Science,2017,130(2):315-324.
[3] OHSAKI Y,SUZUKI M,FUJIMOTO T.Open questions in lipid droplet biology[J].Chemistry & Biology,2014,21(1):86-96.
[4] MURPHY D J.The dynamic roles of intracellular lipid droplets: from archaea to mammals[J].Protoplasma,2012,249(3):541-585.
[5] ROTTET S,BESAGNI C,KESSLER F.The role of plastoglobules in thylakoid lipid remodeling during plant development[J].Biochimica et Biophysica Acta,2015,1847(9):889-899.
[6] ZIENKIEWICZ K,DU Z Y,MA W,et al.Stress-induced neutral lipid biosynthesis in microalgae molecular, cellular and physiological insights[J].Biochimica et Biophysica Acta,2016,1861(9):1269-1281.
[7] HERMAN E.Endoplasmic reticulum bodies:solving the insoluble[J].Current Opinion in Plant Biology,2008,11(6):672-679.
[8] HUANG A H C.Plant lipid droplets and their associated proteins:potential for rapid advances[J].Plant Physiology,2018,176(3):1894-1918.
[9] LERSTEN N R,CZLAPINSKI A R,CURTIS J D,et al.Oil bodies in leaf mesophyll cells of angiosperms: overview and a selected survey[J].American Journal of Botany,2006,93(12):1731-1739.
[10] GIDDA S K,PARK S,PYC M,et al.Lipid droplet-associated proteins (LDAPs) are required for the dynamic regulation of neutral lipid compartmentation in plant cells[J].Plant Physiology,2016,170(4): 2052-2071.
[11] PYC M,CAI Y,GREER M S,et al.Turning over a new leaf in lipid droplet biology[J].Trends in Plant Science,2017,22(7):596-609.
[12] KWIATKOWSKA M,POLIT J T,STEPINSKI D,et al.Lipotubuloids in ovary epidermis of Ornithogalum umbellatum act as metabolons:suggestion of the name‘lipotubuloid metabolon[J].Journal of Experimental Botany,2015,66(5):1157-1163.
[13] KWIATKOWSKA M,STEPINSKI D,POPLONSKA K,et al.Elaioplasts of Haemanthus albiflos are true lipotubuloids: cytoplasmic domains rich in lipid bodies entwined by microtubules[J]. Acta Physiologiae Plantarum,2010,32(6):1189-1196.
[14] HUANG M D,HUANG A H C.Subcellular lipid droplets in vanilla leaf epidermis and avocado mesocarp are coated with oleosins of existing and novel phylogenic lineages[J].Plant Physiology,2016,171(3):1867-1878.
[15] KIM E Y,PARK K Y,SEO Y S,et al.Arabidopsis small rubber particle protein homolog SRPs play dual roles as positive factors for tissue growth and development and in drought stress responses[J].Plant Physiology,2016,170(4):2494-2510.
[16] SHIMADA T L,HARA-NISHIMURA I.Leaf oil bodies are subcellular factories producing antifungal oxylipins[J].Current Opinion in Plant Biology,2015,25:145-150.
[17] LIU L.Ultramicroscopy reveals that senescence induces in-situ and vacuolar degradation of plastoglobules in aging watermelon leaves[J].Micron,2016,80:135-144.
[18] PHILLIPS A R,SUTTANGKAKUL A,VIERSTRA R D.The ATG12-conjugating enzyme ATG10 is essential for autophagic vesicle formation in Arabidopsis thaliana[J].Genetics,2008,178(3):1339-1353.
[19] YURCHENKO O,SHOCKEY J M,GIDDA S K,et al.Engineering the production of conjugated fatty acids in Arabidopsis thaliana leaves[J].Plant Biotechnology Journal,2017,15(8):1010-1023.
[20] SLOCOMBE S P,CORNAH J,PINFIELD-WELLS H,et al.Oil accumulation in leaves directed by modification of fatty acid breakdown and lipid synthesis pathways[J].Plant Biotechnology Journal,2009,7(7):694-703.
