法舒地尔保护小鼠脑缺血再灌流损伤的机制*
2019-07-03杨锡彤程建杰徐弘扬王光明
杨锡彤, 程建杰, 徐弘扬, 王光明
大理大学第一附属医院基因检测中心(云南大理 671000)
脑卒中(stroke)是一种突发的脑血液循环障碍性疾病,包括缺血性和出血性脑卒中两种类型[1]。缺血性脑卒中约占脑卒中的85%以上,已出现年轻化的趋势,并成为第一位致残和致死原因[2]。在脑缺血过程中,缺血区神经组织由于血管堵塞引起的营养缺乏导致神经组织坏死,改善缺血区的侧支循环可以改善营养供应,从而保护或者减轻神经组织的缺血损伤,血脑屏障可通过限制某些物质在血液和脑组织之间自由交换,从而使脑组织少受甚至不受循环血液中有害物质的损害,对维护中枢神经系统内环境的稳定具有重要意义[3-4]。有研究表明法舒地尔(Fasudil)通过抑制Rho激酶的活性,延长了治疗时间窗,在治疗迟发性神经元死亡有较好的疗效[5]。法舒地尔的神经保护作用研究主要在细胞水平进行,也有部分在动物水平,但是法舒地尔保护神经的机制并不清楚,而本研究利用小鼠大脑中动脉闭塞(MCAO)模型,结果提示在脑缺血状态下法舒地尔与过氧化物酶体激活受体α(PPARα)、超氧化物歧化酶(SODs)以及血管生成之间的关系,明确法舒地尔在脑缺血中神经保护作用的机制。因此,在2017年9月至2018年4月,本研究通过经法舒地尔预处理的小鼠构建脑缺血/再灌流(I/R)动物模型,以阐明法舒地尔在小鼠脑缺血损伤的神经保护机制。
1 材料与方法
1.1 实验动物 25只SPF级雄性C57BL/6J小鼠,购自湖南斯莱克景达实验动物有限公司(湖南,长沙),小鼠年龄6~8周,体重20~25 g。动物的使用经大理大学医学伦理委员会批准,其操作过程符合相关的动物实验指南。小鼠购买后,在大理大学实验动物中心饲养1周后用于实验,小鼠以标准食物颗粒和自来水喂养,室内温度在20~25℃。
1.2 主要试剂 TTC,CMC,法舒地尔购自Sigma公司(St. Louis, MO);引物合成,总RNA提取试剂盒和cDNA合成试剂盒由Invitrogen公司(Carlsbad, CA)提供;蛋白质提取试剂盒购自Thermo Scientific公司(Waltham, MA);实时荧光定量PCR试剂盒和蛋白质浓度测定试剂盒购自Bio-Rad公司(Richmond, CA);SODs酶活性检测试剂盒购自美国Wako 化学公司(Richmond, VA);其余试剂未作特殊说明均来自Sigma公司。
1.3 动物分组及药物处理 小鼠随机从1~25进行编号,单号为对照组(CMC组),双号为治疗组(法舒地尔)。药物处理:CMC组用10 mL 0.5%的CMC混悬液/kg体重处理(13只),法舒地尔组用10 mg/kg体重的法舒地尔处理(12只)。小鼠药物处理后,按照编号顺序取CMC组6只和法舒地尔组5只进行I/R模型制备以检测脑坏死体积;其余小鼠经法舒地尔或者CMC处理后直接用于下列检测:PPARα的表达(CMC和法舒地尔各4只);SODs酶活性(CMC组和法舒地尔组各7只);SOD1、SOD2、SOD3 mRNA检测(CMC组和法舒地尔组各5只)。
法舒地尔与0.5%的CMC混合制成混悬液,用小鼠专用灌胃针灌胃给药。CMC和法舒地尔均在每天8:00~8:30 am给药1次,连续3 d;最后一次给药后1 h内进行手术或者取脑组织进行相关检测。
1.4 小鼠大脑中动脉I/R模型制备[6]手术过程用1.5%异氟醚气体麻醉,用加热垫维持小鼠直肠温度在(37±1)℃,手术显微镜(蔡司,德国)下分离右侧颈总动脉和颈外动脉并进行结扎,将长度为11 mm、硅胶包被的8.0尼龙线经颈总动脉插入颈内动脉,当脑血流值低于原始值的20%时开始计时。60 min后撤出尼龙线,进行再灌流。手术期间用BD公司的脑血流监测仪全程监测左耳耳缘后缺血区颅骨表面的脑血流。再灌流30 min后用Laser Speckle图像系统采集脑血流图像。再灌流18 h后处死动物,用于脑坏死体积分析。
1.5 坏死体积测定 用过量的异氟醚处死小鼠,断头后,剥离脑骨及脑膜等,脑组织用刀片切为厚度为2 mm的5片脑片,在室温下用2%的TTC染色30 min,中间翻转1次,脑片经扫描后用MCID图像分析软件进行脑坏死体积的分析。
1.6 SOD1、SOD2、SOD3 mRNA测定 应用实时荧光定量PCR法测定脑内SOD1、SOD2、SOD3的表达水平。小鼠最后一次药物处理后60 min内处死小鼠,剥离脑组织,冷生理盐水冲洗,按照Trizol说明书提取脑组织中总RNA,用逆转录试剂盒合成cDNA,iQ SYBR Green试剂盒进行PCR扩增,扩增所用引物见表1。循环条件如下:起始变性95℃10 min,循环95℃10 s,55℃退火10 s,72℃延伸15 s,循环30次。应用2ΔΔCT法处理数据,以CMC处理组的值为1并作为对照,法舒地尔组与之相比得出倍数变化,反映脑内SOD1、SOD2、SOD3基因的表达水平。

表1 实时荧光定量PCR分析用引物
1.7 SODs酶活性检测 小鼠最后一次药物处理后,取部分脑组织,用预冷的50 mmol/L Tris-HCl(pH=7.0)进行组织匀浆,离心取上清。按照SODs试剂盒说明测定脑组织中SODs活性。
1.8 免疫印迹检测PPARα的表达 小鼠最后一次药物处理后,取部分脑组织,用蛋白质提取试剂盒提取总蛋白,蛋白浓度用Bio-Rad公司的蛋白质浓度测定试剂盒进行检测,以15 μg/5 μL的蛋白量进行SDS-PAGE(分离胶浓度8%),用Bio-Rad公司半干转移系统转到PVDF膜上,用兔抗小鼠的PPARα多克隆抗体(Cayman, Ann Arbor, MI)和山羊抗小鼠的β-actin单克隆抗体(Sigma-Aldrich, St. Louis, MO)孵育,然后用抗兔和山羊的IgG(分别为IRDye 800CW和IRDye 680CW标记)孵育,洗涤后用Bio-Rad公司的蛋白印迹检测系统扫描,所获得的图像用Image J(pubmed)进行分析,PPARα和β-actin灰度值的比值代表了PPARα表达的相对值。
2 结果
2.1 小鼠大脑中动脉缺血再灌注损伤的减轻 将小鼠的脑组织切片,可见脑冠状切片左侧组织出现明显的白色梗死灶(图1-A),法舒地尔处理组小鼠其白色梗死灶明显减小[(100.78±3.36)mm3、(47.36±2.29)mm3],脑梗死体积差异有统计学意义(P=0.000)。而两组动物在灌流前后体温、脑血流方面没有改变(P>0.05),见表2。在脑坏死区域,法舒地尔处理组的小鼠其脑血流好于CMC处理组(图1-B)。

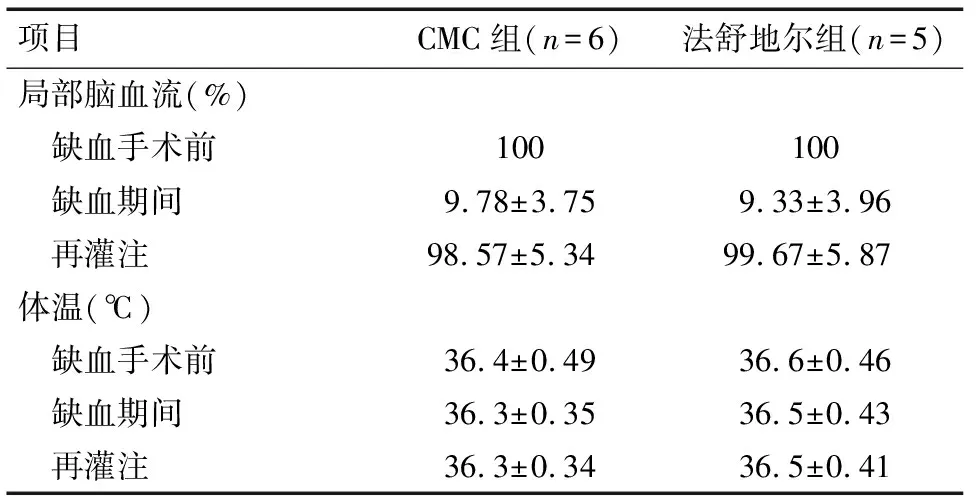
项目CMC组(n=6)法舒地尔组(n=5)局部脑血流(%) 缺血手术前100100 缺血期间9.78±3.759.33±3.96 再灌注98.57±5.34 99.67±5.87 体温(℃) 缺血手术前36.4±0.4936.6±0.46 缺血期间36.3±0.3536.5±0.43 再灌注36.3±0.3436.5±0.41
2.2 PPARα、SOD1、SOD2、SOD3的表达及使SODs活性的改变 提取小鼠脑组织,结果发现法舒地尔处理后脑组织中PPARα的相对含量明显升高(1.601±0.051vs1.124±0.046),差异有统计学意义(P<0.05)。见图2。取小鼠脑组织发现小鼠经法舒地尔处理后,其脑组织中SOD1、SOD2、SOD3的表达明显升高(P<0.05),SODs的检测结果表明法舒地尔处理能够使组织中SODs的活性升高(P=0.000)。见表3。
3 讨论
法舒地尔是一种RHO激酶抑制物,在机体中具有扩张血管、改善脑微循环等作用[7],在大鼠缺血模型中,用法舒地尔处理后,可以改善缺血损伤,其机制是降低缺血区MMP-9的活性及减少中性粒细胞的浸润,以改善血脑屏障(blood-blood barrier,BBB)的功能[8],在法舒地尔对大鼠I/R损伤的研究中认为其保护作用与脂质化的法舒地尔颗粒大小有关[5],在大鼠肺缺血再灌注动物模型中给予法舒地尔处理,可以减轻I/R损伤,但是在机制方面的阐述上仅仅认为与Rho激酶相关[9],有研究认为法舒地尔处理少突胶质细胞后可以促进PPARα的表达[6],PPARα激活后可以促进SODs的表达[10],激活的SODs可以促进血管内皮细胞的增殖,并促进血管的生成[11-12]。组织中血管再生并改善侧支循环,从而使由于某种原因导致的脑组织缺血缺氧引起的坏死、损伤得到改善[11,13],因此在研究I/R引起的脑组织损伤时,改善脑组织的侧支循环有可能是保护I/R损伤的部分机制。
在急性脑卒中,脑损伤的主要原因是脑血流的减少和二次损伤,例如炎症过程。而法舒地尔能够减少缺血性脑损伤,这种效果似乎由以下的效应所介导的:(1)可增加rCBF(区域性脑血流);(2)通过抑制中性粒细胞浸润从而阻止炎症反应。继发损伤是指坏死区域的组织受到进一步的破坏,这是由大量的血管,生化和细胞的级联包括脊髓屏障的破裂和水肿的形成、缺血、缺氧、血管活性物质的释放导致脊髓灌注的改变,与谷氨酸相关的神经元细胞的死亡,形成自由基和一氧化氮,损伤线粒体能量耗尽,炎性细胞的侵袭和激活(例如中性粒细胞、小神经胶质细胞、巨噬细胞和星形胶质细胞),分泌裂解酶和细胞因子导致组织的进一步损伤,少突胶质细胞凋亡和神经退行性变[6-7]。法舒地尔对抑制缺血后的继发性损伤起到重要作用,法舒地尔通过增加局部脑血流量改善血流动力学功能,阻止血液黏滞性过高,并在内皮细胞中上调内皮一氧化氮合酶的活性。法舒地尔也能在大脑缺血后通过抑制中性粒细胞和单核细胞的浸润,抑制中性粒细胞和血管中O2-的产生防止炎症反应的继续发展。
法舒地尔是一种RHO激酶抑制物,在机体中具有扩张血管,改善脑微循环等作用[7]。在本研究中,我们利用法舒地尔预处理小鼠,然后进行小鼠大脑中动脉I/R模型,结果发现小鼠的脑坏死体积由对照组的(100.78±3.36)mm3减小到(47.36±2.29)mm3,说明法舒地尔可以减轻I/R损伤。培养的少突胶质细胞经法舒地尔处理后,其细胞中PPARα的表达升高[10],而在我们的研究中,经法舒地尔处理的小鼠脑组织PPARα的表达明显高于CMC,说明在机体水平或者细胞水平法舒地尔具有促进PPARα表达的作用。利用体外培养的人脑微血管内皮细胞,研究SOD3启动子活性时,我们发现PPARα可以正向调控SOD3的表达[11],在该研究中用法舒地尔处理后,小鼠脑组织中的SOD1、SOD2、SOD3的表达明显升高,SODs的活性也高于CMC处理组,说明法舒地尔处理后,引起小鼠脑组织中PPARα的表达改变以调控SODs的表达;由于生理性、药物性等原因使SODs激活,均对血管内皮细胞的增殖和血管的生成产生影响[12-14],而在我们的研究中,在I/R过程中用Laser Speckle监测缺血区脑血流时发现,与CMC组相比,法舒地尔组小鼠其缺血区的微血管分布明显增多,脑血流增强,说明法舒地尔处理后,小鼠缺血区的脑组织侧支循环得到改善,因此,我们认为法舒地尔在小鼠的脑I/R损伤中的神经保护作用可能是依赖于激活PPARα,然后促进SOD1、SOD2、SOD3的表达,SODs的表达也明显升高,表达升高的SOD1、SOD2、SOD3促进血管的生成,从而导致侧支循环的改善。
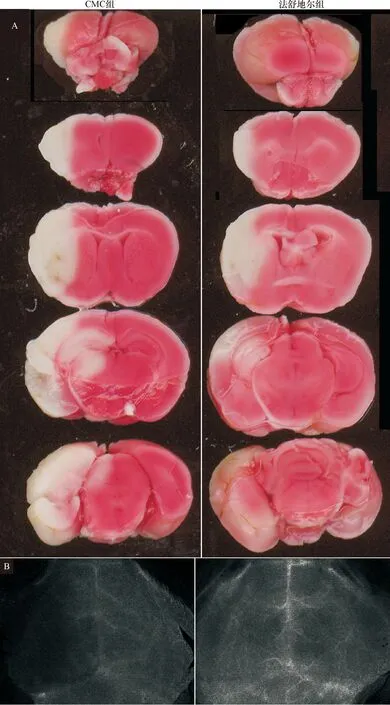
A:每组一只小鼠的脑组织,连续切为5片,TTC染色;B:法舒地尔处理对小鼠脑I/R后脑血流的影响

图2 法舒地尔处理对正常小鼠PPARα表达的影响

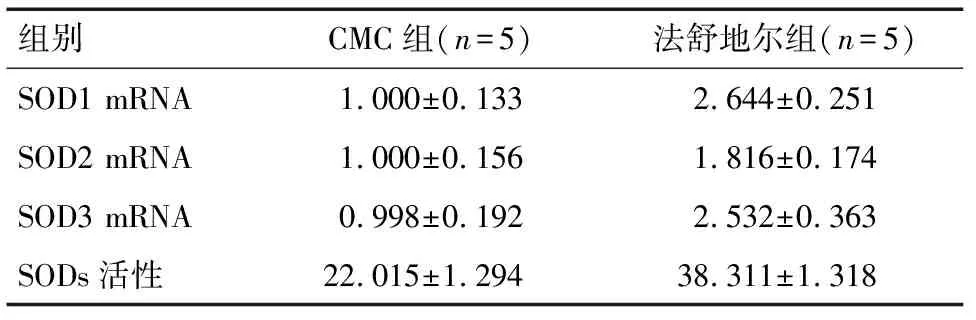
组别CMC组(n=5)法舒地尔组(n=5)SOD1 mRNA1.000±0.1332.644±0.251SOD2 mRNA1.000±0.1561.816±0.174SOD3 mRNA0.998±0.1922.532±0.363SODs活性22.015±1.29438.311±1.318
脑I/R损伤的保护机制可能与改善脑血流、减轻炎症反应和减轻血脑屏障的损伤有关[15-17]。在本研究中,法舒地尔处理后,小鼠脑组织中的PPARα、SOD1、SOD2、SOD3的表达以及SODs的活性均明显升高,小鼠脑组织缺血区的血管分布得到增强,因此法舒地尔在I/R中的神经保护可能是通过促进PPARα的表达,以影响SOD1、SOD2、SOD3以及SODs的表达及活性,从而促进血管的生成以改善侧支循环,达到神经保护的作用。
综上所述,本研究表明,法舒地尔在脑I/R损伤中具有神经保护作用,这一作用与改善侧支循环密切相关。
