响应面法优化黄芩茎叶对照提取物纯化工艺及其特征图谱研究△
2019-07-03张雅蓉徐犇李纳刘吉爽徐文慧陈新
张雅蓉,徐犇,李纳,刘吉爽,徐文慧,陈新
长春中医药大学 药学院,吉林 长春 130117
黄芩茎叶为唇形科植物黄芩ScutellariabaicalensisGeorgi的干燥茎叶,具有清热燥湿、泻火解毒的功效[1]。主要含野黄芩苷、芹菜素苷等黄酮类化合物[2],有效部位为黄芩茎叶总黄酮,现已有“倒挂品种[3]”黄芩茎叶解毒胶囊上市销售,用于治疗上呼吸道感染疾病。
以中药对照提取物为代表的质量控制方法已成为一种新的研究思路和模式,近几年,多种药材的对照提取物[4-7]研究均取得了初步成效,不仅可用于药材的薄层定性鉴别,也可以标示多个单体成分的含量[8]。本实验通过研究黄芩茎叶总黄酮纯化工艺以及特征图谱,为制备黄芩茎叶对照提取物提供参考,将有助于改善检验工作时使用化学对照品(中药标准物质)检验信息单一、价格高昂,制备对照药材溶液过程繁琐的状况,有利于质检工作高效进行。
1 材料
1.1 仪器
1260高效液相色谱仪(美国Agilent公司);WondaSil C18色谱柱(250 mm×4.6 mm,5 μm,日本岛津公司);AB265-S十万分之一分析天平(瑞士梅特勒托利多公司);GZX-9240MBE数显鼓风干燥箱(上海博讯实业有限公司设备厂);UV-1810紫外-可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 试剂
野黄芩苷对照品(中国食品药品检定研究院,纯度:91.7%,批号:110842-201709);野黄芩素对照品(上海源叶生物科技有限公司,纯度>98%,批号:YY91209-20);甲醇[上海西格玛奥德里奇(上海)贸易有限公司,色谱纯];甲酸(天津市光复精细化工研究所,色谱纯);纯净水(杭州娃哈哈集团有限公司);大孔吸附树脂D101(东鸿化工有限公司);AB-8(天津市光复精细化工研究所);DM130(北京索来宝化工有限公司);ADS-7(天津鸿博美化工科技有限公司);XDA-1(西安蓝晓科技新材料有限公司);其他试剂均为分析纯。
1.3 试药
本次共收集样品11批,经长春中医药大学张景龙教授鉴定,均为唇形科植物黄芩ScutellariabaicalensisGeorgi。样品经自然风干后,切段,50 ℃干燥,粉碎,过二号筛,备用。样品详情见表1。

表1 样品信息
注:HQJY为黄芩茎叶拼音首字母缩写。
2 方法与结果
2.1 粗提物制备
取干燥黄芩茎叶适量,加入8倍量的70%乙醇溶液,回流2次,各1 h,过滤,回收乙醇,干燥(60 ℃),即得。
2.2 对照提取物纯化
精密称取粗提物适量,加水配制成质量浓度为30.0 mg·mL-1的溶液,加浓盐酸调节pH为2~3,放置12 h[9],离心,沉淀备用,上清液作为上样液,大孔吸附树脂吸附2 h,6 BV水洗至中性,再用不同浓度乙醇以相应流速洗脱,收集洗脱液。上述沉淀用水洗至中性,再用乙醇溶解,与洗脱乙醇液混合,回收乙醇,干燥,即为对照提取物。
2.3 总黄酮的含量测定方法
2.3.1 标准曲线绘制 取野黄芩苷对照品10.0 mg,置于50 mL量瓶中,加甲醇超声溶解,定容,摇匀,即为对照品溶液。精密吸取上述溶液0.4、0.8、1.2、1.8、2.4 mL至10 mL量瓶中,甲醇稀释至刻线,以甲醇作空白,在波长为285 nm处测定野黄芩苷的吸光度(A)值。以野黄芩苷浓度(mg·mL-1)为横坐标,吸光度(A值)为纵坐标,绘制标准曲线,回归方程为Y=15.082X+0.044 3(r=0.998 2),野黄芩苷在0.007 3~0.044 0 mg·mL-1线性良好。
2.3.2 供试品溶液制备 取黄芩茎叶对照提取物干燥粉末20 mg,精密称定,置于100 mL量瓶中,加甲醇超声处理20 min后,定容至刻线,摇匀,再取1.0 mL至100 mL量瓶中,加甲醇至刻度,摇匀,过滤,即得。
2.3.3 精密度试验 取2.3.1项下野黄芩苷对照品溶液,连续测定6次吸光度(A)值,RSD为0.26%,表明本方法所用仪器精密度良好。
2.3.4 稳定性试验 按照2.3.2项下方法得样品溶液,测定10、20、30、40、50、60 min时吸光度(A)值,RSD为0.42%,表明溶液稳定性良好。
2.3.5 重复性试验 取同一批黄芩茎叶对照提取物干燥粉末6份,各20 mg,按2.3.2项下方法得样品溶液,测定各样品吸光度值(A),RSD为0.77%,说明该方法重复性良好。
2.3.6 准确度试验 精密称定黄芩茎叶对照提取物(总黄酮质量分数56.49%)6份,各10 mg,分别置于100 mL量瓶中,加入一定量野黄芩苷对照品,再照2.3.2方法制备样品溶液,测定吸光度(A)值,计算回收率,结果见表2,总黄酮平均回收率为97.66%,RSD为0.82%,准确度符合要求。
2.4 大孔吸附树脂型号筛选
取预处理好的D101(非极性)、AB-8(弱极性)、DM130(中极性)、ADS-7(强极性)及XDA-1(极性)大孔树脂各25 mL,分别装于5根树脂柱(20 cm×1.5 cm)中,加入上样液8.0 mL,流速为1 mL·min-1,用6 BV水洗除去提取物中的水溶性多糖、无机盐离子等杂质,再用4 BV的95%乙醇洗脱,流速为1 mL·min-1,合并洗脱液。按照2.2项下方法测定总黄酮含量,计算吸附率和解吸率。计算结果见图1。AB-8型大孔吸附树脂的吸附效果和解吸效果明显优于其他型号,且更为经济,因此,选择AB-8型大孔吸附树脂对黄芩茎叶对照提取物进行纯化。公式如下。

(1)

(2)
C0:上样液总黄酮的浓度,V0:上样液体积;
C1:水洗液总黄酮的浓度,V1:水洗液体积;
C2:洗脱液总黄酮的浓度,V2:洗脱液体积。
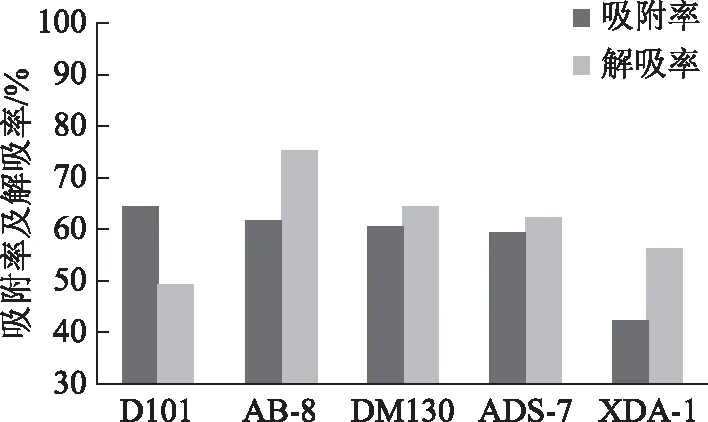
图1 吸附率和解吸率实验结果(n=2)
2.5 泄漏曲线
取黄芩茎叶上样液150.0 mL,上样至装有AB-8大孔吸附树脂25 mL的树脂柱(20 cm×1.5 cm)中,流速为1 mL·min-1,流出液每10 mL收集一份,收集15份停止,测定黄芩茎叶总黄酮含量,以收集次数为横坐标,总黄酮含量为纵坐标,绘制泄漏曲线,见图2。当收集到第5份,即约为2倍柱体积时,总黄酮开始大量泄漏,故确定泄漏点为50 mL,即每1 mLAB-8型大孔树脂的上样量最多不能超过2 mL。
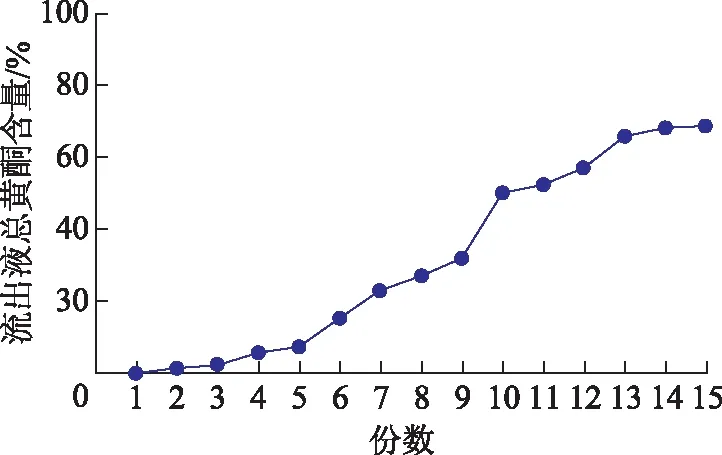
图2 泄漏曲线(AB-8型)
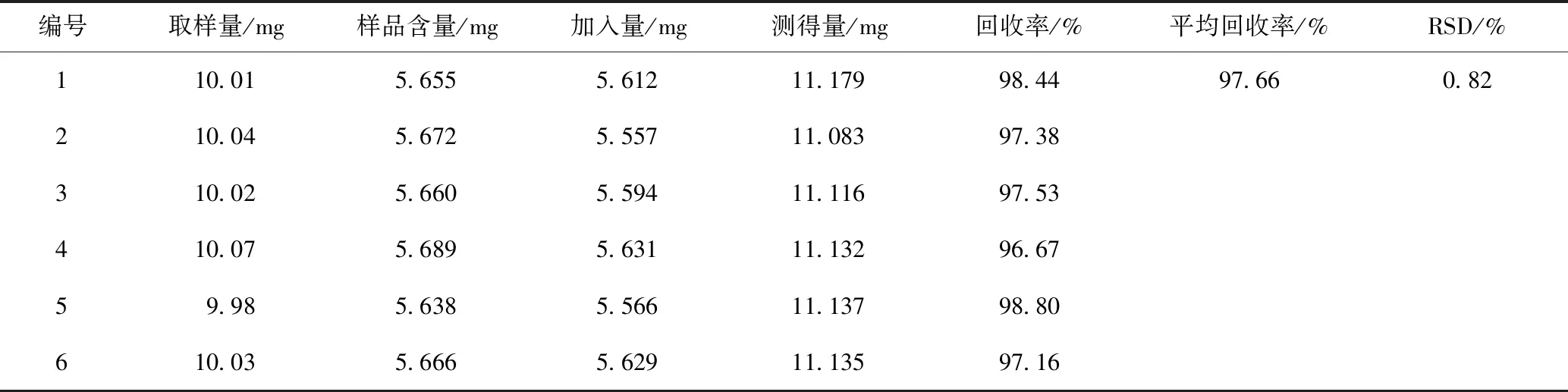
表2 准确度试验结果(n=6)
2.6 单因素考察
2.6.1 上样流速 取黄芩茎叶上样液50.0 mL至装有AB-8大孔吸附树脂25 mL的树脂柱(20 cm×1.5 cm)中,以流速0.5、1、1.5、2、2.5、3 mL·min-1分别上样,上样完成后吸附2 h,6 BV水除杂,流速为2 mL·min-1,95%乙醇洗脱,流速为4 mL·min-1,6 BV体积洗脱。收集洗脱液,测定总黄酮含量,结果见图3。总黄酮含量最高时,流速为1.5 mL·min-1,因此,上样流速应当控制在1.5 mL·min-1。

图3 上样流速选择
2.6.2 洗脱溶剂 取黄芩茎叶上样液50.0 mL至装有AB-8大孔吸附树脂25 mL的树脂柱(20 cm×1.5 cm)中,以流速1.5 mL·min-1上样,上样完成后吸附2 h,6 BV水除杂,流速为2 mL·min-1,继续分别以30%、50%、60%、70%、80%、95%乙醇洗脱,流速为4 mL·min-1,洗脱6 BV体积。收集洗脱液,测定总黄酮含量,结果见图4。总黄酮含量较高的是60%~95%乙醇洗脱液,综合考虑以70%乙醇进行洗脱纯化。
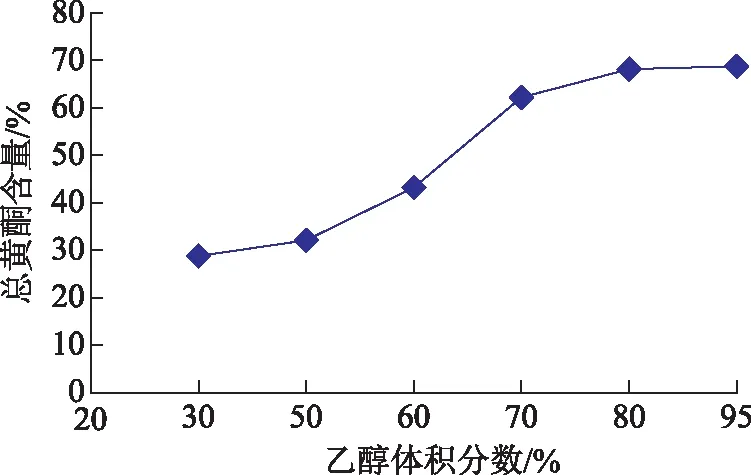
图4 洗脱溶剂选择
2.6.3 洗脱体积 取黄芩茎叶上样液50.0 mL至装有AB-8大孔吸附树脂25 mL的树脂柱(20 cm×1.5 cm)中,以流速1.5 mL·min-1上样,上样完成后吸附2 h,6 BV水除杂,流速为2 mL·min-1,然后用70%乙醇洗脱,流速为3 mL·min-1,洗脱体积分别为2、3、4、5、6、7 BV。收集洗脱液,测定总黄酮含量,结果如图5,总黄酮含量随着洗脱体积的增大而不断变化,当洗脱流速超过5 BV后,再增大洗脱体积,总黄酮含量增幅不大,由此,洗脱体积控制在5 BV最佳。

图5 洗脱体积选择
2.6.4 洗脱流速 取黄芩茎叶上样液50.0 mL至装有AB-8大孔吸附树脂25 mL的树脂柱(20 cm×1.5 cm)中,以流速1.5 mL·min-1上样,上样完成后吸附2 h,用6 BV水除杂,流速为2 mL·min-1,继续用70%乙醇洗脱,流速为1、2、3、4、5、6 mL·min-1,5 BV体积洗脱。收集洗脱液,测定总黄酮的含量,结果如图6。总黄酮含量随着洗脱流速的增大在不断变化,当洗脱流速为4 mL·min-1时,总黄酮含量最高,由此,洗脱流速控制在4 mL·min-1最佳。
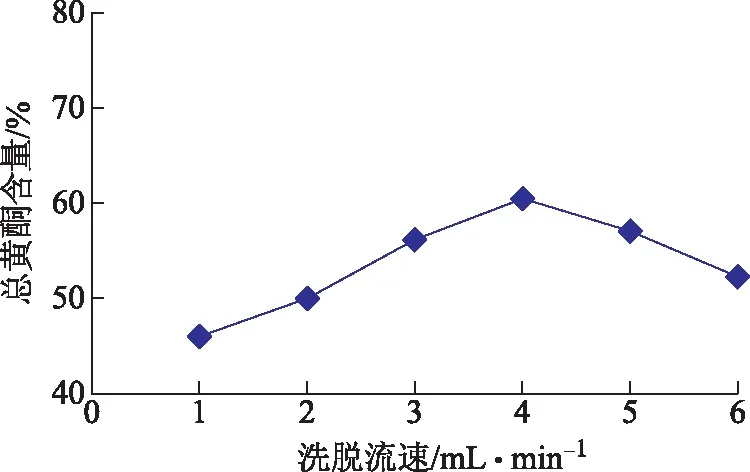
图6 洗脱流速选择
2.7 响应面法优化黄芩茎叶总黄酮纯化工艺
2.7.1 试验设计方法 在单因素试验基础上,依据Box-Benhnken(中心组合)试验设计原理,以A(乙醇浓度)、B(上样流速)、C(洗脱体积)、D(洗脱流速)为自变量,Y(总黄酮含量)为评价指标进行设计,见表3~4。

表3 响应面试验因素水平表

表4 响应面分析方案及结果 %
2.7.2 模型建立与显著性分析 采用Design-Expert 10.0.3软件对数据进行二次多元回归拟合,建立二次多元回归方程Y=65.58+1.68A+0.84B+1.55C+0.44D-0.16AB-1.12AC-0.58 AD+0.62BC-0.067BD+0.30CD+0.52A2-1.46B2-1.25C2-1.47D2,数据模型方差分析结果见表5。

由F值可知,4个因素对总黄酮含量显著性影响的顺序为A>C>B>D。由P值可知,模型一次项A、B、C,交互项AC,二次项B2、C2、D2为极显著项(P<0.01),模型一次项D,二次项A2为显著项(0.01
根据上述回归方程,绘制各因素交互作用的三维响应曲面图及等高线图,见图7~8。响应曲面较陡和椭圆形等高线说明两试验因素交互作用显著,响应曲面较平和圆形等高线说明交互作用不显著[10]。因此,黄芩茎叶总黄酮含量受A(乙醇浓度)、B(上样流速)、C(洗脱体积)、D(洗脱流速)四者的共同影响。首先,本实验采用AB-8型(弱极性)大孔树脂,黄芩茎叶所含黄酮成分为弱极性分子,故高浓度乙醇有利于该类成分洗脱,但当乙醇浓度超过80%时,洗脱液中醇溶性杂质逐渐增多,导致总黄酮含量下降。其次,上样流速慢,不仅延长操作时间,还会使树脂与黄酮类化合物产生死吸附,增加洗脱难度,降低收率。再次,洗脱体积量过小,导致洗脱成分未完全流出树脂柱,降低收率;洗脱体积量过大,总黄酮含量变化增幅不明显,溶剂消耗增加。最后,洗脱流速过大,导致洗脱成分未与大孔树脂上的黄酮分子吸附就已随洗脱剂流出,并且体积流量过小会延长洗脱工作时间,降低洗脱效率。

表5 方差分析结果
注:P<0.01表明差异有统计意义;“—”为差异无统计学意义。
2.7.3 验证性实验 根据Box-Behnken响应面实验优化结果,得到最佳方案为乙醇浓度76.527%,上样流速1.703 mL·min-1,洗脱体积5.441 BV,洗脱流速4.129 mL·min-1。结合实际情况,确定纯化条件为乙醇浓度80%,上样流速1.5 mL·min-1,洗脱体积5 BV,洗脱流速4 mL·min-1。采用优化后的方法对黄芩茎叶进行纯化制得对照提取物,测得3批对照提取物总黄酮质量分数分别为66.93%、66.86%、66.71%,平均值为66.83%,理论值为67.19%,RSD为0.38%,表明预测值与真实值接近,说明该实验设计和数学模型合理可靠,可用于纯化黄芩茎叶对照提取物。

图7 各因素两两交互等高线图

图8 各因素两两交互响应曲面图
2.8 对照提取物特征图谱的建立
2.8.1 色谱条件 色谱柱:岛津WondaSil C18(250 mm×4.6 mm,5 μm),甲醇(A)-0.02%甲酸溶液(B),梯度洗脱(0~40 min,34%~64.67%A);检测波长:335 nm;柱温:30 ℃;流速:1.0 mL·min-1;进样量:10 μL。
2.8.2 参照物溶液制备 取野黄芩苷、野黄芩素对照品适量,精密称定,加甲醇制成每1 mL含野黄芩苷0.10 mg的溶液,每1 mL含野黄芩素0.05 mg的溶液,即得。
2.8.3 供试品溶液制备 取黄芩茎叶对照提取物20 mg,精密称定,置10 mL量瓶中,加甲醇超声处理30 min,用甲醇定容至刻线,摇匀,过滤,取续滤液,即得。
2.8.4 共有峰模式和参照峰的确定 取11批黄芩茎叶药材,按照响应面法优化的对照提取物纯化工艺制得样品(S1~S11),并照2.8.1项下方法,依次进行高效液相分析,参照物色谱图见图9。在所有样品图谱中2号峰(野黄芩苷)分离度良好、峰面积较大且稳定,所以确定2号峰为参照峰(S),计算其他特征峰的相对保留时间和相对保留峰面积的RSD值,各共有峰的相对保留时间RSD值为0.12%~0.40%;相对峰面积RSD值为8.03%~36.05%,具有显著差异。
2.8.5 重复性试验 取同一批样品(S1),制备6份样品溶液,按照2.8.1项下方法进样,以野黄芩苷为参照峰,计算相对保留时间和相对峰面积,RSD值分别为0.97%、1.54%,说明该方法重复性良好。
2.8.6 精密度试验 取同一份样品(S1)溶液,按照2.8.1项下方法,连续进样6次,以野黄芩苷为参照峰,计算相对保留时间及相对峰面积,RSD值分别为0.39%、0.74%,表明该仪器精密度良好。
2.8.7 稳定性试验 取同一份样品(S1)溶液,按照2.8.1项下方法,分别于0、2、4、8、12、24 h进样,以野黄芩苷为参照峰,计算相对保留时间及相对峰面积,RSD值分别为0.86%、1.04%,说明样品溶液在24 h内稳定。
2.9 相似度软件数据处理与评价
使用2012版中药色谱指纹图谱相似度评价系统软件对11批黄芩茎叶提取物样品色谱图的AIA文件格式进行处理,设定“中位数”法,时间窗宽度为0.10,多点校正,并进行自动匹配,结果显示,黄芩茎叶对照提取物共有7个共有峰,特征图谱叠加见图10,对照特征图谱(R)见图11。以对照特征图谱(R)为对照,计算11批黄芩茎叶对照提取物样品相似度(0.957~0.989),见表6。

注:1.为野黄芩苷;2.为野黄芩素图9 参照物色谱图

图10 HQJY对照提取物样品的特征图谱

注:2.野黄芩苷;7.野黄芩素。图11 黄芩茎叶对照提取物的对照特征图谱

编号相似度编号相似度S10.988S70.973S20.982S80.989S30.966S90.982S40.974S100.980S50.979S110.985S60.957R1.000
3 讨论
黄芩茎叶的主要成分为野黄芩苷、芹菜素苷等黄酮类化合物,具有酚羟基,在经酸化处理后,易形成沉淀析出[11],但因析出不完全,故采用大孔吸附树脂法富集上清液中的黄酮类化合物,提高收率。另外,大孔吸附树脂有吸附快、稳定性好、洗脱率高和再生简便的特点,已广泛用于总黄酮的纯化工艺研究[12-15],Box-Behnken响应面法可考察各因素之间的交互作用,高效地减少实验次数。
本实验首次以黄芩茎叶总黄酮为指标,采用紫外分光光度法(UV),先对黄芩茎叶醇提物进行酸化处理,再选用5种不同极性的大孔吸附树脂,以单因素法考察树脂型号、树脂用量、上样液浓度、洗脱剂浓度、洗脱剂用量等因素,并采用Box-Behnken响应面法对黄芩茎叶对照提取物的纯化工艺进行优化。利用高效液相色谱建立了黄芩茎叶对照提取物特征图谱的测定方法,11批样品相似度均大于0.950,说明此次提取制得的黄芩茎叶提取物的质量稳定、可控。
本实验通过对黄芩茎叶对照提取物工艺优化及特征图谱的研究,为对照提取物的质量控制提供了实验依据,高度体现了中药质量控制的整体性、特征性和系统性[16],为黄芩茎叶对照提取物的开发和利用提供了参考。
