药物代谢酶CYP2E1、GSTM1基因启动子区甲基化与抗结核药物性肝损伤的相关性研究
2019-07-02邓乐乐韦丽琴郝金奇胡宝翠
邓乐乐,韦丽琴,郝金奇,张 冬,胡宝翠
0 引 言
世界卫生组织《2017年全球结核病报告》显示,结核病是全球第九大致死性疾病,是由结核分枝杆菌(mycobacterium tuberculosis,Mtb)引起的慢性传染性疾病。2016年全球约有1040万新增结核病病例,其中我国的新发病例数占7.48%[1]。近年来,尽管结核病在国家推荐的标准化抗结核药物方案下得到了有效的治疗和控制,但药物不良反应所导致机体损伤也逐渐受到了人们的重视。已有临床研究证明,异烟肼、利福平、吡嗪酰胺和乙胺丁醇等一线抗结核药物均可产生不同程度的肝毒性[2]。在服用一线药物的结核病患者中,部分患者出现了抗结核药物性肝损伤(anti-tuberculosis drug induced liver injury,ATLI),发生率在2.55%~34.90%[3-5]。多项研究表明高龄、女性、慢性乙酰化状态、营养不良、艾滋病毒携带等环境因素是ATLI发生的危险因素[6-8]。除此之外,约20%~95%的ATLI发生是由较为重要的遗传因素决定的[9]。
在遗传因素方面,越来越多的研究表明药物代谢酶在ATLI发生、发展过程中发挥重要的作用,主要包括细胞色素P450酶系(Cytochrome P450,CYP450)、氮 乙酰 基转 移 酶(Nacetyltransferase,NATs)和谷胱甘肽S-转移酶(Glutathione S-transferase,GSTs)等[10-11]。基因多态性是药物代谢酶的一个重要特征,是导致药物个体差异的重要原因之一。多项研究均发现CYP2E1基因多态性与ATLI的发生有关[12-14]。有研究发现GSTM1缺失基因型是ATLI发生的影响因素[15]。但是药物代谢酶表现出的多态性并不能完全解释个体差异的存在。随着基因组学研究的不断深入,越来越多的研究将研究重点转向基因组的另一类信息:表观遗传学信息。DNA甲基化作为表观遗传修饰重要的一部分,既往研究表明DNA异常甲基化与多种肿瘤的发生有关[16],而药物代谢酶基因异常甲基化是否与ATLI发生有关尚未见报道。本研究主要探讨药物代谢酶CYP2E1和GSTM1基因甲基化水平与ATLI之间的关系,阐述ATLI发病机制,为ATLI的发生提供病因学线索。
1 资料与方法
1.1 研究对象选取2016年9月至2018年12月在内蒙古自治区通辽市结核病防治所已确诊并进行治疗的93例蒙古族肺结核患者资料。根据是否发生ATLI分为2组:肝损伤组(接受抗结核药物治疗6个月内发生ATLI的蒙古族结核病患者,n=31)、对照组(与肝损伤组同性别、年龄相差≤5岁、接受抗结核药物治疗6个月内未发生ATLI的蒙古族结核病患者,n=62)。肝损伤组男16例,女15例,平均年龄(41.55±13.37)岁;对照组男32例,女30例,平均年龄(41.03±14.61)岁。入组依据《中华人民共和国卫生行业标准肺结核诊断标准(WS288-2008)》[17]。纳入标准:①接受异烟肼、利福平、吡嗪酰胺等药物治疗;②抗结核治疗前肝功能正常,治疗期间至少有3次以上肝功能检查结果;③3代均无与外族通婚史。排除标准:①患有其他肝疾病(酒精性肝病、自身免疫性肝炎、病毒性肝炎等),或其他可能导致肝功能紊乱的全身性疾病的患者;②已确诊具有酒精性肝损伤患者,或未经确诊但有酗酒史者。本研究经过学校伦理委员会批准[批准号:2018(003)],患者均签署知情同意书。
1.2 抗结核药物性肝损伤的诊断标准根据《抗结核药物所致药物性肝损伤诊断与处理专家建议》。间隔 2周以上、连续 2次检测 ALT>40 U/L,或/和TBIL>38 μmol/L,或单次检测ALT>80 U/L即可定义为 ATLI[18]。
1.3 研究方法
1.3.1 收集基础资料包括人口学特征、生活方式与习惯、结核病类型、既往患病史及服药史、肝功检查结果等疾病相关情况。调查问卷是由经过统一培训的结核病防治研究所工作人员采用面对面问答方式完成,同时填写知情同意书。
1.3.2 DNA提取及亚硫酸盐修饰采集血样,采用DNA提取试剂盒(购于天根生化科技有限公司),按照说明书进行细胞裂解,离心后提取细胞核沉淀,用蛋白酶溶液和RNA溶液处理,再进行多次吸附柱处理,加入50 μL缓冲液溶解DNA。所提取DNA需满足浓度>30 ng/uL,纯度 A260/A2801.7~2.0,A260/A230>1.4,置于-20℃储存备用。使用亚硫酸盐处理试剂盒对DNA进行修饰,其原理是将样本DNA中没有甲基化的C全部转化为U。
1.3.3 甲基化检测基于MassARRAY平台检测甲基化水平,过程主要包括:亚硫酸盐修饰后的DNA进行PCR扩增(CYP2E1和GSTM1引物序列分别为:5′端引物:GTTTTGAGAAGGAGGGTGATTTATT,3′端引物:TCCTTCTAACCCCATTCATATAACA;5′端引物:TAGTATTATGGGTATGGTGTTGGTTG,3′端引物:AAACCACCACTTTTTAATCTAACCC。PCR产物长度分别为493bp和497bp)、SAP反应、T切/RNase A消化反应、树脂纯化等。基因启动子区甲基化水平=CpG片段数/(CpG片段数+CpA片段数)。将甲基化水平<30%为低甲基化,30%~70%为部分甲基化,>70%为高甲基化[19],观察CpG位点的甲基化水平。
1.4 统计学分析采用SPSS 19.0软件进行统计分析。计数资料组间比较采用χ2检验;ATLI相关影响因素分析采用Logistic回归;2组间甲基化水平比较采用Mann-Whitney U秩和检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 单因素分析结果2组BMI、婚姻状况、文化程度、职业、等差异无统计学意义(P>0.05),但在吸烟、饮酒史上差异有统计学意义(P<0.05),见表1。
2.2 CYP2E1和GSTM1基因启动子区CpG岛甲基化水平CYP2E1、GSTM1基因启动子区均存在1个CpG岛,共包含39个CpG位点(9,30),CpG位点数目分别为9、23个,总体检出率82.05%(32/39),见图1。结果发现,34.38%的CpG位点平均甲基化水平<30%,15.63%的CpG位点平均甲基化水平>70%。
CYP2E1基因启动子区9个CpG位点平均甲基化水平为74.11%,其中CpG_8甲基化平均水平为41.82%,另外8个位点的平均甲基化水平在69.76%~87.55%。肝损伤组启动子区9个CpG位点平均甲基化为71.26%,其中CpG_4.5.8位点的平均甲基化水平处于30%~70%,CpG_1.2.3.6.7.9位点的平均甲基化水平>70%。对照组启动子区9个CpG位点平均甲基化为75.53%,其中CpG_1.2.3.8位点的平均甲基化水平处于30%~70%,CpG_4.5.6.7.9位点的平均甲基化水平>70%,最高达86.81%。肝损伤组CpG_1.2.3平均甲基化水平高于对照组(81.26%vs 69.63%),其他8个位点的平均甲基化水平均对照组高于肝损伤组。

表1 本组结核病患者单因素结果分析[n(%)]]Table1 General data on the 93 tuberculosis patients n(%)
GSTM1基因启动子区23个CpG位点平均甲基化水平为19.86%,肝损伤组和对照组分别为18.16%、20.71%,均为低甲基化。CpG_2、4、5、6、7、8、9、10、11、12、13、14、15、19、20、21、28、29共15个CpG位点平均甲基化水平均低于30%,最低甲基化水平为0.17%;其他8个CpG位点均呈现部分甲基化状态,最高甲基化水平为59.03%。见图1。
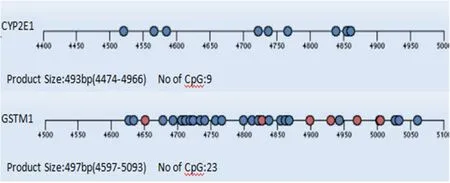
图1 CYP2E1和GSTM1基因启动子区CpG位点数量及反向序列分布Figure 1 Number and distribution of the CpG islands in the CYP2E1 and GSTM1 promoter regions of the tuberculosis patients
2.3 CYP2E1和GSTM1基因启动子区CpG岛甲基化与ATLI的关系2组CYP2E1_CpG_1-6位点及总体甲基化水平差异有统计学意义(P<0.05),说明本组蒙古族结核病患者ATLI与CYP2E1基因启动子区甲基化水平有关。2组GSTM1_CpG_13、14、18位点甲基化水平差异有统计学意义(P<0.05),GSTM1基因启动子区总体甲基化水平差异无统计学意义(P>0.05),说明本组GSTM1基因启动子区甲基化水平与蒙古族结核病患者ATLI的发生无关,见表2。
2.4 ATLI相关影响因素Logistic回归分析将上述单因素分析中差异有统计学意义的因素全部纳入Logistic回归模型。以分组为应变量,吸烟、饮酒、CYP2E1、GSTM1基因启动子区甲基化水平4个因素为自变量,进行Logistic回归分析。结果显示,饮酒、CYP2E1基因启动子区甲基化与蒙古族结核病患者ATLI发生有关(P<0.05),调整OR(95%CI)分别为5.329(1.442~19.697) 、0.312(0.165~0.591) 。见表3。
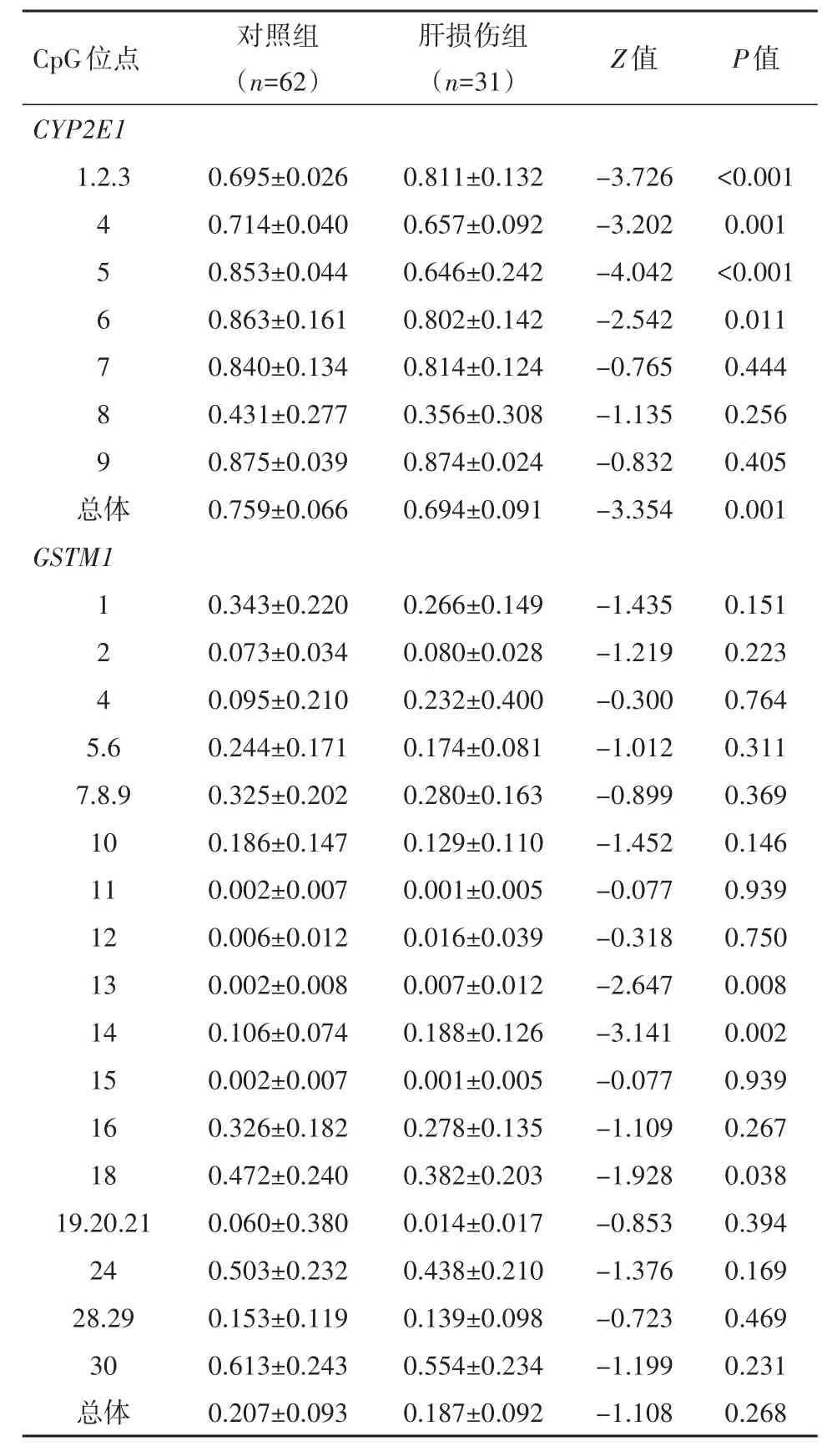
表2 结核病患者CYP2E1、GSTM1基因启动子区CpG位点甲基化水平比较(xˉ± s)Table 2 Methylation levels of the CpG islands in the CYP2E1 and GSTM1 promoter regions of the tuberculosis patients in the ATLI and non-ATLI control groups(xˉ± s)
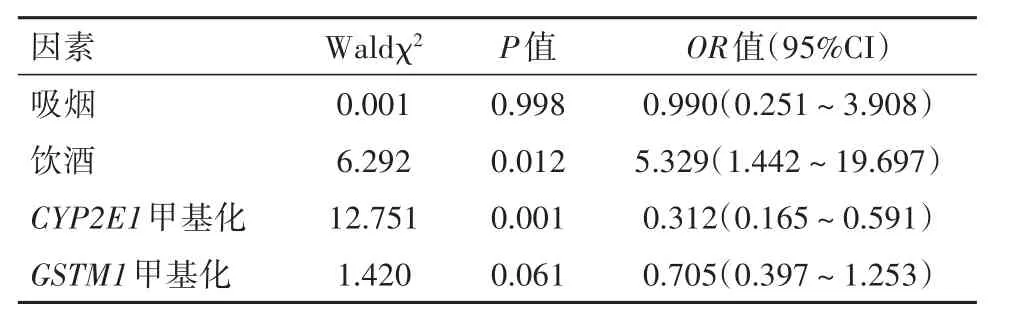
表3 结核病患者ATLI相关影响因素多因素Logistic回归分析Table 3 Results of multivariate logistic regression analysis on the risk factors of ATLI in the tuberculosis patients
3 讨 论
目前,关于抗结核药物性肝损伤的研究多集中在基因多态性,而在表观遗传学方面研究短缺,故本研究从表观遗传学中较为重要的DNA甲基化方面进行研究,为降低ATLI的发生率,减少病死率提供更多信息。
本研究发现相对于部分甲基化(30%~70%),CYP2E1基因启动子区高甲基化(>70%)是ATLI的保护因素,可以降低ATLI发生的风险,提示蒙古族结核患者CYP2E1基因启动子区部分甲基化(30%~70%)可以增加ATLI的风险,甲基化水平越低发生ATLI的风险越高。Zhang等[20]发现汉族CYP2E1基因启动子区高甲基化患者发生ATLI的危险性是低甲基化者的4.390倍,这与本研究部分甲基化患者比高甲基化患者发生ATLI的危险性更高的结果不一致。原因为:①种族、地域差异,蒙古族结核患者中的确存在这种现象;②ATLI的判定标准不同,本研究肝损伤的诊断根据《抗结核药物所致药物性肝损伤诊断与处理专家建议》[18];Zhang等[20]诊断标准来源于1990年在巴黎召开的国际共识会议;③实验方法不同,本研究基于Mass ARRAY平台对药物代谢酶基因启动子区甲基化水平进行定量检测,范围为0~100%;而Zhang等[20]采用甲基化特异性PCR法对药物代谢酶基因甲基化进行甲基化和非甲基化状态的定性检测;④本研究样本量不足。另外,Shen等[21]发现ATLI大鼠全基因组甲基化水平低于正常组,且CYP2E1基因启动子区出现了异常的甲基化改变。因此本研究认为CYP2E1基因启动子区高甲基化者发生ATLI的危险性可能低于部分甲基化者。
本研究单因素分析和多因素Logistic回归分析均未发现GSTM1基因启动子区甲基化与ATLI的发生有关,结合本研究前期对GSTM1基因多态性与ATLI关系的研究结果同样未发现GSTM1基因多态性与ATLI的发生有关。故GSTM1基因无论从遗传学还是表观遗传学都与ATLI的发生无关。
目前,有关GSTM1基因甲基化与ATLI的关系还未见报道。但研究发现,许多GSTs类基因启动子区的异常甲基化影响着基因转录调控过程。多项研究表明,GSTP1启动子区异常甲基化会抑制基因表达,从而增加了肝损伤发生的可能性[22],如王锦红[23]发现,肝癌早期就可检测出基因启动子区甲基化的异常改变,并作出GSTP1基因启动子区甲基化可能参与了肝炎的发生,并参与了肝癌发生、发展的整个过程。同样,贺蕾[24]发现GSTP1基因多态性与ATLI的发生无关;其启动子区CpG岛甲基化与ATLI的发生有关,具有高甲基化特征的患者是发生ATLI的高危人群。可见GSTs基因各亚家族的与ATLI之间关系的研究并不完全一致,需要我们进一步探索,寻求更多证据来证明两者之间真正的关系。
发病机制方面,CYP2E1基因启动子区高甲基化会抑制转录过程,从而抑制CYP2E1酶活性,在异烟肼的代谢途径主要表现为:①异烟肼通过NAT2乙酰化形成乙酰异烟肼,经水解生成异烟酸和乙酰肼,NAT2基因启动子区高甲基化抑制其酶活性,使其不能发挥功能,从而降低了抗结核药物的代谢分解能力,增加了肝损伤的可能性;②通过酰胺酶作用水解生成异烟酸和肼。肼可以被继续乙酰化为乙酰肼和二乙酰肼。其中,肼和乙酰肼是造成肝损伤的主要原因,乙酰肼经CYP酶作用催化产生毒性中间代谢产物,它们与不饱和脂肪酸发生氧化反应导致肝细胞的损害[25],CYP2E1基因启动子区的高甲基化同样会抑制其酶活性,这样乙酰肼由于没有酶的催化,减少了毒性代谢产物的形成,降低肝损伤发生的可能性。研究显示GSTs被认为是细胞内的自由基清除剂,主要参与化学物质的解毒过程[26],上述形成的毒性代谢产物可进一步被肝内的GSTs结合,降解肼和乙酰肼的生成,减轻对肝细胞的毒性作用[27]。
综上所述,本研究揭示了蒙古族CYP2E1、GSTM1基因甲基化水平与ATLI之间的关系,加深了对蒙古族结核病患者ATLI发病机制中基因甲基化的认识,提示CYP2E1基因甲基化可作为ATLI发生的生物标志物应用于结核病患者ATLI的预防和控制。
