不同提取方法对灰树花呈味物质释放的影响
2019-07-01徐晓东宋诗清
许 锐,徐晓东,宋 泽,贾 茜,冯 涛,宋诗清*
(上海应用技术大学香料香精技术与工程学院,上海 201418)
灰树花(Grifola frondosa)属担子菌亚门、层菌纲、非褶菌目、多孔菌科、树花菌属,又名贝叶多孔菌,浙江庆元等地俗称云蕈,河北迁西等地俗称栗蘑,四川称千佛菌,日本称舞茸。灰树花不仅口感鲜美,含有丰富的蛋白质、碳水化合物、多糖、维生素、多种微量元素,更具有免疫功能和抗癌作用[1-2],其中灰树花多糖中生物活性最高的β-葡聚糖具有较好的抗炎作用[3-4]。20世纪80年代以来,日本、中国等国的科学家在灰树花的生物、化学、药理学等方面进行了广泛研究,结果表明灰树花是具有特殊价值的药食两用菇[5]。
近年来,国内外研究者对灰树花等食用菌的研究主要集中在多糖、贮藏保鲜及初级调味品开发等方面,有关灰树花呈味物质方面的研究鲜见报道。Zhang Anqiang等对灰树花水溶性多糖的纯化和结构鉴定进行了研究[6];Yang Hailong等研究了灰树花发酵液与豆乳之间的协调作用[7];He Xiaoyun等提取了灰树花中的新呋喃酮并对其进行鉴定,同时对其抗菌性进行了研究[8];吕旭聪等分析了灰树花抗氧化活性多酚的提取纯化方法并对其进行鉴定[9];Su Chunhan等研究了不同提取温度对灰树花生物活性多糖理化性质的影响[10];Dissanayake等研究了灰树花提取物的功能性食用价值[11];陈贵堂等对灰树花多肽的抗氧化活性进行了研究[12];茆广华研究发现富硒灰树花子实体具有减毒、抗肿瘤和增强免疫机制的作用[13]。有关食用菌风味物质的研究一直是风味化学工作者研究的重点,食用菌调味料及食用菌风味食品的开发是食用菌深加工的重要方向[14-15]。食用菌的滋味主要是其丰富多样的风味物质引起的,主要分为挥发性和非挥发性两类。食用菌的挥发性组分种类繁多,主要包括八碳化合物及其衍生物、萜烯类、含硫化合物以及醛类、酸类、酮类、酯类等[16]。非挥发性风味物质主要是一些可溶性糖及糖醇、有机酸、游离氨基酸以及5’-核苷酸等[17]。本实验以可溶性糖、有机酸、游离氨基酸组成和含量、分子质量分布为指标,研究高压蒸煮、酶解和闪式高速提取对灰树花呈味物质释放的影响,以期为食用菌调味料的开发及风味增强肽产品的研究提供理论依据。
1 材料与方法
1.1 材料与试剂
灰树花干品为浙江庆元市售。
纤维素酶(20 000 U/g)、风味蛋白酶(20 000 U/g)、食用菌水解酶(2 000 U/g) 广西南宁庞博生物工程有限公司;海藻糖、岩藻糖、鼠李糖、阿拉伯糖、葡萄糖、木糖、甘露糖、果糖、甘露醇及5’-核苷酸标准品 美国Sigma公司;氨基酸标准品 日本Wako公司;其他试剂 国药集团化学试剂公司。
1.2 仪器与设备
ICS2500型离子色谱仪、CarboPac PA-20阴离子交换分析柱、Carbo Pac MA-1阴离子交换柱 美国Dionex公司;600高效液相色谱仪 美国Waters公司;Ultimate AQ-C18色谱柱 上海月旭材料科技有限公司;Green ODS-AQ C18色谱柱 上海易创仪器分析有限公司;ATN-300全自动凯氏定氮仪 上海洪纪仪器设备有限公司;754PC紫外-可见分光光度计 上海菁华科技仪器有限公司;GL-21M高速冷冻离心机 上海卢湘仪离心机仪器有限公司;DHG-9145A型鼓风干燥箱、HWS28型电热恒温水浴锅 上海一恒科学仪器有限公司;CS-700粉碎机 上海淀久机械制造有限公司;Milli-Q超纯水设备 美国Ultra公司;JHBE-60T闪式高速提取器上海钒帜精密设备有限公司;ASTREE电子舌系统法国Alpha MOS公司。
1.3 方法
1.3.1 原料前处理
灰树花干品使用CS-700粉碎机粉碎,过200 目筛,储存待用。
1.3.2 灰树花原液制备
称取100 g灰树花粉末,按料液比1∶20加入去离子水,混合,搅拌均匀,浸泡1.5 h,经8 层纱布过滤,得灰树花原液(记为A1)。
1.3.3 灰树花酶解液的制备
食用菌水解酶酶解:称取100 g灰树花粉末,按料液比1∶20加入去离子水,升温至90 ℃,灭酶5 min,冷却至50 ℃,调节pH值至4.5,加入食用菌水解酶0.2 g(0.2%(以灰树花质量计,下同)),酶解1.5 h,升温至90 ℃,灭酶5 min后,7 000 r/min下冷冻离心15 min,取上清液备用(记为B1)。
复合酶酶解:称取100 g灰树花干品粉末,按料液比1∶20加入去离子水,升温至90 ℃,灭酶5 min,冷却至50 ℃,调节pH值至3.5,加入纤维素酶0.5 g(0.5%),酶解1.5 h,然后调节pH值至6.0、温度为50 ℃,加入风味蛋白酶0.4 g(0.4%),继续酶解1.5 h,升温至90 ℃,灭酶5 min后,7 000 r/min下冷冻离心15 min,取上清液备用(记为C1)。
1.3.4 灰树花高压蒸煮液的制备
称取100 g灰树花粉末,按料液比1∶20加入去离子水,在40 kPa压力下蒸煮1.5 h,蒸煮液冷却至室温,7 000 r/min下冷冻离心15 min,取上清液备用(记为D1)。
1.3.5 灰树花闪式高速提取液的制备
在进行上述4 种处理前,将100 g灰树花粉末按料液比1∶20加入去离子水,在11 000 r/min的转速下,用闪式高速提取器提取2 min,再通过以上4 种处理方法分别制得4 个样品,分别记为A2、B2、C2、D2。
1.3.6 水分含量的检测
水分含量的检测参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[18]中烘箱法。
1.3.7 粗蛋白含量的检测
粗蛋白的检测参照GB/T 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[19]中凯氏定氮法。
1.3.8 粗脂肪含量的检测
粗脂肪含量测定参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》[20]中酸水解法。
1.3.9 可溶性糖含量的检测
可溶性糖含量的检测参考Ajlouni等[21]的方法。
1.3.10 有机酸、游离氨基酸含量及分子质量分布的检测
有机酸、游离氨基酸含量及分子质量分布的检测参考徐晓东等[22]的方法。
1.3.11 灰树花呈味物质的呈味特性测定
采用ASTREE电子舌系统,其主要由味觉传感器、信号采集器和模式识别系统3 个部分组成。该装置配有7 个传感器(SRS-1、BRS-1、SWS-1、UMS-1、STS-1、SPS-1、GPS-1),以Ag/AgCl作为参比电极,在室温下进行数据采集。数据采集前,电子舌系统需要经过自检、诊断和矫正等步骤,以确保采集得到的数据具有可靠性和稳定性。本实验采用体积分数为10%的乙醇作为清洗溶剂,采样时间120 s,1 次/s,每个样品设置3 个平行样品。
1.4 数据处理与分析
实验所得数据表示为平均值±标准差。采用SPSS软件进行显著性分析,分析方法为最小显著差法,显著性水平为P<0.05。主成分分析(principal component analysis,PCA)采用Unscramb 9.7软件。
2 结果与分析
2.1 灰树花干品的基本成分
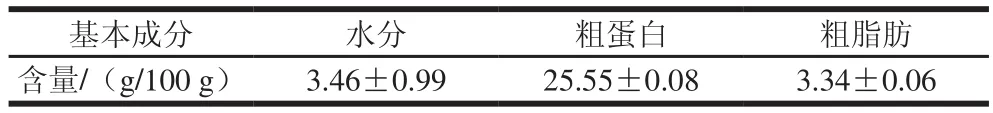
表1 灰树花干品基本成分Table 1 Chemical composition of Grifola frondosa
由表1可知,灰树花干品的水分含量为3.46 g/100 g。灰树花中主要的营养物质为蛋白质,其含量较高,为25.55 g/100 g,因此适合呈味肽的开发研究。同时,灰树花中粗脂肪含量极低,仅有3.34 g/100 g,适合健康饮食的需要。
2.2 不同处理方式对灰树花可溶性糖含量的影响

表2 不同处理方式条件下灰树花提取液中可溶性糖含量Table 2 Soluble sugar contents in Grifola frondosa extracts obtained by different extraction methods
由表2可知,和原液相比,所有的处理方式条件下灰树花提取液中可溶性糖的总量都呈现显著性降低,尤其采用闪式高速提取处理后的高压蒸煮制备液中其含量由1.15 mg/g(A2)降低为0.12 mg/g(D2)。这可能是由于在高压蒸煮制备过程中会伴随有美拉德反应的发生,导致糖含量降低,而进一步采用闪式高速提取器进行处理,其细胞破碎程度增加,除了糖的释放,蛋白质或氨基酸含量也会增加,美拉德反应程度也相应加剧。两种酶的酶解处理同样会伴随有美拉德反应的发生,因此可溶性糖含量出现降低,但又因为酶解条件相对温和,尽管采用了闪式高速提取器处理,可溶性糖总量也没有出现显著性降低。
食用菌的甜味主要是由这些小分子可溶性糖提供的[21]。从单一糖含量的变化来看,除样品D1外,蔗糖在其他样品中的含量显著降低,且在食用菌水解酶酶解处理的样品B1和B2中未检出;木糖和阿拉伯糖在样品B、C和D中都呈下降趋势;葡萄糖的含量在两种酶处理的样品组中呈现增加趋势,可能是葡萄糖的释放量大于其消耗量,而葡萄糖在高压蒸煮液中显著降低,说明其释放量不足以满足消耗量;鼠李糖和岩藻糖在原液中均未检出,而在高压蒸煮液中被检出;酶解液和高压蒸煮液中检出岩藻糖的存在。
对比4 组样品闪式高速提取器处理前后的可溶性糖含量可知,闪式高速提取对可溶性糖的释放有一定的促进作用。
2.3 不同处理方式对灰树花有机酸含量的影响

表3 不同处理方式条件下灰树花提取液中有机酸含量Table 3 Organic acid contents in Grifola frondosa extracts obtained by different extraction methods
有机酸是存在于生物体中的酸,是具有羧基(—COOH)的有机化合物的总称。本实验选择研究了10 种有机酸的变化,结果如表3所示。和原液相比,无论是酶解处理还是高压蒸煮处理,其有机酸的总量都呈显著性增加,如原液A1中有机酸的总量为2.79 mg/g,经过食用菌水解酶酶解处理后(B1),其有机酸的总量增加到4.83 mg/g,高压蒸煮处理后(D1),其总量增加到5.27 mg/g。其中丙酸在原液(A1和A2)中均未检出,而在B、C和D样品中检出,尤其在食用菌水解酶酶解处理的样品B1和高压蒸煮处理的样品D1中含量较高,分别为2.84 mg/g和3.22 mg/g。乳酸在复合酶酶解处理样品中增加较明显,由原液A1中的0.83 mg/g增加到C1中的2.43 mg/g。酒石酸和富马酸的含量变化不明显,而其他有机酸经过不同处理后含量变化没有明显规律性,但是有机酸对食品的酸味起到重要的作用,因此有机酸含量增加,其样品的酸味感有可能会增加。对比4 组样品闪式高速提取器处理前后的有机酸含量变化可知,除经过闪式高速提取处理后的原液略有降低外,其他3 组经过闪式高速提取处理后都呈现一定程度的增加趋势。
2.4 不同处理方式对灰树花游离氨基酸含量的影响

表4 不同处理方式条件下灰树花提取液中游离氨基酸含量Table 4 Free amino acid contents in Grifola frondosa extracts obtained by different extraction methods
游离氨基酸是食用菌中重要的鲜味活性物质。除了色氨酸未检测出,其余17 种氨基酸都能检测到,结果见表4。从游离氨基酸总量上看,两种酶解作用后的游离氨基酸总量都呈现显著性增加,尤其复合酶酶解处理的样品,其总量由118.70 mg/100 g增加到221.60 mg/100 g,其原因可能是复合酶是分步酶解,这使得灰树花蛋白在酶解过程中充分释放氨基酸。相反,高压蒸煮处理的样品其游离氨基酸总量出现显著性下降,这与前述的可溶性糖含量降低的结果相吻合,可能是由于美拉德反应的发生所导致。从各个氨基酸的变化可以看出,除蛋氨酸、苯丙氨酸、异亮氨酸和亮氨酸外,所有的氨基酸含量在高压蒸煮过程中均降低,很多研究报道它们都是参与美拉德反应产生呈味物质的重要前体物[23];其中天冬氨酸和谷氨酸是灰树花中主要的呈鲜物质,它们在两种酶解处理中都显著性增加,且复合酶酶解处理的样品增加量最多。
由表4可知,在经过闪式高速提取器处理后,尽管2 组酶解样品游离氨基酸总量有所增加,但是B2和C2中的游离氨基酸含量都低于A2,原因可能是经过闪式提取之后再进行酶解反应会导致一些氨基酸的损失,例如丝氨酸、甘氨酸和缬氨酸等;而呈鲜味、甜味的氨基酸含量有所增加,例如天冬氨酸、谷氨酸、苏氨酸和丙氨酸。因此,闪式高速提取器处理不利于游离氨基酸的释放,或需要进行闪式高速提取优化后再继续进行。
根据氨基酸的呈味特性,将其分为鲜味、甜味、苦味以及无味4 种。其中各氨基酸按呈味特性分类如下,鲜味:Asp+Glu;甜味:Thr+Ser+Gly+Ala+Pro;苦味:Val+Met+Ile+Leu+Phe+His+Arg;无味:Cys+Tyr+Lys,分别计算其含量,结果如表5所示。
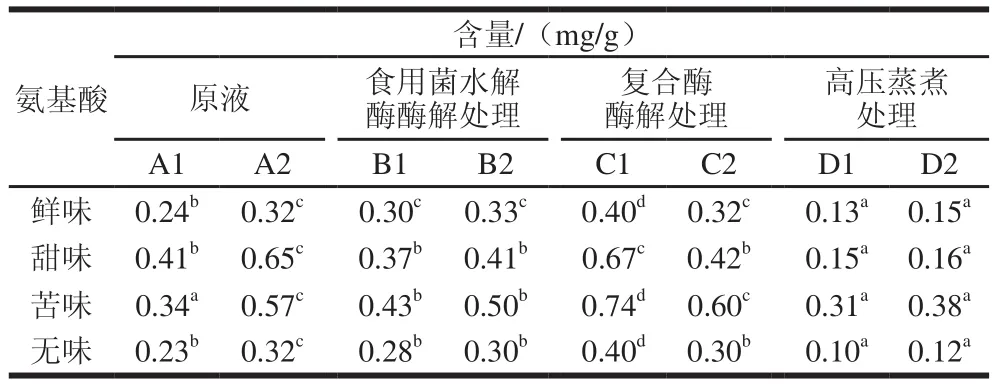
表5 不同处理方式条件下灰树花提取液中游离氨基酸分类及含量Table 5 Free amino acid composition in Grifola frondosa extracts obtained by different extraction methods
谷氨酸与食盐结合形成的L-谷氨酸钠是鲜味的代表物质,也是味精的主要成分,虽然天冬氨酸钠盐的鲜味程度低于L-谷氨酸钠10%[24],但是仍具有明显的鲜味,通常把天冬氨酸和谷氨酸均归类为鲜味氨基酸。由表4可知,天冬氨酸和谷氨酸的总量约占游离氨基酸总量的20%左右。由表5可以看出,复合酶酶解处理的鲜味氨基酸、甜味氨基酸以及苦味氨基酸含量较其他处理增加更明显,但闪式高速提取处理不利于鲜味氨基酸的生成。
2.5 不同处理方式对灰树花肽分子质量分布的影响
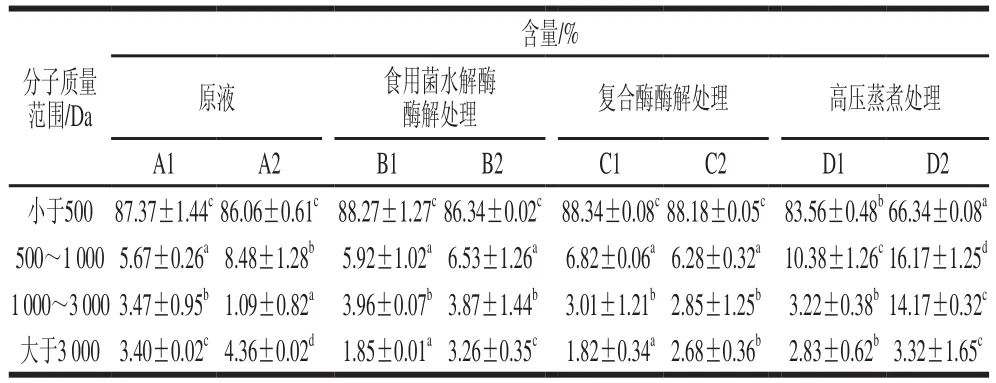
表6 不同处理方式条件下灰树花提取液的分子质量分布Table 6 Molecular mass distribution of Grifola frondosa extracts obtained by different extraction methods
由表6可以明显看出,不同提取方法得到的制备液中不同分子质量组分的肽分布明显不同。和原液相比,酶解作用后,小于1 000 Da组分的含量增加,这是因为酶解条件充分使得大分子分解成小分子,而高压蒸煮处理样品中小于500 Da组分含量降低,但是500~1 000 Da的肽分布含量显著性高于其余3 组,可能是由于高压蒸煮使得蛋白质大分子降解为肽的能力可能小于酶的作用。氨基酸的分子质量都小于500 Da,即3 种不同提取方法处理后,氨基酸的含量都有增加,两种酶解处理液增加最为明显,这与游离氨基酸的分析结果一致。食用菌味道鲜美是源于其含有许多鲜味物质,呈味肽就是一类重要的风味物质,呈味肽是一类分子质量小于3 000 Da的寡肽[25],这类肽组分可与舌头味蕾上某一味道的特异性受体相互作用,呈现特征滋味[26]。由表6可以看出,两种酶解制备液中,小于3 000 Da的组分含量最多,分别占98.15%和98.17%,说明酶解制备液最有可能获得呈味肽。
而经过闪式高速提取器的处理后,小于3 000 Da的组分含量反而减少,可能是当水作为溶剂时会因为水溶的成分太多导致样品的黏稠性增大,发生混悬、乳化等情况,造成过滤困难,同时根据闪式高速提取器的原理,在转头高速转动下和超声情况下,容易产生热量,使得局部温度升高、环境变劣,导致小分子的肽损失,所以小分子的肽经过闪式提取处理之后会出现含量降低现象。
2.6 灰树花呈味物质的呈味特性分析
2.6.1 基于电子舌检测的PCA
PCA可以在没有任何样品信息的条件下,迅速浏览所有数据,找出它们之间的相关性,建立一个合理的模型[27-29]。本研究对不同处理方式的样品进行电子舌分析,将得到的数据进行PCA,由于两个主成分累积贡献率为87%(超过70%),前2 个主成分已经包含了几乎全部的信息,能够反映样品的整体信息,能够清楚地显示出判定结果,说明主成分之间的独立性较强,因此只建立了PC1-PC2的二维判别图。由图1可知,8 个样品明显被分为3 类,A2、B2、C2和D2位于最左侧,B1、C1和D1位于最右侧,A1位于中上部,这说明闪式高速提取器处理对于灰树花的呈味特性有明显影响,原液A1也与处理后的样品味道呈现明显差异。A2位于最左侧,D1位于最右侧,说明A2和D1味道差异最大。B1和D1的距离很近,说明食用菌水解酶酶解处理和高压蒸煮处理的灰树花味道在有些方面更为接近,与原液和复合酶酶解处理差异比较大。

图1 基于灰树花呈味物质电子舌检测分析的PCA图Fig. 1 PCA plot of Grifola frondosa extracts based on electronic tongue data
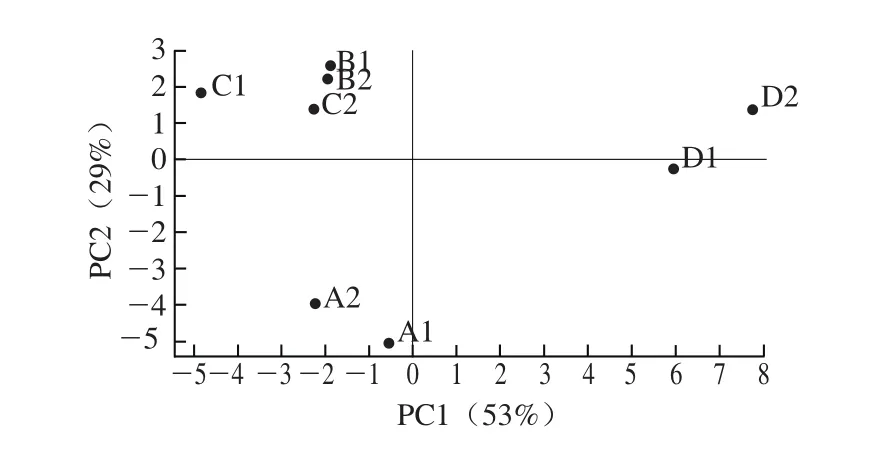
2.6.2 基于呈味物质含量检测的PCA分析
以8 个样品中可溶性糖、有机酸和游离氨基酸的含量为变量,采用数理统计方法将样品进行PCA分析。由于两个主成分累积贡献率为82%(超过70%),前2 个主成分已经包含了几乎全部的信息,能够反映样品的整体信息,能够清楚地显示出判定结果,说明主成分之间的独立性较强,因此只建立了PC1-PC2的二维判别图。由图2可知,样品D位于PC1的右侧,其余样品都在PC1左侧,说明高压蒸煮下处理的样品与其他方式处理的样品在呈味物质的释放方面存在明显差异。同时还可以看出,样品B和C距离比较接近,与样品A相差较远,说明酶解处理后的样品在呈味物质释放上比较相似,而与原液明显不同。由于样品中呈味物质分析仅给出含量的差异,体现在味感上面更加复杂,而电子舌可以给出酸、甜、鲜、苦、咸和复合口感,所以二者的PCA分析存在差异。但综合图1、2的分析可以得出,无论酶解还是高压蒸煮处理,味感及呈味物质都与原样存在明显差异,闪式高速提取处理后其味感及呈味物质也发生了明显改变。
3 结 论
经过食用菌水解酶酶解、复合酶酶解和高压蒸煮3 种不同提取方法获得的制备液,呈味物质都有一定的变化,3 种不同的提取方法对灰树花呈味物质释放的影响不尽相同。
研究结果表明,和原液相比,所有处理方式的样品可溶性糖总量都显著性降低,尤其采用闪高速提取处理后的高压蒸煮制备液。从有机酸含量变化来看,酶解处理和高压蒸煮处理的样品有机酸总量都显著性增加;对比4 组样品闪式高速提取器处理前后的有机酸含量变化可知,除原液经过闪式高速提取处理后略有降低外,其他3 组经过闪式高速提取处理后都呈现一定程度的增加。从游离氨基酸总量上看,两种酶解作用后的样品游离氨基酸总量都显著性增加,尤其复合酶酶解处理的样品。相反,高压蒸煮处理的样品游离氨基酸总量显著性下降,可能是由于美拉德反应所导致。在经过闪式高速提取器处理后,尽管两组酶解样品氨基酸总量有所增加,但是和经过闪式高速提取器处理的原液相比仍然较低,因此,闪式高速提取器处理不利于游离游离氨基酸的释放,或需要进行闪式高速提取优化后再继续进行。由氨基酸分类及含量变化可以看出,闪式高速提取处理不利于鲜味氨基酸的保留。PCA分析发现无论酶解还是高压蒸煮处理,味感及呈味物质都与原样存在明显差异,同时闪式高速提取处理后其味感及呈味物质也发生了明显改变。
总之,本实验通过系统研究不同提取方法对灰树花中呈味物质释放的影响,对灰树花呈味深加工产品的开发提供了一定的理论参考。
