对中东亚人群胃癌相关易感基因的挖掘
2019-06-27安覃景李思思韩崇旭
安覃景,李思思,韩崇旭,3△
(1.大连医科大学研究生院,辽宁大连 116044;2.江苏省苏北人民医院/扬州大学临床医学院临床医学检验中心,江苏扬州 225001;3.扬州大学医学院研究生院,江苏扬州 225001)
胃癌是我国常见的肿瘤之一[1],由于其早期临床症状不明显,潜伏期较长,故大部分患者确诊时已处于晚期阶段。因此,胃癌的早发现、早诊断和早治疗在提高患者生存率方面显得尤为重要。近年来,生物信息学方法已成为筛选易感基因的常用分析工具。本研究通过基因表达数据库(GEO)对中东亚人群的胃癌易感基因进行挖掘,旨在从基因角度探索其发病机制,从而对胃癌的诊断和治疗提供帮助。
1 资料与方法
1.1一般资料 本研究资料均来自于GEO数据库(https://www.ncbi.nlm.nih.gov/gds)中东亚人群胃癌数据集GSE56807和GSE63089。
1.2研究方法 在GEO数据库中利用GEO2R平台的limma包分别对2个数据集的癌症组织和正常胃组织进行分析,取其交叉的差异表达基因提取相应数据文件,进而采用DAVID6.8(https://david.ncifcrf.gov/tools.jsp)在线对已获取的差异表达基因分别从生物学过程(BP)、细胞组分(CC)、分子功能(MF)3个方面进行基因本体(GO)富集分析,并利用KOBA3.0(http://kobas.cbi.pku.edu.cn/)对其进行京都基因与基因组百科全书(KEGG)信号转导通路分析。最终,利用STRING(http://string-db.org/)数据库分析已获取差异表达基因的相互作用,并去除孤立基因。
1.3统计学处理 利用GEO2R平台对数据进行统计学分析,组间比较采用t检验及Bayes检验,并对结果进行筛选,条件如下:(1)P<0.05表示差异有统计学有意义;(2)基因的表达量差异在4.00倍以上或0.25倍以下。GO富集分析采用Fisher精确检验,以P<0.05为差异有统计学意义。KEGG信号转导通路分析采用Fisher精确检验,以P<0.01为差异有统计学意义。
2 结 果
2.1芯片数据资料 本研究中共纳入2个数据集,其包含胃癌组织及正常胃部组织,且数据集人群为中东亚人群,并未涉及胃癌分期和分级,见表1。

表1 数据集基本信息
2.2差异基因选取 在2个数据集间选择交叉的40个基因,其在2个数据集中的方向一致。包括上调基因34个,下调基因6个。
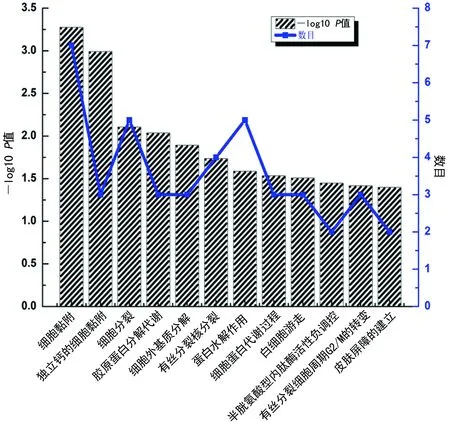
注:双Y轴图中的Y轴分别为-log10P值和在某种生物学过程中差异基因的富集个数
图1差异基因生物学过程分析的GO富集分析
2.3GO富集分析 GO富集分析的结果表明,差异表达基因涉及的生物学过程主要为12项,包括细胞黏附、独立钙的细胞黏附、细胞分裂、胶原蛋白分解代谢、细胞外基质分解、有丝分裂核分裂、蛋白水解、细胞蛋白代谢、白细胞游走、半胱氨酸型内肽酶活性负调控、有丝分裂细胞周期G2/M的转变以及皮肤屏障的建立(P<0.05),见图1。笔者还发现差异表达基因涉及的细胞组分主要包括细胞外空间、纺锤体极、双细胞紧密连接以及顶端浆膜等4项(P<0.05),见图2。涉及的相关分子功能为6项,包括氢-钾交换ATP酶活性、结构分子活动、蛋白酶结合、整合素结合、金属异位酶活性及蛋白质激酶结合(P<0.05),见图3。

注:双Y轴图中的Y轴分别为-log10P值和在某种细胞组分中差异基因的富集个数
图2差异基因细胞组分的GO富集分析
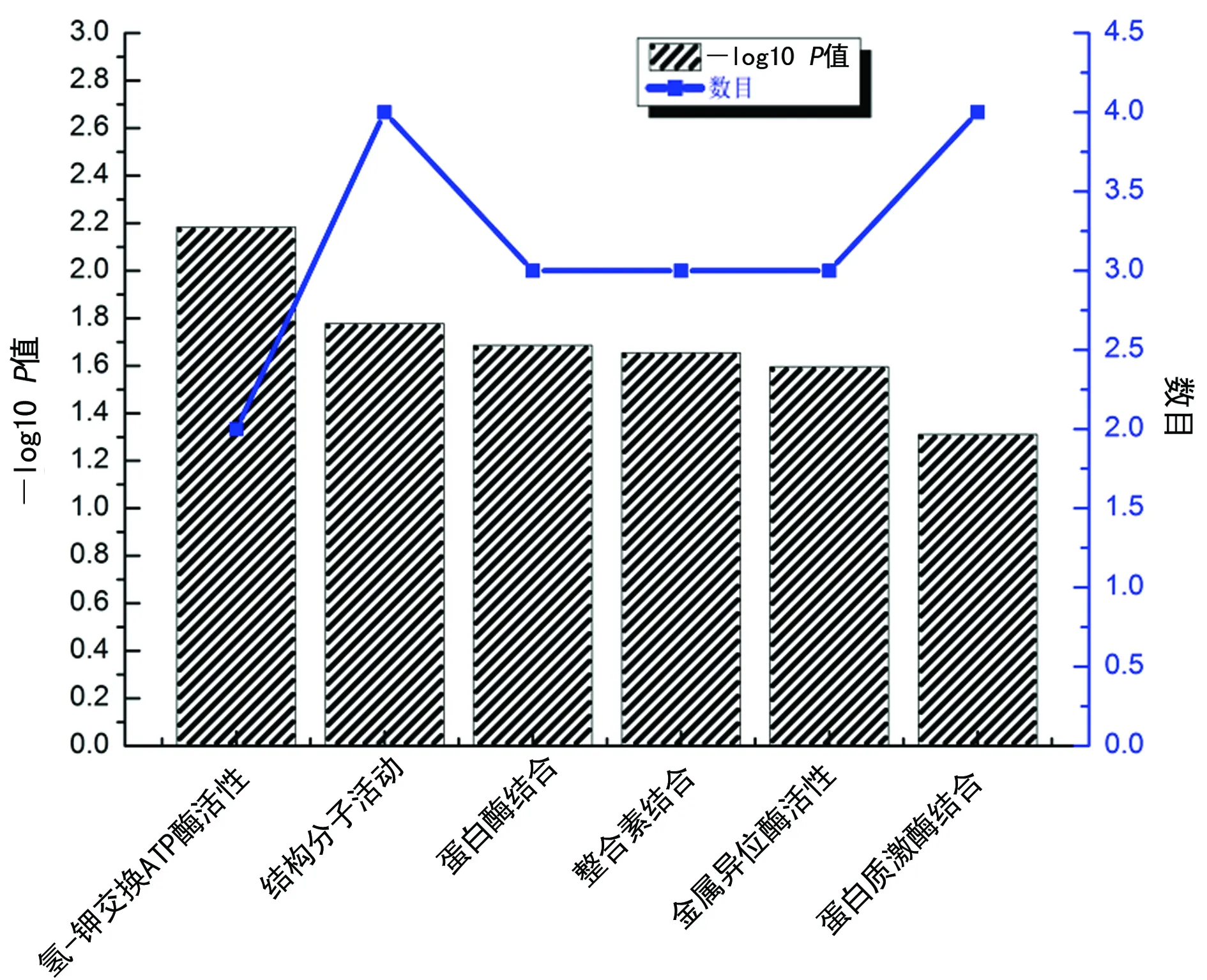
注:双Y轴图中的Y轴分别为-log10P值和在某种分子功能中差异基因的富集个数
图3差异基因分子功能的GO富集分析
2.4差异基因信号转导通路分析 KEGG信号转导通路分析的结果发现,差异表达基因涉及的通路大约有7个(P<0.01),主要包括白细胞转运蛋白迁移、p53信号通路、细胞周期、丙型肝炎、胃酸分泌物收集、紧密连接及细胞黏附分子,见表2。
2.5差异基因的蛋白相互作用分析 STRING分析结果表明,发生相互作用的差异表达基因共计12个,分别为CKS2、ECT2、TPX2、DLGAP5、CCNB1、TOP2A、PBK、CCNB2、RRM2、CDC6、ARHGAP11A和CKAP2,上述差异表达基因可能在胃癌的发生发展过程中起促进或抑制作用,其中首次发现ARHGAP11A基因与胃癌相关。见图4。

表2 差异基因信号转导通路分析
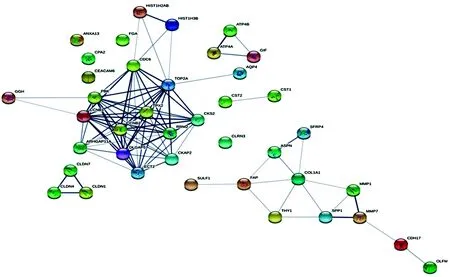
图4 差异基因的蛋白相互作用
3 讨 论
目前,中国、日本和韩国等中东亚地区是胃癌好发地带,新诊断胃癌人数占世界范围的60%[2]。中东亚地区人口基数较大,尚未发现较可靠的胃癌易感基因。因此,挖掘中东亚人群的胃癌易感基因可为其诊断和治疗提供新的依据。
本研究基于GEO数据库对中东亚人群的胃癌差异表达基因进行筛选,根据已获得的差异基因的P值大小及基因的表达量差异倍数等数据,分析各基因与胃癌的相关性。本研究发现,差异基因所涉及的信号通路中的p53信号通路可能与胃癌的增殖和转移相关,多种基因通过其发挥作用,而细胞周期则与患者的预后及病理类型存在较强的相关性,本研究结果与国外研究一致[3-5]。
通过STRING对差异表达基因的蛋白相互作用进行分析,结果表明,共有12个差异表达基因存在蛋白之间的相互作用,且其在2个数据集中均成上调趋势。CKS2属于细胞周期蛋白依赖性激酶亚基家族成员,TANAKA等[6]认为CKS2是胃癌相关基因之一,与胃癌的生物学侵袭性及预后相关,与本研究结果类似。此外高水平的CKS2与组织学肿瘤分化、肿瘤大小、淋巴结转移分期及病理分级高度相关,这可能是因为CKS2提高了细胞生长速度[7]。近年来,有研究表明,胃癌患者上皮细胞转化序列2(ECT2)与肺癌、乳腺癌、胃癌等多种癌症密切相关,其在胃癌患者水平升高可能是由于组织表达增加或肿瘤细胞过度周转,导致大量的ECT2进入血液循环所致[8-10]。TERASHIMA等[11]的研究表明,拓扑异构酶Ⅱ(TOP2A)主要参与DNA合成和细胞增殖,且较易引起血源性复发(HR=2.353),因此,其可能与胃癌的治疗和预后有着密切的联系,为胃癌的治疗提供了新靶点。LI等[12]在GEO数据库中对胃癌易感基因进行了挖掘,同时用PCR方法验证,结果表明,TOP2A是胃癌的明显靶向基因,与本研究结果一致。Xklp2的靶向蛋白(TPX2),又名限制性表达的增殖相关蛋白,它出现在细胞周期的G1和S期之间,在细胞分裂完成后消失[13]。LIANG等[14]研究认为TPX2过表达与整体生存率呈低相关关系(P=0.004),且与复发时间间隔有关(P=0.013),这可能与TPX2是正常双极纺锤体形成和正常细胞分裂所必需的蛋白有关,由此导致胃癌肿瘤细胞过度增殖。大盘相关蛋白5(DLGAP5)是DLGAPS家族成员之一,LIU等[15]在TCGA和GEO数据库对DLGAP进行了研究,并对其在胃癌组织的表达通过PCR验证,结果表明,相对于正常的胃组织,DLGAP4和DLGAP5在胃癌组织中表达量明显增加(P<0.000 1),与本研究结果一致。
KEGG信号转导通路分析显示,细胞周期通路中的成员CCNB1、CCNB2及CDC6与胃癌的发病密切相关,这也存在于差异基因的蛋白相互作用的网络中。CCNB2可与转化生长因子β的Ⅱ型受体结合,因此,CCNB2可能在转化生长因子β介导的细胞周期控制中发挥关键作用[16]。有研究表明,肿瘤细胞中CCNB1的稳定或沉默可能会增加对紫杉醇的敏感性,并导致肿瘤生长停滞[17]。细胞分裂周期6蛋白质(CDC6)可参与细胞更新,其可能通过作用于细胞的增殖指数来影响胃癌预后[18]。
有研究表明,PDZ绑定激酶(PBK)的敲除对胃癌细胞增殖无影响,但可抑制其侵袭[19]。PBK/TOPK主要通过与p53和PI3K/AKT通路相关的分子机制致癌,在p53-DO7阴性组中,肿瘤中PBK/TOPK表达阳性的患者比那些肿瘤中无PBK/TOPK表达的患者存活率明显下降,这可能是胃癌潜在的治疗靶点[20]。核糖核苷酸还原酶M2亚基(RRM2)严格控制细胞周期中核苷酸还原酶的活性,对其进行的功能学研究表明,RRM2特异性siRNA的下调,可能会抑制肿瘤细胞在体外和体内生长,降低侵袭性,并抑制其致癌特性[21]。细胞骨架相关蛋白2(CKAP2)与细胞的增殖活性有关,KIM等[22]对其与胃癌的相关性进行了研究,结果表明,CKAP2在T1或T2男性患者亚组中表达显著(P=0.001),而在其他亚组患者中不存在异常表达,这可能与男女的生理、激素水平及晚期细胞侵袭有一定关系。
本研究得到的存在于蛋白之间相互作用的11个差异基因与以往研究结果具有一致性,进一步证明了筛选得到的差异基因具有较明显的可信性。而LU等[23]研究认为ARHGAP11A可能为肝癌转移信号轴的组成部分,此外,还有研究表明,其主要通过细胞周期中的亚细胞定位导致乳腺癌,该基因在癌细胞中的表达抑制了rhoa依赖机制,如应力纤维形成和局灶性黏附,使细胞更容易迁移[24-25],但目前尚无其与胃癌关系的研究,这为胃癌的发病机制提供了新思路。
4 结 论
本研究通过对GEO数据库中GSE56807及GSE63089 2个中东亚人群数据集进行胃癌易感基因的挖掘,结果发现ARHGAP11A基因可能与胃癌有一定的关系,这为中东亚人群胃癌的病因和治疗方面提供了新方向。
