条件实验综合分析滴定法测定药品含量实验误差在教学中的应用
2019-06-26田宗明
田宗明,田 琼,毛 燕
(1.浙江医药高等专科学校,浙江 宁波 315100;2.湖北工程学院,湖北 孝感 432000)
1 滴定法在药品含量测定中的应用现状
药品的有效成分含量是药品质量重要指标之一[1],药品含量的测定通常采用化学分析和仪器分析,而化学分析中的滴定法在药品含量测定中有广泛的用途。滴定法起源很早,一直沿用到今天仍然普遍应用,虽然滴定分析实验步骤多较,而且大多需要控制实验条件,但是只涉及到称量、溶解、定容、加热、移液、滴定等基本操作技术,实验条件比较低,仪器设备简单,操作快捷简便,在药品的生产企业、检验机构、科研院所等均有采用。滴定分析实验多用于常量分析或半微量分析,相对标准偏差(RSD)在0.2%以内[2],测定结果的准确度很高,能满足多数药品含量测定准确度标准的要求。但理论基础知识、实验操作技术都会对滴定分析实验结果的准确性产生很大的影响,也是产生实验误差的主要原因。
如何有效控制滴定法在测定药品含量操作中实验误差,是在药物分析过程中需要关注的重要问题,为提高滴定法在药品含量的实验误差,我们需要进一步学习滴定分析的理论知识,建立实验误差分析的方法和思路,找到实验误差的来源并在实验过程中合理实验过程中合理控制实验条件,减小实验误差,达到对含量药品测定结果准确度的要求至关重要。采用逆向分析药品含量实验的实验过程,清晰实验步骤,找出实验过程的关键点,深入理解在测定药品含量实验过程中实验误差产生的真正原因,利于加深对实验误差的认识,从而达到对滴定分析在药品含量测定过程中产生误差的精深理解在《中华人民共和国药典》(简称《药典》)1986版~2015版中,滴定法一直是测定药品含量的重量方法,而且作为法定方法也是我国医药工作者在测定药品含量过程中广泛使用。但现实工作是很多人机械的按照药典的方法测定药品含量,对理论知识没有真正的理解,不会融会贯通,在出现实验误差的时候,无法解释并修正,甚至很难甄别、发现实验误差,无法确信实验结果的准确性。总结多年的实验数据发现,即使在熟练掌握滴定操作技术,得到的平行实验实验数据的精密度也很高的情况下,含量测定的结果却出现较大的差异而产生了误差,也正是在这种精密度很高准确度却不高的情况下,处理实验数据时的很难被甄别发现。
2 分析原因及解决方法
实验测定过程总为何会出现实验数据精密度高,实验结果差异却很大的问题呢?从实验过程设计上分析,实验操作人员参照《药典》上的方法对药品含量进行检测时,如果只是机械地安排实验步骤,不按实际实验条件对实验过程分析,没有真正理解实验原理,操作过程中对实验关键点没有真正控制好,实验误差也就很难避免,而且实验过程中个人的操作习惯相对固定,导致产生误差的原因往往重现,且对实验结果影响的程度相近,从而导致实验数据的很接近,实验结果的精密度较高,正是这样的实验误差不容易被操作者发现,从而影响实验结果的准确性。
为了查找误差来源,可以将药品含量测定的滴定分析实验逆向分析,设计成条件实验,对实验过程中的关键条件进行探讨,深入解析误差产生的原因及实验条件对实验结果的影响程度,通过条件实验验证,并分析条件实验数据分析实验关键条件解析的正确性,,进一步优化的实验条件 通找到减小实验误差的关键因素,提高滴定法测定药品含量准确性。在此基础上可进一步将《药典》中常见药品含量测定的滴定分析实验分类、归纳,列出实验关键条件,分析误差来源并总结规律,形成方便学习应用的技术资料。
3 条件实验分析应用实例
现以葡萄糖(C6H12O6)注射液中C6H12O6含量测定实验为例,深入解析条件实验的解析及数据处理分析过程。参照《药典》2000版[3],设计验证实验步骤:移取C6H12O6标准溶液4.00 mL至1000 mL容量瓶,稀释、定容、摇匀,再移取C6H12O6稀释液25.00 mL至250 mL碘量瓶中,加入25.00 mL,0.01 mol/L I2标准溶液,滴加2 mol/L NaOH溶液至碘量瓶,至溶液呈浅黄色后,加盖后水封,于暗处放置约15 min,加6 mL,2 mol/L HCl溶液,用0.02 mol/L Na2S2O3标准溶液滴定,当碘量瓶中反应液显浅黄色后,再加0.5%淀粉指示剂1 mL,接着滴加Na2S2O3标准溶液至蓝色恰好消失,记录消耗Na2S2O3标准溶液的体积,平行5次实验,计算注射液中C6H12O6的含量 。
分析实验过程,解析实验原理:单质碘(I2)与氢氧化钠(NaOH)反应,生成的次碘酸钠(NaIO)能定量的将葡萄糖(C6H12O6)氧化成葡萄糖酸(C6H12O7),用盐酸(HCl)酸化,未与葡萄糖反应的次碘酸钠转化成的单质碘再用硫代硫酸钠(Na2S2O3)标准溶液滴定,最后计算葡萄糖的含量,其反应如下[4]:
I2与NaOH反应:
I2+2NaOHNaIO + NaI + H2O
NaIO与C6H12O6反应:
C6H12O6+NaIOC6H12O7+ NaI
I2氧化C6H12O6的总反应:
I2+ C6H12O6+ 2NaOHC6H12O7+ 2NaI + H2O
C6H12O6反应完后, 碱性条件下NaIO歧化:
加HCl酸化,析出I2:
NaIO3+ 5NaI + 6HCl3I2+ 6NaCl + 3H2O
析出的I2与Na2S2O3反应:
I2+2Na2S2O3Na2S4O6+ 2NaI
分析反应式可以得出:C6H12O6与I2反应的物质的量之比为1∶1;剩余的I2与Na2S2O3反应的物质的量之比为1∶2。故注射液中C6H12O6的含量ρ(C6H12O6)(g/L)如下式计算:

M(C6H12O6) =180.16g/mol[5]
实验过程中有四个影响实验结果的关键条件[6]:①NaOH溶液用量及加入速度。②加NaOH溶液后,于暗处放置时间。③HCl溶液用量。④淀粉指示剂的用量及加入时机。已葡萄糖标准溶液为参照,分别设计条件实验来验证实验误差,探讨测定葡萄糖含量的最佳滴定实验条件。
3.1 实验仪器及试剂
3.1.1 实验仪器
电子天平(Sartorius BAS224S,已校准)、棕色碱式滴定管(25 mL,已校准);容量瓶(1000 mL,250 mL,已校准)、碘量瓶(250 mL)、量筒(10 mL)、移液管(25 mL,已校准)、吸量管(5 mL,已校准)。
3.1.2 实验试剂
HCl溶液(2 mol/L)、NaOH溶液(2 mol/L)、淀粉指示剂(0.5%)、葡萄糖注射液(5%)、Na2S2O3标准溶液(0.02017 mol/L)、I2标准溶液(0.01026 mol/L)。
3.2 NaOH溶液用量及加入速度实验
碱性太弱时,I2歧化反应不完全,生成NaIO的量少,不能完全氧化C6H12O6,使得C6H12O6含量测定结果偏低;碱性太强时,加入相同量HCl溶液后,未反应的碘在酸性偏弱的条件下不能以完全以I2形式析出,且酸性较弱时Na2S2O3与I2反应生成SO42-,使得Na2S2O3标准溶液消耗偏少,C6H12O6含量测定结果偏高,所以要严格控制NaOH溶液的用量。在加入NaOH溶液时,也应注意加入速度,加入速度太快会使生成的NaIO进一步歧化,导致C6H12O6不能被完全氧化;加入速度太慢时,I2挥发和生成的NaIO分解都会导致Na2S2O3标准溶液消耗偏少,C6H12O6含量测定结果偏高。
设计5次平行实验,分别加入2 mol/L NaOH溶液2.0、3.0、4.0、5.0、6.0 mL,考察NaOH溶液用量对C6H12O6含量测定结果的影响,分析表1实验数据,选择最合理的NaOH溶液体积。再设计5次平行实验,分别以1次性、分3次、每秒3滴、每秒1滴、每5秒1滴、每10秒1滴的速度加入NaOH溶液,考察加入NaOH溶液的速度对C6H12O6含量测定结果的影响(表1),根据实验数据表2分析最合理的NaOH溶液加入速度。

表1 不同NaOH溶液用量的实验数据Table 1 Experimental data of the amount of sodium hydroxide solution
注:V(Na2S2O3)为5次实验Na2S2O3标准溶液消耗体积的平均值;颜色是指加入NaOH后反应液呈现的颜色。
分析表1实验数据,与葡萄糖标准溶液浓度比较,当加入3.0~5.0 mL,2 mol/L的 NaOH溶液时,C6H12O6含量测定结果合理,RSD较小。

表2 NaOH溶液滴加速度不同的实验数据Table 2 Experimental data of dropping of sodium hydroxide solution
注:V(Na2S2O3)为5次实验Na2S2O3标准溶液消耗体积的平均值。
分析表2实验数据,在加入NaOH溶液时,速度不能太快或太慢,实验中以每秒3滴至每5秒1滴边滴边摇的方式加入实验结果准确,RSD也在合理范围内。
3.3 加入NaOH溶液后放置时间实验
实验过程中,加入NaOH溶液后需在暗处放置一段时间,是因为I2与NaOH歧化生成的NaIO氧化C6H12O6的反应速度并不是很快,放置时间如果太短,C6H12O6不能被完全氧化,导致测定C6H12O6含量测定结果偏低;放置时间如果太长,剩余的I2挥发和NaIO不稳定分解,都导致C6H12O6含量测定偏高。
设计5次平行实验,在加入NaOH溶液后,选择分别在暗处放置5、10、15、20、25分钟后再测定C6H12O6含量,考察加入NaOH溶液后在暗处放置时间对C6H12O6含量测定结果的影响,根据表3实验数据分析合理的暗处放置时间。

表3 加NaOH溶液后放置时间不同的实验数据Table 3 Experimental data of the place time after dropping the sodium hydroxide solution
注:t指加入NaOH溶液后于暗处放置的时间;V(Na2S2O3) 为5次实验Na2S2O3标准溶液消耗体积的平均值。
分析表3实验数据,加入NaOH溶液后于暗处放置的时间对测定结果的准确性影响很大,参照C6H12O6标准溶液浓度,滴加NaOH溶液后在暗处放置10~16 min,测含量定结果准确,RSD合理。
3.4 HCl溶液用量实验
加入NaOH溶液于暗处放置后,为了剩余的碘以I2析出,需要再加一定量的HCl溶液,如果HCl溶液用量过少时,溶液酸性弱,Na2S2O3与I2反应生成SO42-, Na2S2O3标准溶液消耗体积偏少,使C6H12O6含量测定结果偏高; 如果HCl溶液用量过多时,溶液酸性太强,Na2S2O3会分解, Na2S2O3标准溶液消耗体积增多,使C6H12O6含量测定结果偏低。
设计5次平行实验,分别在加入NaOH溶液于暗处放置后再加入3.0、5.0、7.0、9.0、11.0 mL,2 mol/L HCl溶液,考察HCl溶液用量对C6H12O6含量测定结果的影响,然后根据表4实验数据分析出合理的HCl溶液用量。
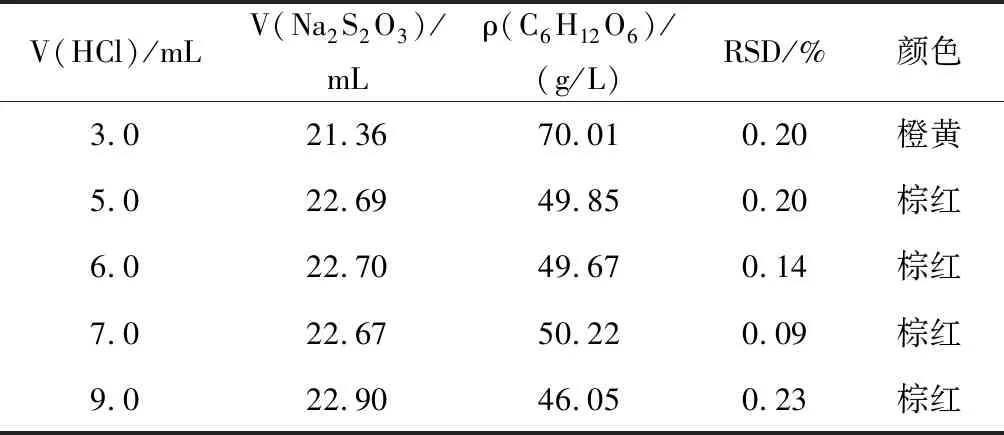
表4 不同HCl溶液用量的实验数据Table 4 Experimental data of the amount of hydrochloric acid
注:V(Na2S2O3) 为5次实验Na2S2O3标准溶液消耗体积的平均值;颜色是指加入HCl溶液后反应液呈现的颜色。
分析表4实验数据,酸性的强弱导致的副反应直接关系反应进行的完全程度,标准溶液的消耗体积差异明显,对C6H12O6含量测定结果的准确性影响很大,数据表明加入 2 mol/L HCl溶液 5.0~7.0 mL最佳。
3.5 淀粉指示剂用量及加入时机实验
间接碘量法需要在接近终点时加入淀粉指示剂,加入指示剂时溶液颜色呈现浅黄较合适,如果颜色太深表明I2量多,与淀粉生成包合物中的I2容易被牢固吸附而不易被滴定, Na2S2O3标准溶液消耗的体积会增加,滴定终点滞后导致C6H12O6含量测定结果偏低。
设计5次平行实验,分别选择在消耗Na2S2O3标准溶液10.00、15.00、20.00、21.00、22.00 mL后加入1.00 mL 0.5%淀粉指示剂,考察加入淀粉指示剂时机对C6H12O6含量测定结果的影响,根据表5实验数据分析加入淀粉指示剂的最佳时机。

表5 淀粉指示剂加入时机的实验数据Table 5 Experimental data of starch indicator added opportunity
注:V1(Na2S2O3)为加淀粉指示剂时Na2S2O3标准溶液已消耗体积;V2(Na2S2O3) 为5次实验Na2S2O3标准溶液消耗体积的平均值;颜色①是指加淀粉指示剂时反应液呈现的颜色;颜色②是指加淀粉指示剂后反应液呈现的颜色。
分析表5实验数据,加入淀粉指示剂时机对实验结果的影响不如其他因素大,在实验滴定过程中,当溶液颜色呈现较浅黄后再加淀粉指示剂,就可以得到合理的实验结果及RSD。
淀粉指示剂的用量过少时溶液颜色太浅,很难判断终点,容易导致实验数据精密度不高,相对标准偏差也较大;用量过多时颜色深,包合物中I2被牢固吸附,滴定终点滞后,,滴定终点滞后导致C6H12O6含量测定结果偏高低。设计5个平行实验,分别加入0.5%淀粉指示剂0.10、0.50、1.00、2.00、4.00 mL,考察淀粉指示剂的用量对C6H12O6含量测定结果的影响,根据表6实验数据分析出合理的指示剂用量。

表6 淀粉指示剂用量不同的实验数据Table 6 Experimental data of the amount of starch indicator
注:V(Na2S2O3) 为5次实验Na2S2O3标准溶液消耗体积的平均值;颜色是指加入淀粉指示剂后反应液呈现的颜色。
分析表6实验数据,如果指示剂用量太多时,溶液颜色太深,滴定终点滞后,相应Na2S2O3标准溶液消耗体积也偏大,导致C6H12O6含量测定结果也偏低;如果指示剂用量太少时,实验终点判断困难,RSD偏大,当加入0.5%淀粉指示剂0.50~2.00 mL时,测定结果合理。
4 结论
通过解析实验原理,设计条件实验,通过分析30组实验验数据可以明确间接碘量法测定C6H12O6注射液含量实验的最合理条件:取质量分数为0.5%的C6H12O6注射液25.00 mL,加入0.01026 mol/L的 I2标准溶液25.00 mL后,以约每秒5滴至约每秒1滴且边滴边摇的速度加3.0~5.0 mL 2 mol/L NaOH溶液后,在暗处放置10~15 min后,加入5.0~7.0 mL 2 mol/L的HCl溶液,再用0.02017 mol/L的Na2S2O3标准溶液滴定,溶液呈浅黄色后,加入0.50~2.00 mL 0.5%的淀粉指示剂,继续用Na2S2O3标准溶液滴至蓝色刚好消失,实验数据重现性好,RSD≤0.2%,C6H12O6含量测定结果准确合理。
实验过程中,要完成这种条件实验分析的滴定分析实验误差,必须先掌握滴定分析的基本实验操作技术,包括称量、溶解、定容、移液、滴定等,还要掌握实验数据处理的一般方法及实验误差分析等知识。设计并完成条件实验后,可以通过条件实验数据对整个药品含量滴定实验进行实验条件分析,比较直观的分析出不同实验条件对药物含量测定结果影响的程度,进而更透彻的理解实验原理、把握实验关键点,提升综合分析处理实验数据的能力。实验过程中剖析关键点,设计合理的条件实验是关键,要求实验工作者深入研究并能准确预估不同的实验条件对实验结果可能的影响,最终通过分析条件实验数据得到最佳的实验条件,减小实验误差,提高药品含量测定结果的准确性。
