毛细管电泳法同时分析水、乳、膏类化妆品中5种有机酸
2019-06-24汪慧敏北京理工大学生命学院北京100081
汪慧敏, 孙 淼, 屈 锋(北京理工大学生命学院,北京 100081)
化妆品是重要的日化产品之一。随着生活水平的提高,人们对化妆品的使用越来越频繁,对其质量要求也越来越高。小分子有机酸是化妆品的重要成分之一。它通过渗透至皮肤角质层,使老化角质层中的细胞键合力减弱,加快细胞更新速度,促进死亡细胞脱离,从而使皮肤表面光滑、细嫩、柔软。小分子有机酸具有防皱、抗衰老的作用[1],但超量使用含有机酸类的化妆品,可能会减弱皮肤对紫外线的抵抗力,导致皮肤老化,发红、起泡乃至灼伤,加速对皮肤细胞的破坏,造成对皮肤的永久性伤害[2-4]。世界各国对化妆品中的有机酸添加都有含量限定。我国对化妆品中有机酸的含量检测是化妆品卫生管理的一项重要指标,规定:α-羟基酸(酒石酸、乳酸、苹果酸、乙醇酸、柠檬酸)含量不得大于6%(质量分数);防腐剂甲酸的最大允许量为0.5%(质量分数)[5]。
《化妆品安全技术规范》(2015年版)中有机酸的检测方法有离子色谱法(IC)、高效液相色谱法(HPLC)和气相色谱法(GC)。IC采用电导检测,需要特殊的抑制器,且色谱柱昂贵、使用寿命短[6];HPLC在pH 2.45的条件下对较强极性的5种有机酸的保留及分离能力有限,与杂质分离不好,检测易受基体干扰[7];GC分析有机酸样品需要进行15 min柱前衍生处理[8],衍生步骤繁琐且重现性低。《化妆品安全技术规范》中使用上述3种方法对化妆品中有机酸的检测,分别需要11、13、18 min[5]。
毛细管电泳法(CE)分辨率高、分析速度快[9]、试剂用量少[10]、操作简单[11,12],已经应用于食品[13]、葡萄酒[14]、益生菌[15]、醋[16]、啤酒[17]、木材[18]、植物[19]、纤梭杆菌发酵液[20]、尿液[21]、中药[22]中有机酸的检测。Liu等[23]建立的毛细管电泳法可在10 min内检测美白亮肤凝胶、去角质清洁剂中乳酸、苹果酸、酒石酸、乙醇酸、柠檬酸、扁桃酸、水杨酸等7种有机酸。但该法需要使用环糊精修饰毛细管,操作较复杂,方法的重现性较低,如苹果酸峰面积的RSD为8.21%,柠檬酸峰面积的RSD为6.48%。Dutra等[24]建立的毛细管电泳间接紫外检测方法成功检测出巴西圣保罗区市售5种化妆品中的酒石酸、乙醇酸、乳酸等3种有机酸。其他采用毛细管电泳法分析化妆品中有机酸的报道不多。
本文针对我国市售的水、乳、膏状3类化妆品,建立了毛细管电泳间接紫外检测方法。可在6 min内完成甲酸、苹果酸、柠檬酸、乙醇酸、乳酸5种常见有机酸的同时检测。该方法不仅操作简单、节省样品,且比规范中所用3种色谱方法省时5~12 min,较报道的毛细管电泳法检测化妆品中有机酸[23,24]用时更短,可同时检测的有机酸种类更多,将该法用于水状、乳状、膏状3种化妆品中有机酸的检测,可满足分析检测需求,有望成为化妆品中有机酸色谱分析检测方法的替代和补充。
1 实验部分
1.1 仪器与试剂
Agilent 7100型毛细管电泳仪(安捷伦科技公司)、KQ2200DA型数控超声波清洗器(昆山市超声仪器有限公司)、冷冻高速离心机(ThermoFisher Scientific公司)、高速振荡器(海门市其林贝尔仪器制造有限公司)等。甲酸(纯度≥99.0%)、苹果酸(纯度≥99.0%)、柠檬酸(纯度≥99.0%)、乙醇酸(纯度≥99.5%)、乳酸(纯度≥99.0%),购于北京化工厂;邻苯二甲酸氢钾(纯度≥99.8%,北京百灵威科技有限公司),十四烷基三甲基溴化铵(TTAB,纯度≥99.5%,梯希爱(上海)化成工业发展有限公司),超纯水。
1.2 背景电解质溶液和标准样品的配制
毛细管电泳的背景吸收电解质溶液为15 mmol/L邻苯二甲酸氢钾(含0.4 mmol/L TTAB)组成,用氢氧化钠调节pH为5.6。所有电解质溶液使用前用0.45 μm的滤膜过滤,常温保存。
用超纯水分别配制0.500 mol/L甲酸、苹果酸、柠檬酸、乙醇酸,5.000 mol/L乳酸作为标准样品的储备液,于常温保存。
1.3 毛细管电泳分析条件
毛细管电泳分离条件:熔融毛细管(有效长度/总长度:48.5 cm/57 cm,内径:75 μm);进样压力5 kPa;进样时间5 s;分离电压:-15 kV;检测波长:254 nm;分离温度:25 ℃。
新毛细管在使用前,分别用1 mol/L NaOH、0.1 mol/L NaOH和H2O各冲洗30 min。两次实验进样间用0.1 mol/L NaOH、H2O和背景电解质溶液各冲洗3 min。更换背景电解质溶液时,以0.1 mol/L NaOH溶液、H2O和背景电解质溶液各冲洗5 min。毛细管不用时水封,于室温下保存。
1.4 样品前处理
实验所用爽肤水、保湿乳、护手膏样品购于北京某商场。称取爽肤水样品1.000 0 g于2 mL离心管中,加纯水稀释至2 mL后进样;分别称取1.000 0 g保湿乳和护手膏样品于50 mL离心管中,加0.5 mL 20%(v/v)甲醇助溶。再用纯水稀释至50 mL,超声30 min,于高速离心机上离心20 min(12 000 r/min),取上清液用于样品分析。
2 结果与讨论
2.1 毛细管电泳分析方法的建立
在CE模式中,有机酸作为阴离子,其电泳方向与电渗流方向相反,其迁移速率较慢,分离效率降低。为加快阴离子迁移速率,通常在溶液中加入阳离子表面活性剂TTAB作为电渗流改性剂[25]。因TTAB与毛细管管壁硅羟基产生静电吸引作用,以及另侧十四烷基疏水基团的疏水聚集作用,导致毛细管内壁呈正电荷性,从而改变电渗流方向,使Zeta电势为正[26]。因此,加入TTAB使电渗流反向,可加快有机酸阴离子的迁移速率,缩短有机酸检测时间[16]。所测有机酸在220 nm以上没有生色官能团[27],不能进行直接紫外检测,故采用间接紫外检测法。在电泳运行缓冲液中加入邻苯二甲酸氢钾,可提高背景吸收。当有机酸样品迁移通过检测窗口时,则背景信号减弱,呈现负峰,实现间接紫外检测。与直接紫外检测方法[28,29]相比,间接紫外检测用时更短,灵敏度更高[9,10,30,31]。本文针对所购爽肤水、保湿乳、护手膏中的有机酸分析,建立和优化了毛细管电泳间接紫外检测方法。
2.1.1阳离子表面活性剂浓度的影响
在阴离子分析时,通常采用的TTAB浓度为0.2 mmol/L[31]、0.25 mmol/L[32]、0.3 mmol/L[33]、0.5 mmol/L[34,35]和0.75 mmol/L[36]。我们比较了3种TTAB浓度(0.2、0.4、0.6 mmol/L )对有机酸分离的影响,从图1可以看出,当TTAB浓度为0.2 mmol/L和0.4 mmol/L时,5种有机酸均可实现完全的基线分离。但0.2 mmol/L时,乳酸(峰5)出峰后基线不平,似有干扰组分。当TTAB浓度为0.6 mmol/L时,未见苹果酸峰(峰2),且柠檬酸和乙醇酸(峰3和峰4)出峰时间相近,分离度降低;因此,采用0.4 mmol/L TTAB,此时5种有机酸的分离度最高,各峰检测无干扰,易于分析。
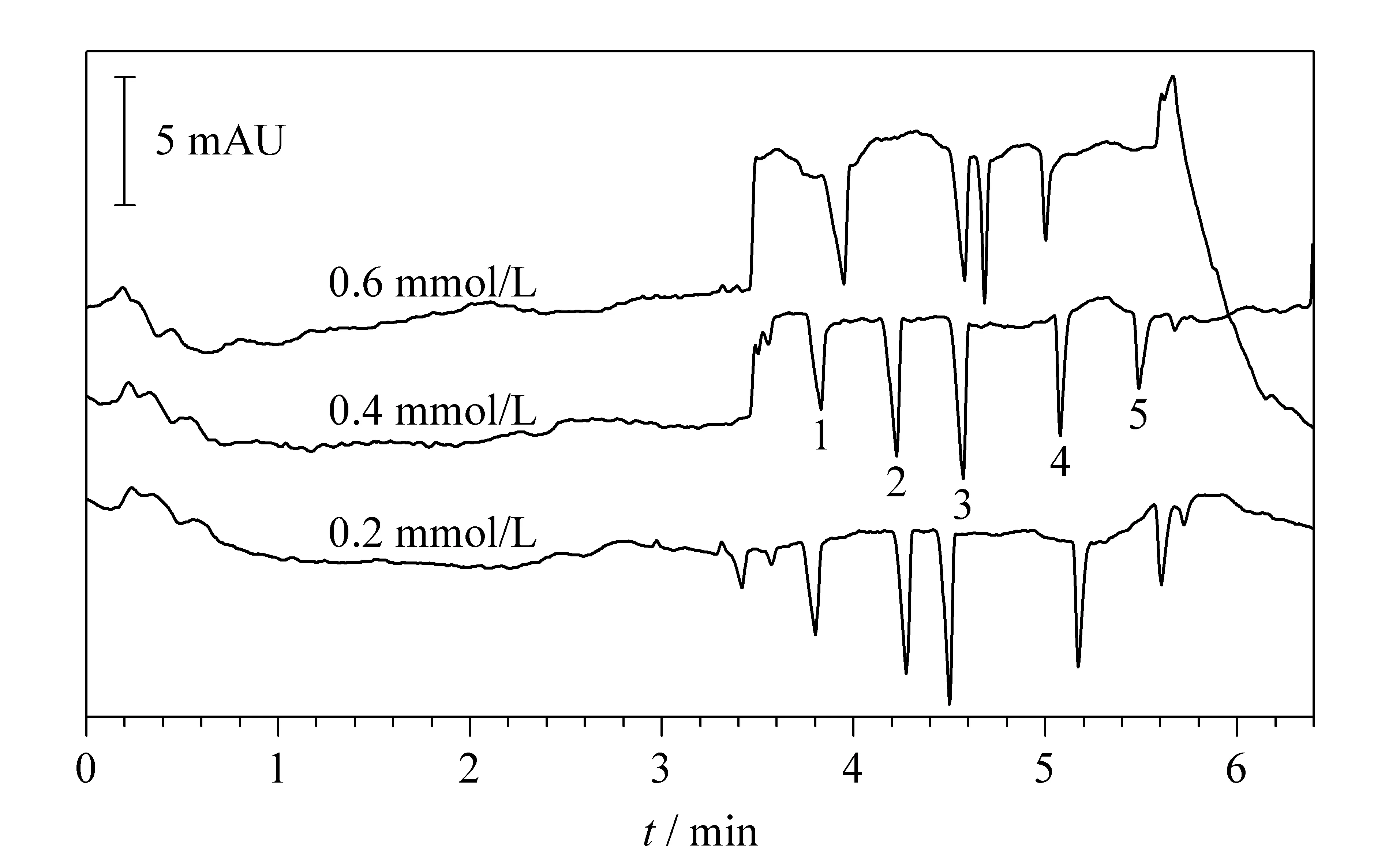
图1 阳离子表面活性剂TTAB浓度对有机酸分离的影响Fig.1 Effect of TTAB cationic surfactant concentrationson the separation of organic acids TTAB:tetradecyltrimethylammonium bromide. Peaks:1.formic acid;2.malic acid;3.citric acid;4.glycolic acid;5.lactic acid.
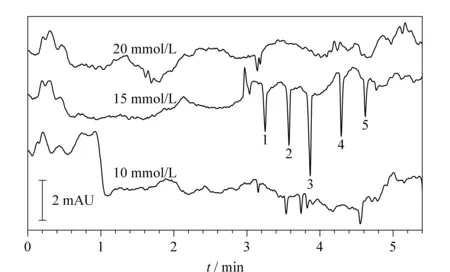
图2 背景电解质溶液中邻苯二甲酸氢钾浓度对有机酸分离的影响Fig.2 Effect of concentration of potassium acid phthalate background electrolyte on the separation of organic acids Peaks 1-5 are the same as in Fig.1.
2.1.2背景电解质浓度的影响
考察背景电解质溶液中邻苯二甲酸氢钾的浓度(10、15、20 mmol/L)对有机酸分析检测的影响。如图2所示,使用10 mmol/L和20 mmol/L邻苯二甲酸氢钾时,5种有机酸难以检测,也无法定量分析。使用15 mmol/L邻苯二甲酸氢钾时,5种有机酸可在5 min内出峰,且分离度良好,基线较平稳。
2.1.3背景电解质pH的影响
毛细管电泳利用分析物的迁移率不同实现分离。迁移率的大小主要依赖于分析物的荷质比。分析物在溶液中的带电荷数由分析物的pKa和溶液的pH决定。理论上,pKa与pH差异越大,分析物的离子化程度越高,电荷数越多,迁移时间越快。本研究中,甲酸、乙醇酸、乳酸均为一元羧酸,其相对分子质量相近,实际迁移顺序与其pKa大小顺序一致;而苹果酸和柠檬酸为二元和三元羧酸,其相对分子质量也明显大于前3种有机酸,故实际迁移顺序与其pKa大小顺序不完全相符。5种有机酸的pKa值在3~6之间(甲酸:pKa=3.75;苹果酸:pKa1=3.40,pKa2=5.11;柠檬酸:pKa1=3.14,pKa2=4.77,pKa3=5.40[33];乙醇酸:pKa=3.83;乳酸:pKa=3.86[25]),故缓冲溶液的pH也选在这一范围内。考察了pH 4.0、5.0、5.6的背景电解质溶液对5种有机酸同时分析的影响。如图3所示,当pH为4.0和5.0时,柠檬酸峰(峰3)出现裂峰,且pH 4.0时乙醇酸峰(峰4)后基线不平,乳酸峰(峰5)出峰很小。而当pH为5.6时,5种有机酸均可实现基线分离。因此选择pH 5.6的背景电解质溶液进行后续实验。

图3 背景电解质溶液pH对有机酸分离的影响Fig.3 Effect of background electrolyte solution pH on the separation of organic acids Peaks 1-5 are the same as in Fig.1.

表1 5种有机酸的线性范围、线性方程、相关系数及检出限Table 1 Linear ranges,linear equations,correlation coefficients (R2)and limits of detection(LODs)of the five organic acids
y:peak area;x:mass concentration,mg/L.
2.2 方法的线性范围、线性方程和检出限
在上述优化条件下,以有机酸质量浓度为横坐标,峰面积为纵坐标进行线性拟合,5种有机酸的线性范围、线性方程和相关系数见表1。不断稀释样品溶液,至样品溶液的信号强度为噪声的3倍,将此时样品溶液中有机酸的含量确认为检出限,结果见表1。在《化妆品安全技术规范》中,甲酸的检测方法是HPLC和GC。其中,HPLC的检出限为1 μg/g,但未给出GC的检出限。苹果酸、柠檬酸、乙醇酸、乳酸4种有机酸使用的检测方法是IC、HPLC和GC。其中,离子色谱的检出限最低,4种有机酸的检出限均在1.66~3.4 ng/g之间;HPLC次之,在0.2~0.4 μg/g之间;也未给出GC的检出限。
本文方法测得的甲酸检出限比《化妆品安全技术规范》中HPLC低,而苹果酸、柠檬酸、乙醇酸、乳酸与《化妆品安全技术规范》中HPLC的检出限在同一数量级。本方法的检出限可满足《化妆品安全技术规范》中的要求。
2.3 化妆品中有机酸的加标回收率和检测精密度
取化妆品样品溶液一份,均分成4份。1份用于直接测定,另外3份溶液中分别添加低(5种有机酸终浓度均为50 mg/L)、中(5种有机酸终浓度均为100 mg/L)、高(5种有机酸终浓度均为200 mg/L)3个水平的5种有机酸混合标准溶液,考察样品检测的回收率。每个水平的样品平行测定3次,所得检测结果见表2。在50、100、200 mg/L 3个加标水平下,样品分析的回收率均在95.0%~101.6%之间,且RSD均在2.0%以内,验证了方法良好的准确性和精密度。

表2 样品中5种有机酸的加标回收率和精密度(n=5)Table 2 Recoveries and precisions of the five organic acids spiked in samples (n=5)
ND:not detected.
2.4 供试样品中5种有机酸含量的检测
购买北京市场所售5种实际样品,测得5种有机酸的含量见表3。检测结果表明,市场所售A样品中柠檬酸含量为0.02%;B样品中乙醇酸含量为0.01%;C样品中柠檬酸含量为0.02%,乳酸含量为0.17%;D样品中乳酸含量为0.23%;E样品中乳酸含量为0.18%。5种实际样品中所测有机酸含量均低于6%,符合《化妆品安全技术规范》(2015年版)的相关要求。

表3 化妆品中5种有机酸的含量Table 3 Contents of the five organic acids in cosmetics
3 总结
本文发展了针对爽肤水、保湿乳和护手膏3类化妆品中有机酸分析的毛细管电泳间接紫外检测方法。该法操作简单、分析快速、无需使用有机试剂,可用于3类化妆品中5种常用有机酸的分析检测,并有望用于化妆品生产和保存过程中的质量监测。
