枯草杆菌芽孢皮层裂解酶的分离纯化以及酶学结构分析
2019-06-24曾朝玮马慧娇郭家俊郭洪伟
曾朝玮,孙 静,马慧娇,郭家俊,郭洪伟,章 中
(宁夏大学农学院,宁夏银川 750021)
芽孢是某些细菌在生长发育到一定阶段后,在其细胞内形成一个圆形或椭圆形的休眠体,对杀菌处理具有极端抗性,是引起食品安全问题和食品腐败的原因之一[1-5]。芽孢萌发后其极端抗性消失。芽孢皮层裂解酶是芽孢内唯一水解芽孢皮层肽聚糖的酶[6],芽孢萌发过程中皮层裂解酶被激活并将芽孢皮层水解可致使芽孢核心完全水化。许多因素都能诱导芽孢萌发,如溶菌酶、十二烷胺等阳离子表面活性剂、嘌呤核苷类物质、氨基酸、葡萄糖、细胞壁碎片等等[7-8]。
高压热杀菌技术(HPTS)将超高压和温度协同起来,能有效杀灭细菌芽孢,并有利于保持食品的风味、颜色、质地以及营养价值[9-12],但是HPTS杀灭芽孢的机理尚不明确。有报道推测在一定的压力和温度条件下,皮层裂解酶可能被激活,导致芽孢皮层肽聚糖水解,进而使得芽孢结构被破坏而死亡[13]。因此,研究HPTS对芽孢皮层裂解酶的作用具有重要意义,而要研究HPTS是否能激活芽孢皮层裂解酶,首先要从枯草芽孢杆菌皮层裂解酶粗酶液中分离纯化出皮层裂解酶,然后对皮层裂解酶进行HPTS处理,阐明HPTS对皮层裂解酶活性和结构的影响,进而揭示HPTS杀灭芽孢的机理。微生物酶常见的分离纯化方法有盐析、离子交换层析、凝胶过滤、疏水层析和亲和层析[14]。单一的分离方法难以达到理想的分离效果,因此往往需要两种或两种以上的分离方法才能达到分离纯化的目的,而分离次序的选择又影响最大纯化倍数和和回收率以及酶活力。
本实验采用透析法、硫酸铵分级沉淀、SP-sephadex C-25离子交换层析及Superdex 75凝胶过滤层析对皮层裂解酶进行分离纯化,并在每一步纯化操作结束后对皮层裂解酶的活性及总蛋白含量进行测定,使用SDS-PAGE电泳分析测定其分子量,建立适用于分离纯化枯草杆菌芽孢皮层裂解酶的实验条件,为研究HPTS对皮层裂解酶的作用提供实验材料。
1 材料与方法
1.1 材料与仪器
枯草芽孢杆菌(Bacillussubtilis) 中国普通微生物菌种保藏管理中心(CGMCC),编号As 1.433;促芽孢生长锰盐营养琼脂培养基:向普通营养琼脂培养基中加入MnSO4·H2O(使得培养基中Mn2+的浓度为50 mg/L),调pH至7,灭菌,备用;30%丙烯酰胺溶液 北京雷根生物科技有限公司;pH=8.8的4×Tris/SDS分离胶缓冲液,pH=6.8的4×Tris/SDS浓缩胶缓冲液 上海双螺旋生物科技有限公司;2,6-吡啶二羧酸(DPA) 分析纯,美国Sigma公司;透析液:1 mmol/L的乙二胺四乙酸(EDTA)、1 mmol/L的巯基乙酸钠的磷酸钠缓冲液(浓度75 mmol/L、pH=7.0);L-丙氨酸、肌苷 上海瑞永生物科技有限公司;TEMED、甘氨酸 北京博奥拓达科技有限公司;宽范围预染蛋白质分子量标准 美国Thermo Scientific;牛血清白蛋白 北京酷尔化学科技有限公司;SP-sephadex C-25、Superdex 75 GE生命科学;考马斯亮蓝R-250 上海翊圣生物科技有限公司;5×蛋白质电泳缓冲液:Tris 15.1 g,甘氨酸94 g,SDS 5 g,用蒸馏水定容至1000 mL,使用时用蒸馏水稀释5倍;其它化学试剂 均为分析纯,天津市大茂化学试剂厂。
DYCZ-24DN型电泳槽 北京六一生物科技有限公司;DYY-6C型电泳仪电源 北京市六一仪器厂;XH-T型涡旋混合器 金坛区金城硕华仪器厂;DHL-B型电脑恒流泵 上海青浦沪西仪器厂;BS-100N型自动部分收集器 上海青浦沪西仪器厂;TH-1000A型梯度混合器 上海青浦沪西仪器厂;UV-2450型紫外可见分光光度计 日本岛津公司;Agilent 1100型HPLC色谱仪及数据处理平台 美国Agilent公司;970CRT型荧光分光光度计 杭州汇尔仪器公司;Welch Ultimate AQ-C18色谱柱(250 mm×4.6 mm,5 μm) 美国Welch公司;Spectrum Two型傅里叶变换红外光谱仪 美国PerkinElmer公司。
1.2 实验方法
1.2.1 芽孢悬浮液的制备 芽孢的制备参照Gao等[15]的方法,将活化(挑一环菌液在灭菌后的营养琼脂试管斜面上进行划线培养,37 ℃条件下培养7 d,重复3次)的枯草芽孢杆菌接入营养琼脂培养基,在灭菌后的营养琼脂试管斜面上进行划线培养,在37 ℃条件下恒温培养7 d,将试管斜面上的芽孢用无菌去离子水振荡洗涤下来,收集到离心管里,然后用无菌去离子水离心洗涤(4 ℃、8000 r/min、15 min)芽孢3次,洗涤后的芽孢重悬在无菌去离子水中,离心浓缩(8000 r/min、15 min),测定吸光度,调节芽孢浓度约为1.5×109CFU/mL,4 ℃保存,一个月内使用。每次使用前要将芽孢用无菌去离子水再次洗涤(4 ℃、8000 r/min、15 min)。
1.2.2 枯草杆菌芽孢萌发处理 萌发处理参照Miyata等[16]和Makino等[17]的方法。将枯草杆菌芽孢悬浮液(0.1 g/mL)在65 ℃下热激活45 min,然后在冰水浴中冷却至室温,再经离心(8000 r/min、4 ℃、15 min)沉淀后,将芽孢置于10倍体积的、pH=7.0的、30 mmol/L的磷酸钠缓冲液中,于32 ℃下萌发,磷酸钠缓冲液中含有10 mmol/L的L-丙氨酸和4 mmol/L的肌苷。
1.2.3 芽孢皮层裂解酶粗酶液的提取 参照Gombas等[18]和Makino等[17]的方法提取芽孢皮层裂解酶粗酶液,并对该方法稍作修改,芽孢萌发后,进行离心处理(8000 r/min,4 ℃,15 min),将上清粗酶液移入8000 Da的透析袋中于4 ℃冰箱中透析48 h,期间24 h更换一次透析液。
1.2.4 芽孢皮层裂解酶粗酶液DPA测定 使用RP-HPLC法检测DPA。DPA检测参照Fichtel等[20]的方法。使用C18柱(250 mm×4.6 mm,5 μm)进行检测,柱温设定为30 ℃,进样量为10 μL,洗脱条件为20%的甲醇和80%浓度为50 mmol/L的磷酸氢钠溶液,pH=2.5,流速为1.0 mL/min。
1.2.5 脱芽孢衣芽孢的制备 脱芽孢衣芽孢的制备是通过对Gombas等[18]和Makino等[17]的方法稍作修改而完成的,用pH为10.0,浓度为0.1 mol/L的硼酸盐缓冲液在40 ℃处理枯草芽孢杆菌芽孢,缓冲液中含有30 mmol/L十二烷基硫酸钠、0.2 mol/L 2-巯基乙醇,8 h后再用蒸馏水离心(8000 r/min,4 ℃,15 min)洗涤干净。
1.2.6 芽孢皮层裂解酶活性测定 酶活性分析方法参照Makino等[17]和Miyata等[16]的方法,皮层裂解酶可以水解芽孢皮层肽聚糖,具有专一性,芽孢皮层肽聚糖被水解后,会导致脱芽孢衣芽孢悬浮液OD600值显著下降,酶活性越高,OD600值下降的程度则越大,因此脱芽孢衣芽孢悬浮液OD600值的变化可用于评价皮层裂解酶的活性。酶活性单位定义参考周磊等[19]的方法,并做了部分修改。在32 ℃下,向4 mL透析后的皮层裂解酶中加入1 mL浓度为1.5×107CFU/mL的脱芽孢衣芽孢悬浮液,反应酶液包含0.05 mol/L磷酸钠缓冲液、1 mmol/L的EDTA和1 mmol/L的巯基乙酸钠,pH为7.0。对照组为4 mL无菌水中加入1 mL浓度为1.5×107CFU/mL的脱芽孢衣芽孢悬浮液,酶的活性通过脱芽孢衣芽孢悬浮液的OD600值的减少量来测定。每分钟OD600值降低0.001所需的酶量为一个活性单位。根据以下公式计算酶活:
式中:X为酶活(U/L),V为参与反应的酶量(mL),t为反应时间(min)。
1.2.7 蛋白质浓度的测定 牛血清蛋白(BSA)标准曲线的制作。配制1 mg/mL的BSA标准溶液(准确称取100 mg牛血清蛋白,用20 mmol/L、pH=6.5的磷酸缓冲溶液定容至100 mL),取7支试管,依次加入0、20、40、60、80、100和120 μL的BSA标准溶液,然后用磷酸缓冲液将各管中蛋白母液体积补充至1 mL,再向各管中加入2.5 mL考马斯亮蓝染色液,涡旋振荡混匀,室温放置2 min后在595 nm下测定吸光度值,以标准蛋白浓度为横坐标,以吸光度值为纵坐标进行线性回归,并得出回归方程。
1.2.8 芽孢皮层裂解酶粗酶液的分离纯化
1.2.8.1 硫酸铵分级沉淀 硫酸铵分级沉淀参照文献[21-22]的方法,分别将粗酶液中硫酸铵饱和度调节为20%、30%、40%、50%、60%、70%、80%,在加入硫酸铵时,为防止硫酸铵局部浓度过高,要边加边进行混匀,加完后继续涡旋振荡混匀20 min,以使硫酸铵充分溶解;于4 ℃冰箱中静置12 h后冷冻离心(8000 r/min,30 min),将沉淀收集并溶解于磷酸钠缓冲液中,测定各饱和度下皮层裂解酶活力和蛋白含量,得到酶活力较高的区间。
1.2.8.2 SP-sephadex C-25离子交换层析 参照Makino等[17]和Ando等[23]的方法,并作相应的修改,经硫酸铵分级沉淀处理后的酶液经脱盐浓缩后用SP-sephadex C-25柱(1.5 cm×15 cm)处理,首先要将该柱进行平衡,平衡条件为:用250 mL、75 mmol/L、pH=7.0的磷酸钠缓冲液进行平衡,缓冲液中含有1 mmol/L的EDTA、1 mmol/L的巯基乙酸钠(缓冲液A),流速为1.5 mL/min;平衡后上样,再用洗脱液在常温下洗脱,洗脱条件为:用含有线性梯度NaCl(洗脱过程中NaCl浓度由0逐渐增大至1.2 mol/L)的缓冲液A进行洗脱,洗脱速度控制在0.5 mL/min。洗脱结束后在220 nm下测定各管洗脱液的吸光度值,将含有皮层裂解酶的组分收集起来。
1.2.8.3 Superdex 75凝胶过滤洗脱 将收集起来的皮层裂解酶进行脱盐浓缩,立即用Superdex 75凝胶柱(2.6 cm×15 cm)在常温处理。首先要将该柱进行平衡,平衡条件为:先用250 mL缓冲液A平衡,再用150 mL、含0.4 mol/L氯化钠的缓冲液A进行平衡处理,流速均为1.5 mL/min;平衡后的柱子在常温下放置1 h后进行上样、洗脱,洗脱条件为:用200 mL含有0.2 mol/L氯化钠的缓冲液A进行洗脱以分离出皮层裂解酶,洗脱速度控制在0.5 mL/min。洗脱结束后,各组分(每管3.5 mL)被收集起来并在220 nm下测定各管洗脱液的吸光度值,将含有皮层裂解酶的组分收集起来,于4 ℃透析处理24 h,透析对照液为1 L的75 mmol/L的、pH=6.5的磷酸钠缓冲液(缓冲液B)。
1.2.9 芽孢皮层裂解酶SDS-PAGE凝胶电泳 SDS-PAGE参考郭尧君等[24]的方法。选择10%的分离胶及5%的浓缩胶进行实验,上样量为10 μL。电泳过程中,样品在浓缩胶中时调节电压为75 V,样品迁移至分离胶中调节电压为120 V,当样品条带迁移至距凝胶底端1 cm左右时,停止电泳,取出凝胶板,然后对分离胶进行过夜染色(考马斯亮蓝R-250 1 g,乙醇45%,冰乙酸10%,加水定容至1000 mL,过滤后使用),之后用水将凝胶漂洗几遍,用脱色液(冰乙酸10%,乙醇30%)进行脱色,每3 h换一次脱色液,脱色至能清楚显示出蛋白条带为止。

表1 10%分离胶和5%的浓缩胶的配制Table 1 Preparation of 10% separation glue and 5% concentrated glue
1.2.10 枯草杆菌皮层裂解酶的结构分析
1.2.10.1 样品制备 将分离纯化出的皮层裂解酶(酶液中磷酸钠浓度为0.05 mol/L)使用10 kDa的超滤离心管进行浓缩、脱盐。然后将皮层裂解酶样品进行真空冷冻干燥成粉末状,放在4 ℃冰箱保存。
1.2.10.2 枯草杆菌皮层裂解酶的傅里叶红外光谱扫描及图谱分析 采用傅立叶变换红外光谱仪对皮层裂解酶进行光谱采集。称取2 mg的样品在玛瑙研钵中磨成细粉,再与干燥的溴化钾粉末(100 mg,粒度200目)混合均匀,装入模具内,在压片机上压制成片测试。测定样品在4000~400 cm-1波谱数的吸收光谱,扫描温度为(35±0.2) ℃,分辨率为4 cm-1。图谱处理参考Byler等[25]的方法。利用PeakFitv4.12软件在谱带范围内(酰胺Ⅰ带1600~1700 cm-1)校正基线,然后用Gaussian去卷积,做二阶导数拟合,多次拟合使残差最小。根据峰的面积,计算出枯草杆菌芽孢皮层裂解酶的二级结构含量。
1.3 数据处理
所有实验都重复3次,实验结果均以平均值±标准差表示。用SPSS 20.0软件对实验结果进行统计分析,用Origin 8.0软件进行作图。
2 结果与分析
2.1 芽孢皮层裂解酶粗酶液DPA测定
芽孢萌发的关键是芽孢内源DPA的释放,而皮层裂解酶能诱导脱芽孢衣芽胞萌发并释放DPA[1]。为确定所提取到的粗酶液中确实含有皮层裂解酶,将皮层裂解酶粗酶液与脱芽孢衣芽孢悬浮液混合,然后将样品混合液进行RP-HPLC分析。结果如图1所示,由图1可以看出,DPA标准溶液的出峰时间为4.64 min,样品混合液在4.65 min时有峰出现,这个出峰时间与DPA的出峰时间相符,说明脱芽孢衣芽孢被皮层裂解酶诱导萌发,并且释放出了DPA。

图1 反相高效液相色谱图。Fig.1 Reversed-phase high performance liquid chromatography 注:(a)DPA标液;(b)样品混合液。
2.2 芽孢皮层裂解酶粗酶液硫酸铵分级沉淀试验
根据实验结果绘制牛血清蛋白标准曲线,结果如图2,并根据标准曲线方程:y=8.457x-0.003,计算出经硫酸铵盐析所得沉淀的蛋白浓度,再对各硫酸铵浓度下所沉淀出的皮层裂解酶活力进行测定,结果如图3所示。从图3中可以看出,随着硫酸铵浓度的不断增大,总蛋白含量和皮层裂解酶活力都逐渐增大,使用40%的硫酸铵进行沉淀时,总蛋白浓度为0.075 mg/mL,酶活为102.08 U/L;当硫酸铵浓度增大至60%时,此时大部分皮层裂解酶被聚集沉淀下来,总蛋白浓度(0.086 mg/mL)及皮层裂解酶活力(292.71 U/L)都达到最大值。继续增大硫酸铵饱和度至70%、80%时,酶活力均有所降低,蛋白浓度有所降低,说明在此饱和度下所沉淀下来的蛋白大部分为杂蛋白。为尽可能减少杂蛋白对实验结果造成干扰以及简化后期的分离工作,本实验选取40%~60%硫酸铵饱和度用于皮层裂解酶的分离纯化。

图2 牛血清蛋白标准曲线Fig.2 Standard curve of bovine serum

图3 芽孢皮层裂解酶粗酶液硫酸铵分级沉淀Fig.3 Ammonium sulfate fractionation precipitation of the crude cortex-lytic enzyme
2.3 枯草杆菌芽孢皮层裂解酶粗酶液SP-sephadex C-25离子交换层析
枯草杆菌芽孢皮层裂解酶经硫酸铵分级沉淀后,再经SP-sephadex C-25离子交换层析,对皮层裂解酶的洗脱结果进行作图。结果如图4所示,图中峰1为NaCl浓度在0.1~0.2 mol/L时所出现的洗脱峰,经皮层裂解酶活性测定,OD600处吸光度值下降,确定该峰为目的蛋白峰。峰2为NaCl浓度在0.3~0.4 mol/L时所出现的洗脱峰,经检测确定该峰为杂蛋白峰。将酶活性较高的几管收集起来进行超滤离心,对收集到的皮层裂解酶进行脱盐浓缩,最终将酶液浓缩至4 mL左右。对该纯化步骤前后的皮层裂解酶进行SDS-PAGE检测,结果见图5。

图4 皮层裂解酶SP-sephadex C-25离子交换层析图Fig.4 Elution curve of cortex-lytic enzyme by SP-sephadex C-25 chromatography注:a.NaCl洗脱浓度;b.枯草杆菌皮层裂解酶随NaCl洗脱浓度变化曲线。
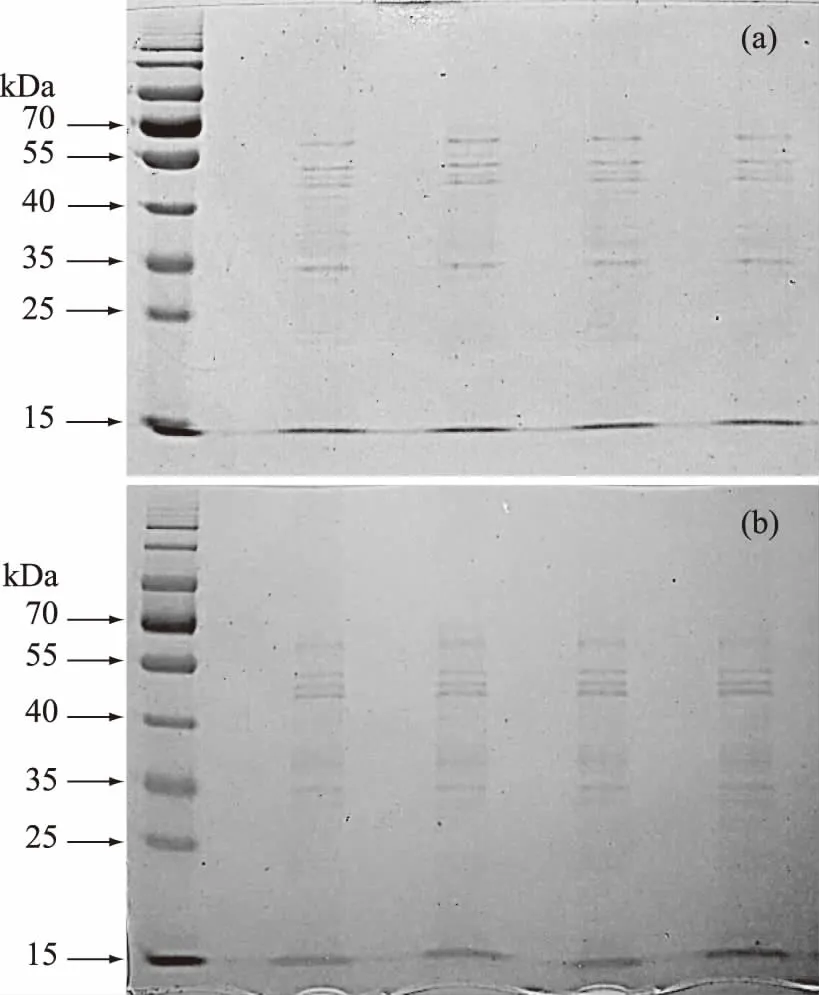
图5 皮层裂解酶SDS-PAGE图Fig.5 SDS-PAGE electrophoresis of spore cortex-lytic enzymes注:(a)未经纯化的皮层裂解酶;(b)经SP-sephadexC-25离子交换层析的皮层裂解酶。
如图5所示为皮层裂解酶SDS-PAGE图,且每个泳道均为15 μL的枯草杆菌皮层裂解酶粗酶液。由图5(a)可见,未经SP-sephadex C-25离子交换层析的皮层裂解酶中杂蛋白种类很多,而且很多杂蛋白较为密集,且分子量大小较为相似,而经SP-sephadex C-25离子交换柱层析后的皮层裂解酶粗酶液中大部分杂蛋白被分离,但是目的蛋白里面仍有一些杂蛋白条带,说明这些杂蛋白与目的蛋白的离子强度相近,使用离子交换柱无法将其完全分离。但从图5(b)可以看出,经SP-sephadex C-25离子交换柱层析纯化后,各蛋白条带的分子量差异明显,因此选择Superdex 75凝胶过滤法,根据蛋白质分子量的大小对酶液进一步纯化。
2.4 枯草杆菌芽孢皮层裂解酶粗酶液Superdex 75凝胶过滤
由图6看出,经SP-sephadex C-25离子交换层析后的酶液再经过Sephadex 75凝胶柱后,出现了许多蛋白峰,但主要获得的有3个蛋白峰,分别收集这3个蛋白峰并进行酶活测定,结果发现峰1和峰3均为杂蛋白峰,峰2为目的蛋白峰。将22~29管的酶液收集起来,通过使用10 kDa的超滤浓缩管,对洗脱下来的酶液进行脱盐浓缩。浓缩后使用SDS-PAGE再次进行纯度测定,结果如图7。
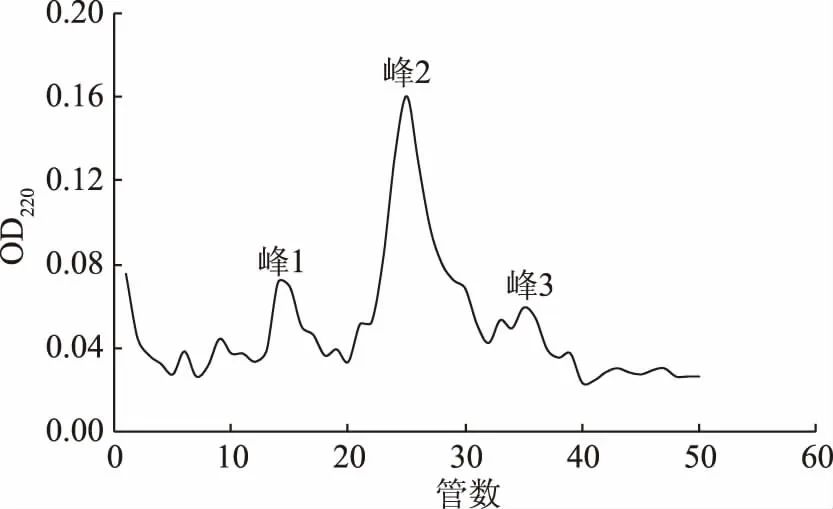
图6 皮层裂解酶Superdex 75凝胶过滤洗脱图Fig.6 Superdex 75 gel filtration eluting diagram of cortex-lytic enzyme

图7 纯化后的皮层裂解酶SDS-PAGE图Fig.7 SDS-PAGE electrophoresis of the purified cortex-lytic enzymes
由电泳图7可以看出,在凝胶板上显示一条蛋白条带,分子量为61.10 kDa。说明经过透析、硫酸铵沉淀、SP-sephadex C-25离子交换层析及Superdex 75凝胶过滤层析纯化手段之后,很好地将目的蛋白酶与杂蛋白酶进行了分离。最终获得了达到电泳纯的皮层裂解酶。
在经过一系列的分离纯化操作后,得到了纯度较高的芽孢皮层裂解酶,分别测定各个纯化操作步骤的总蛋白含量和总酶活力,对各纯化过程的比酶活力、纯化倍数和回收率进行计算,得到相关参数来对纯化过程的效果进行评价,结果如表2所示。可以看出,芽孢皮层裂解酶粗酶液经硫酸铵沉淀后,比酶活力为158.22 U/mg;经SP-sephadex C-25离子交换层析后,比酶活力为218.31 U/mg;经Superdex 75凝胶过滤层析纯化后,比酶活力可达1690.75 U/mg,可以看出纯化过程中比酶活力逐渐增大。而总酶活力由最初的347.74 U/L降低到67.63 U/L,这是因为在纯化过程中,洗脱液的pH、洗脱温度以及洗脱液的选择都会对皮层裂解酶活性造成影响,而且随着时间的延长,皮层裂解酶活性会有一些降低,这些因素最终导致了皮层裂解酶总活力在每步洗脱过程中都会有所降低。最终经Superdex 75得到的纯化倍数和回收率分别为14.98倍和19.45%。皮层裂解酶粗酶液经过一系列分离纯化操作后,其纯化倍数和比酶活力均得到了较大程度的提高,可为后续的相关研究提供高纯度、活性强的皮层裂解酶。

表2 皮层裂解酶纯化过程相关参数Table 2 Parameters during the purification of spore cortex-lytic enzymes
2.5 皮层裂解酶结构的傅里叶红外光谱分析
N-H伸缩振动的吸收峰在3400~3440cm-1出现,它与氢键缔合后,向低波数发生位移[26]。由图8可以看出,枯草杆菌皮层裂解酶在3415 cm-1处有一个强吸收峰,这是由蛋白质中N-H伸缩振动引起,N-H伸缩振动与氢键形成了缔合体,向低波数发生位移。枯草杆菌芽孢皮层裂解酶在1665、1080、528 cm-1波数处均有吸收峰,1665 cm-1处的吸收峰是蛋白质的特征吸收峰,归属于酰胺Ⅰ带的C=O伸缩振动引起,1080 cm-1处的吸收峰是由蛋白质中C-O伸缩振动引起的。而528 cm-1处的吸收峰是由氨基酸的COO面外摇摆振动引起的[27]。

图8 皮层裂解酶的傅里叶红外光谱图Fig.8 FTIR of cortex-lytic enzymes
蛋白质在红外区有若干特征吸收带,酰胺Ⅰ带(1600~1700 cm-1)对于研究蛋白质的二级结构最有价值。应用二阶导数和曲线拟合的方法对枯草杆菌芽孢皮层裂解酶酰胺Ⅰ带(1600~1700 cm-1)曲线拟合,共有10个子带谱峰。主要有如下特征峰:1620、1629、1637、1646、1655、1663、1671、1679、1688 cm-1。除了1611 cm-1峰是由氨基酸残基侧链或苯环振动引起的,其余各峰都归因于蛋白质羰基的振动吸收[28]。参照Byler等[29]的研究结果,将子带谱峰进行如下归属:1620、1629、1637 cm-1峰指认为β-折叠,1655 cm-1峰指认为α-螺旋结构,1646 cm-1峰指认为无规卷曲,1663、1671、1679、1688 cm-1峰指认为β-转角。通过计算得出,枯草杆菌皮层裂解酶的α-螺旋、β-折叠、β-转角、无规卷曲的含量分别为12.80%、31.56%、44.97%、10.68%。

图9 皮层裂解酶酰胺Ⅰ带曲线拟合谱图Fig.9 Fitting curve of amideⅠband of cortex-lytic enzymes
3 结论
通过硫酸铵分级沉淀、离子交换层析和凝胶过滤层析的方法,成功分离纯化出了枯草杆菌芽孢皮层裂解酶。粗酶液的总酶活为347.74 U/L,回收率为100%;经硫酸铵分级沉淀后,总酶活为292.71 U/L,回收率为84.17%,经SP-sephadex C-25离子交换层析后的总酶活力为237.96 U/L,回收率为68.43%,最后使用Superdex 75凝胶过滤层析进行纯化,得到了电泳纯的皮层裂解酶并且总酶活力为67.63 U/L,回收率为19.45%。纯化后皮层裂解酶的比酶活力由112.90 U/mg增大至1690.75 U/mg,纯化出的皮层裂解酶分子量为61.1 kDa。运用傅里叶红外光谱(FTIR)对芽孢皮层裂解酶进行结构分析,在3415、1665、1080、528 cm-1波数处有吸收峰,其中在1665 cm-1处有明显的酰胺I带,枯草杆菌皮层裂解酶中含12.80%的α-螺旋、31.56%的β-折叠、44.97%的β-转角、以及10.68%的无规卷曲。本文成功纯化了枯草杆菌皮层裂解酶,为研究HPTS对皮层裂解酶的作用提供实验材料,进而有助于研究HPTS杀灭细菌芽孢的机理。
