雨生红球藻和小球藻间的原生质体融合与糖异养融合子筛选
2019-06-24徐晓莹史文凯袁冠华张文蕾崔玉琳刘天中
徐晓莹,史文凯,袁冠华,张文蕾,张 维,*,崔玉琳,刘天中
(1.中国科学院青岛生物能源与过程研究所,山东省能源生物遗传资源重点实验室,山东青岛 266101; 2.中国科学院大学,北京 100049; 3.烟台市水产研究所,山东烟台 264003; 4.中国科学院海岸带研究所,海岸带生物学与生物资源利用所重点实验室,山东烟台 264003)
天然虾青素是世界上最强的天然抗氧化剂[1],广泛应用于医药健康、水产养殖等行业。雨生红球藻是生产天然虾青素的最好生物材料,其含量可达干重的2.0%~5.0%,为自然界中虾青素含量最高的生物[2-4]。目前,雨生红球藻已实现规模化的养殖与虾青素的商业化生产,市场规模已达六亿美元,并正在以每年10%的速度快速增长。然而长期以来,雨生红球藻的养殖一直依赖于光合自养,生产受到地理、天气等自然环境条件的限制,同时由于雨生红球藻本身的特性,其生长极其缓慢,远不及小球藻、螺旋藻等经济微藻[5-6],因而目前规模化养殖效率不高。
除自养生长外,雨生红球藻也可以进行异养生长。乙酸(盐)是目前雨生红球藻已知的唯一能够有效利用的底物[7-10]。Hata等[11]和Wan等[12]均将乙酸盐异养发酵引入雨生红球藻的细胞培养过程,虾青素产率分别可达4.4和6.4 mg/L/d,但乙酸盐对藻细胞生长有明显的底物抑制,因此要建立基于乙酸盐的雨生红球藻异养发酵,必须严格控制培养过程中乙酸盐底物的浓度。在大多数微生物发酵中,葡萄糖是原料最为丰富、应用最广的有机碳底物。如果雨生红球藻能够利用葡萄糖底物进行高密度异养发酵,无疑将大大解决天然虾青素生产的稳定性、规模化和成本问题,促进天然虾青素产业的发展。因此向雨生红球藻中引入葡萄糖代谢途径以获得可利用葡萄糖的异养株,成为目前雨生红球藻技术研发的热点。
Zaslavskaia等[13]通过向三角褐指藻中引入功能的葡萄糖转运蛋白基因,成功使三角褐指藻获得了利用葡萄糖进行异养生长的能力,但在另外的研究如向团藻[14]和细柱藻[15]中引入该基因却未能使其发挥异养作用。对此有学者认为对于团藻和细柱藻等,藻类细胞本身可能缺失糖代谢过程的关键途径[16-17]。也有研究认为藻类无法异养生长的主要原因在于不完整的三羧酸循环途径[18],然而细胞内糖代谢途径涉及的过程复杂,相关的功能基因也非常繁多,到目前为止有关藻类细胞异养功能缺失的代谢机制仍不清楚。对于雨生红球藻,缺乏相关的基因组学数据,对其代谢途径的认知也不甚清楚。特别是迄今未建立起稳定的雨生红球藻遗传改造技术[19]。因此很难通过同源重组或基因编辑的方法来实现多基因的引入,获得雨生红球藻葡萄糖异养株。相反,如果能够将具有完全糖同化利用能力的微生物(藻)细胞与雨生红球藻进行细胞融合杂交,有可能使葡萄糖利用的重要或全部基因得以在融合子中表达,从而获得可利用葡萄糖的雨生红球藻表型。
在水生浮游绿藻类群中,存在着能够高效利用葡萄糖进行快速异养生长的物种[20],其中异养小球藻最为典型。蛋白核小球藻利用葡萄糖异养发酵,其细胞密度可在5 d内达到100 g/L的高密度。雨生红球藻与小球藻同属于绿藻门,具有一定的亲缘关系,因此本研究拟通过原生质体融合的方式进行雨生红球藻和小球藻间的种间杂交,并通过限制性的糖异养条件筛选具有糖异养生长能力的融合子细胞,该研究的开展有可能为雨生红球藻以及其它产业化微藻的遗传改良与异养代谢应用提供一条新途径。
1 材料与方法
1.1 材料与仪器
雨生红球藻HaematococcuspluvialisSCCAP K-0084、NIES144、SAG34-1b 分别购自于丹麦哥本哈根大学SCCAP藻类与原生动物保藏库、日本NIES微生物菌种库和德国SAG藻种保藏库;小球藻ChlorellakessleriSAG 211-11a、ChlorellapyrenoidosaFACHB29、Chlorellasp. FACHB31 分别购自于德国SAG藻种保藏库和中国科学院淡水藻种库(FACHB);藻种通过BG11培养基[21]进行传代培养;D-葡萄糖、D-果糖、乙酸钠、丙三醇、D-苹果酸、丁二酸、α-酮戊二酸和柠檬酸 分析纯,国药;酵母提取物 分析纯,OXOID;二氯苯基二甲脲(DCMU)分析纯,Sigma-Aldrich;2-脱氧-d-葡萄糖(2DG) 99%试剂纯,上海生工;蛋白酶K(40 U/mg)、纤维素酶(500 U/mg)、半纤维素酶(200 U/mg) 分子生物学级,索莱宝;葡萄糖醛酸酶(1 kU/mg) Sigma-Aldrich。
PGX-250C光照培养箱 宁波赛福实验仪器有限公司;BX53显微镜 日本Olympus公司;SW-CJ-2D超净工作台 苏州净化设备有限公司;HWS-12恒温水浴 上海一恒科技公司;WD-9405A水平摇床 北京市六一仪器厂
1.2 实验方法
1.2.1 可利用糖底物的筛选与潮霉素抗性鉴定 基于BG11培养基,在其中添加10 μmol/L光合抑制剂二氯苯基二甲脲(DCMU)抑制光合作用,同时分别添加2 g/L的D-葡萄糖、D-果糖、乙酸钠、丙三醇、D-苹果酸、丁二酸、α-酮戊二酸或柠檬酸作为碳源底物,培养基中添加1.5 g/L琼脂制备固体平板。培养中分别将三种雨生红球藻和三种小球藻细胞涂布于平板上,(25±1) ℃暗处培养,根据克隆的出现与否判断底物的可利用性。对于细胞潮霉素抗性比较,也是基于BG11培养基,在其中分别添加不同浓度的潮霉素,添加琼脂制备固体平板,培养中分别将三种雨生红球藻和三种小球藻细胞涂布于平板上,(25±1) ℃光照培养,根据克隆生长情况判断细胞耐受能力。
1.2.2 雨生红球藻的原生质体制备 雨生红球藻原生质体制备参考Cheng等[22]的方法。将BG11中培养7~10 d的雨生红球藻细胞以2×103个/mL的细胞密度接种于BYA培养基中,BYA培养基是在BG11基础上添加2 g/L的乙酸钠和2 g/L的酵母提取物,培养温度为(25±1) ℃,连续光照强度为(50±1) μmol/(m2·s),每天定时摇动3次。3~4 d培养后获得超过85%的雨生红球藻游动细胞并用于原生质体制备。原生质体的酶处理采用含有0.06%的蛋白酶K、0.05 mol/L Tris-HCl、0.2 mmol/L CaCl2、0.2 mol/L山梨醇/甘露醇的酶解液(pH7.8)处理雨生红球藻游动细胞2~3 h。
1.2.3 小球藻的原生质体制备 小球藻原生质体的制备采用Rosen等[23]的方法。2500×g转速下离心5 min收集培养对数期的小球藻细胞,以2-脱氧-d-葡萄糖(2DG)作为预处理剂,将藻细胞置于含有1%(w/v)Glu/2DG(1∶3)的BG11中,于39 ℃下预处理24 h。预处理后用BG11洗涤藻细胞,最后将藻细胞置于含有4%纤维素酶、4%半纤维素酶、5%葡萄糖醛酸酶、8 mmol/L CaCl2、0.3 mol/L山梨醇/甘露醇的酶解液中,控制细胞密度为2×106~3×106个/mL,于29 ℃黑暗环境下酶解24 h。
1.2.4 原生质体制备率的计算 雨生红球藻游动细胞渗透敏感性高,其原生质体制备率的计算采用Cheng等[22]的方法,以胞外基质(Extracellular matrix,ECM)的去除来统计原生质体释放效率。ECM的去除是通过显微观察并结合血球计数板统计检测,每个样品至少3个平行,每个平行至少有200个细胞被统计和分类。酶解前及酶解后无ECM的细胞比例分别为R0和R1,则ECM去除率(%)=(R1-R0)÷(1-R0)×100。
小球藻原生质体制备效率采用Tjahjono等[24]所述的Triton裂解率统计方法,以0.019% Triton X-100作为原生质体裂解剂。将样品平均分成2份,一份加入Triton X-100使终浓度为0.019%,另一份加入等体积的PBS缓冲液(含0.3 mol/L山梨醇/甘露醇),30 min后分别用血球计数板统计加入Triton X-100的完整细胞数(X1)及加入PBS缓冲液(含0.3 M山梨醇/甘露醇)的完整细胞数(X2),则Triton裂解率(Lysis rate)=(X2-X1)÷X2×100%。
1.2.5 雨生红球藻与小球藻原生质体融合 原生质体融合采用PEG融合,参考陈波[25]采用的方法。雨生红球藻与小球藻的原生质体酶解后用重悬于含0.3 mol/L山梨醇/甘露醇的高渗缓冲液中,分别按细胞个数1∶10、1∶5和1∶1的混合细胞悬液,500×g转速下离心3 min,倾去上清液,向沉淀中加入1 mL原生质体融合液(40%聚乙二醇6000,添加0.6 mol/L山梨醇/甘露醇和50 mmol/L CaCl2-2H2O),轻轻混匀,于30 ℃水浴保温30 min后,缓慢加入1 mL原生质体清洗液(pH9.0的50 mmol/L甘氨酸缓冲液,添加0.6 mol/L山梨醇/甘露醇和50 mmol/L CaCl2-2H2O),轻轻混匀,10 min后再加入2 mL清洗液(对照组每次加入同等体积的原生质体培养液)。10 min后再加入2 mL原生质体培养液(BG11培养基添加0.3 mol/L山梨醇/甘露醇),离心洗涤,再用原生质体培养液离心洗涤3次,得到雨生红球藻与小球藻原生质体融合产物。
1.2.6 融合细胞的筛选 融合细胞在原生质体培养液中经过暗处48 h恢复性培养,在限制性糖异养平板条件进行筛选,筛选培养基BG11为基础,添加10 μmol/L光合抑制剂二氯苯基二甲脲(DCMU)和4 g/L葡萄糖(glu)去除野生型雨生红球藻细胞,同时添加10 μg/mL的潮霉素(hyg)抑制小球藻细胞的繁殖,加入1.5 g/L琼脂以制备固体平板。融合后的细胞经过24 h的恢复性培养后,每103个雨生红球藻形态细胞被均匀涂布在一个固体平板上,平板置于25 ℃培养3~4周。
1.2.7 融合子在含葡萄糖培养基中生长速率的测定 挑选3株经扩大培养后未产生形态分化的融合子以及另外两个亲本藻株,于BG11+4 g/L Glu的培养基中培养,接种密度控制在103个/mL,于散射光处25 ℃培养10 d,通过细胞计数[22]对比生长差异。
1.3 数据处理
实验中所有数据在EXCEL中进行记录与方差计算分析,并在SigmaPlot中作图。
2 结果与分析
2.1 雨生红球藻与小球藻的异养生长
DCMU是一种光合抑制剂及光形态建成抑制剂,它能抑制从PSⅡ上的Q向PQ的电子传递,研究中使用10 μmol/L的DCMU添加能够有效地抑制小球藻和雨生红球藻的光合自养生长。对比了3种小球藻和3种雨生红球藻基于不同碳源底物的异养生长能力,结果如表1中所示。3种小球藻均能够利用葡萄糖、果糖和乙酸钠进行异养生长,相比而言C.kessleriSAG211.11a的异养生长能力更强,同时还可以利用甘油、苹果酸以及琥珀酸进行异养生长。小球藻是目前报道最多的能够利用不同碳源底物进行异养生长的真核微藻类群[26],大量的报道也表明雨生红球藻仅可以利用乙酸盐进行异养生长[9-10],本研究结果同样发现3种雨生红球藻均只能利用乙酸钠进行异养生长,在其它底物下细胞完全不能分裂和繁殖。此外,本研究还发现H.pluvialisK0084藻株具有较强的潮霉素耐受能力(如图1),在10 μg/mL潮霉素浓度下H.pluvialisK0084能够在平板上正常形成藻落,而C.kessleriSAG211.11a的生长则受到明显抑制,这使得研究中可以通过限制性糖异养条件和潮霉素的添加来分别抑制野生型雨生红球藻和小球藻的生长,非常适合于融合子的筛选过程。因此,本研究选用H.pluvialisK0084和C.kessleriSAG211.11a进行细胞间的原生质体融合研究。

表1 不同碳源底物下雨生红球藻和小球藻的异养生长能力Table 1 Heterotrophic growth of Haematococcus and Chlorella species based on different carbon resources

图1 不同浓度潮霉素对H.pluvialis K0084和C.kessleri SAG211.11a的抑制Fig.1 Inhibition of different concentration of hygromycin on H.pluvialis K0084 and C.kessleri SAG211.11a注:hy10、hy20、hy30分别代表潮霉素浓度10、20、30 μg/mL。
2.2 雨生红球藻的原生质体制备
有研究曾提出,雨生红球藻游动细胞不具有纤维素化的细胞壁,原生质体外仅有松散的细胞外基质(extracellular matrix,ECM)结构包裹,因而在低渗透压条件下极易裂解,因此不能使用传统的渗透压裂解来评价原生质体得率,并且提出通过利用ECM去除率来衡量原生质体的制备效率[22,27]。表1的结果显示,雨生红球藻游动细胞经过蛋白酶处理后,无ECM细胞比例可以提高到75%以上,ECM去除率平均可达72.11%±3.94%,这表明经过酶处理后超过70%的雨生红球藻细胞以原生质体形态存在,满足本研究的需要。

表2 雨生红球藻原生质体制备效率(%)Table 2 Protoplast preparation rate of H. pluvialis(%)
2.3 小球藻原生质体的制备
小球藻不同于雨生红球藻,其不存在明显的细胞分化,而且细胞上有明显的纤维素化细胞壁包裹,因而小球藻的原生质体制备大多以纤维素酶和半纤维素酶等多糖降解酶为主,此外为了提高原生质体释放效率,以2-脱氧-d-葡萄糖(2DG)作为预处理剂处理24 h[28]。如表3所示,本研究中酶解处理后Triton裂解率达到42.07%±3.73%,这意味着经过酶处理后仅有40%左右的小球藻细胞形成裸露的原生质体。以往的研究中不同学者对于小球藻原生质体制备情况研究各异,但大部分的原生质体制备率都不高于50%[25,28]。这些研究认为,小球藻细胞壁中存在类似次生细胞壁的结构,该部分在酶解过程中较难降解,尤其是一种孢粉素成分的存在导致原生质体释放效率不高[29]。虽然在小球藻中原生质制备效率受到目前技术条件的限制,无法进一步提高,但是由于本研究中可以通过添加潮霉素抑制未融合的小球藻细胞生长,因此这一结果仍然可以满足研究需要。

表3 小球藻原生质体制备效率Table 3 Protoplast preparation rate of C. kessleri
2.4 雨生红球藻与小球藻原生质体融合
原生质体的融合主要有物理和化学融合两种方式,以往藻类细胞融合研究中大部分都采用的是PEG介导的化学融合的方式,这种方式操作过程简单,设备依赖性低,易于操作[25]。在本研究中融合过程首先利用40% PEG处理实现细胞间的聚集,之后再加入高钙、高pH的融合洗涤液促进原生质体间的融合。由于雨生红球藻细胞同小球藻间存在明显的细胞个体大小差异,因而本研究将雨生红球藻与小球藻分别按1∶1、1∶5和1∶10的细胞个数比例进行混合后,再同时进行细胞间的融合,以获取最佳的细胞融合与筛选条件。在3种融合条件下,雨生红球藻周围都会有小球藻附着,而且均观察到各种典型的两两融合状态,之间并未存在任何明显差异。如图2A中所示,可以观察到两种原生质体间彼此靠近,同时未去壁的雨生红球藻细胞由于细胞壁的障碍,阻止了原生质体的融合;此外,在融合过程中也经常发生多个小球藻原生质体同单个雨生红球藻原生质体聚集和靠近的现象(图2B),这时一些互相靠近的原生质体间隔膜(细胞膜)逐渐消失,原生质体逐渐发生融合(图2C)。因此,本过程完全实现了雨生红球藻和小球藻间的融合与杂交。
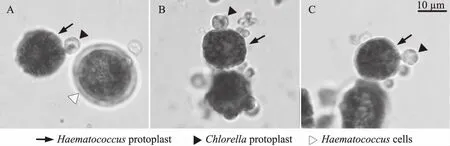
图2 雨生红球藻和小球藻间的细胞融合观察Fig.2 Micrographs of cell fusion between H.pluvialis and C.kessleri注:A~C均为1∶1融合条件的结果。
2.5 糖异养细胞的筛选
以往的原生质体融合研究中,通常通过单细胞显微操作,将融合细胞分离后再进行表型鉴定与选育,这种方式完全依赖于个人的操作,能够筛选和鉴定的融合子克隆数量非常有限[25],因此本研究采用限制性糖异养条件进行筛选,针对整合融合后的细胞样品,选育具有糖异养生长能力的雨生红球藻融合子克隆。由于雨生红球藻不能利用葡萄糖进行异养生长,在添加光合作用抑制剂DCMU的含糖培养基中,野生型无法生长,通过这一条件可以筛选出能够进行糖异养生长的雨生红球藻融合子细胞,但由于小球藻可以在这一条件下快速生长,这会大大影响筛选效率,为此,在该筛选培养条件下还加入了10 μg/mL的潮霉素抑制小球藻的生长。如图3所示,经过3~4周的筛选性培养在雨生红球藻对照平板上,完全没有任何藻落形成,经过显微镜检观察,涂布后的细胞完全被裂解,或者仍然保持单细胞未分裂增殖状态,小球藻对照平板上,仅有个别克隆形成,生长受到潮霉素的抑制。对于1∶1、1∶5和1∶10比例下融合细胞样品,随着小球藻比例的提高,更多的克隆在平板上形成。通过显微鉴定发现两种不同形态的藻落形成(如图4),一种是藻落明显且照片中清晰可见的大部分克隆,经过鉴定完全是小球藻形态细胞;另一种是较小且照片中不清晰或完全肉眼不可见的克隆,但经过显微观察确定为正常的雨生红球藻藻落。通过这种显微鉴定方式,对各个融合条件与对照下的平板进行了显微统计,结果如表4所示,在1∶1融合条件下,平板上获得的藻落大部分为雨生红球藻类型,仅有个别小球藻藻落形成,随着融合中小球藻细胞比例的提高,在1∶5与1∶10融合条件下出现越来越多的小球藻形态的藻落,此外,在1∶10的融合比例下,大量的小球藻落形成,完全没有鉴定到雨生红球藻形态的糖异养克隆,这可能是由于大量小球藻藻落的形成,吸收和利用了大部分平板营养,限制了雨生红球藻融合子继续生长,而如果能通过细胞分选技术在融合后进行融合细胞与小球藻的高效分离,有可能大大地提高融合细胞的筛选效率。

图3 H.pluvialis与C.kessleri不同融合比例下的平板筛选Fig.3 Screening plates from fusion samples with different cell ratios of H.pluvialis and C.kessleri

图4 融合子筛选性平板上的两种克隆形态Fig.4 Two microscopic forms of colonies on the fusant-screening plate注:A:雨生红球藻形态;B:小球藻形态。
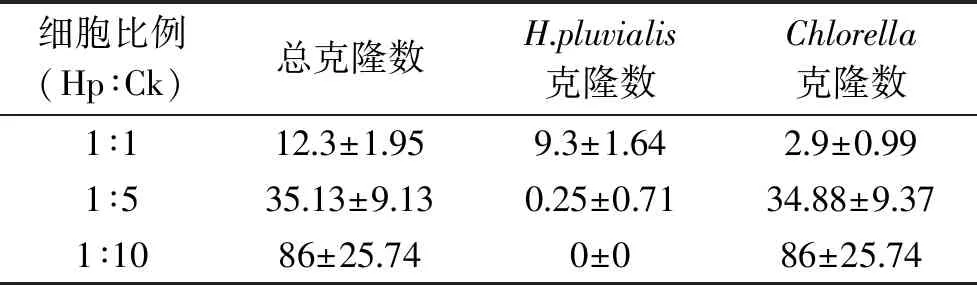
细胞比例(Hp∶Ck)总克隆数H. pluvialis克隆数Chlorella克隆数1∶112.3±1.959.3±1.642.9±0.991∶535.13±9.130.25±0.7134.88±9.371∶1086±25.740±086±25.74
2.6 融合子的培养与鉴定
对于融合条件获得平板,经过显微克隆形态鉴定后,选取雨生红球藻形态的融合子克隆,接种到含有BG11培养基的24孔板中培养,经过一段时间培养后,将正常生长的克隆转移到50 mL三角瓶中继续扩大培养后进行鉴定观察。经过扩大培养后的融合子与野生型亲本藻株的细胞形态如图5所示。从显微照片可以看到,雨生红球藻融合子细胞在外观、大小上与野生型雨生红球藻类似。另外,还可以观察到某些融合子培养后,形成了类似小球藻形态的克隆,但是其逐渐开始分化(图5D),分化出的细胞形态类似小球藻,但比小球藻要大,说明某些融合子在遗传表型上并不稳定。陈波[25]也曾报道,雨生红球藻和小球藻的融合子细胞中可能会有形态类似小球藻,但个体较大的细胞。本研究统计了挑选的融合子经扩大培养后遗传表型的分化情况,在所挑选的72个融合子克隆中,有23个融合子出现了向小球藻分化的情况,其它融合子经两次以上传代后遗传表型仍能够保持。
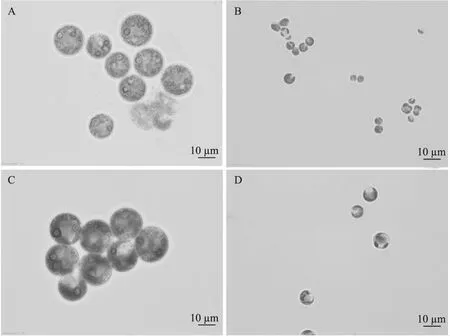
图5 野生型雨生红球藻(A)、小球藻(B)及融合子细胞(C,D)显微照片Fig.5 Micrographs of wild-type H. pluvialis(A),Chlorella(B)and fusants(C,D)。
2.7 融合子的糖异养生长
三个融合子(Fusant8、Fusant9、Fusant10)被置于含糖条件下进行培养,它们同雨生红球藻以及小球藻间的生长差异如图6所示,三个融合子的生长速率相比于野生型雨生红球藻有明显的增强,10 d培养后细胞密度分别达到6.7×104、8.7×104和6.5×104个/mL,明显高于野生型的2.45×104个/mL,但是相比于小球藻10 d后1.4×106个/mL的细胞密度而言,异养生长能力仍然有限,尚不能满足高密度培养的需求。目前,细胞杂交育种技术在微藻育种中的应用研究较少,沈继红等[30]曾将富含EPA和DHA的自养绿色巴夫藻和生长迅速的异养四鞭藻用细胞融合的方法构建EPA和DHA高产异养藻株,融合藻株虽较亲本异养藻株各方面指标大有提高,但相比亲本自养藻株仍不够理想,而且后期遗传稳定性也不高。江胜滔等[31]在酒酵母与雨生红球藻的细胞融合子的鉴定过程中认为,融合子在世代延续中可能发生过双亲DNA的互相排斥或单亲DNA的丢失。这可能是造成融合子后代无法获得稳定杂交遗传表型的主要原因,而如果能够通过在融合后对融合细胞进行进一步的高强度诱变处理,破除细胞间的核障碍,有可能使原生质体杂交技术在远缘杂交中获得更广泛的应用。

图6 三个雨生红球藻融合子及亲本藻株在含葡萄糖培养基中的生长Fig.6 Growth curve of H.pluvialis fusants and parental strains cultured in medium with glucose
3 结论
本研究通过PEG介导的原生质体融合技术,实现了雨生红球藻同小球藻间的细胞杂交,而且基于限制性糖异养条件筛选出具有雨生红球藻形态融合子克隆,这些融合子细胞获得了增强的糖代谢能力,但是经过传代后会出现遗传表型蜕化以及糖异养生长能力低等问题,尚不能满足细胞高密度培养的需要。究其原因,应该是由于细胞融合后两基因组间无法有效实现同源重组所导致的,而如果能将原生质体融合技术同高强度的基因组诱变技术相结合,提高融合后异源基因组间的重组效率,有可能建立更高效的藻种间基因组杂交与选育技术,为雨生红球藻藻种改良建立更高效的平台技术与体系。
