PI3K/Akt通路在缺氧活化钙敏感受体介导的A549细胞转移中的作用
2019-06-24李光伟张宁宁
李光伟,王 珺,肖 薇,金 莉,李 波,赵 宇,张宁宁,汪 娜
(齐齐哈尔医学院病理生理学教研室,黑龙江 齐齐哈尔 161006)
肺癌是世界上发病率和死亡率最高的恶性肿瘤[1]。钙离子与钙信号转导在肺癌发生中起重要作用,但其具体机制尚未阐明。钙敏感受体(calcium-sensing receptor,CaSR)是细胞膜上的一种G蛋白偶联受体[2],其在肿瘤的发生中发挥着重要作用,但CaSR在肺癌转移中的作用鲜有报道。我们前期研究发现,CaSR蛋白在人非小细胞肺癌组织中表达增强,其表达强度与肿瘤大小、肿瘤分化程度、TNM分期及淋巴结转移情况有关,提示在非小细胞肺癌中,CaSR的表达可能与肿瘤细胞的增殖及侵袭、转移密切相关[3]。为探究CaSR在肺癌转移中的具体机制,本实验以A549及A549/DDP细胞为研究对象进行研究,以期为肺癌的防治提供新的药物作用靶点。
1 材料与方法
1.1 细胞人肺腺癌细胞A549、耐顺铂人肺腺癌细胞A549/DDP,购于中国科学院上海生命科学研究院细胞资源中心。
1.2 试剂与仪器基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)ELISA试剂盒,购于美国R&D公司;Transwell小室,购于Corning公司;CaSR、MMP-2、Akt、p-Akt、GAPDH的一抗及二抗,均购于Santa Cruz公司;LY294002(PI3K/Akt通路抑制剂)、NPS2143(CaSR抑制剂)、GdCl3(CaSR激动剂),购于Sigma公司。缺氧培养箱及酶标仪(Thermo);倒置显微镜(Olympus);DF-D型恒压恒流电泳仪(北京六一厂);高速离心机(美国Sigma公司);化学发光成像系统(上海天能科技有限公司)。
1.3 实验分组及缺氧模型的复制A549及A549/DDP细胞在37 ℃、5% CO2条件下,含10%胎牛血清和1%双抗的RPMI 1640培养基中培养,顺铂维持浓度为2 mg·L-1。将处于对数生长期的细胞随机进行分组。对照组(control):细胞无血清培养24 h后,正常培养箱无血清培养24 h;缺氧组(H):细胞无血清培养24 h后,缺氧箱内无血清培养24 h(93% N2、2% O2、5% CO2);GdCl3干预组(H+Gd):细胞无血清培养24 h,加入GdCl3(300 μmol·L-1)后,缺氧箱内无血清培养24 h;NPS2143干预组(H+NPS):细胞无血清培养24 h,加入NPS2143(10 μmol·L-1)后,缺氧箱内无血清培养24 h;LY294002干预组(H+LY+Gd):细胞无血清培养24 h,加入LY294002(10 μmol·L-1)孵育30 min后,加入GdCl3(300 μmol·L-1),缺氧箱内无血清培养24 h[4]。
1.4 Western blot检测CaSR、MMP-2、Akt、p-Akt的蛋白水平各细胞组达到实验终点后,细胞刮下后,加入蛋白裂解液及PMSF,冰上孵育40 min,4 ℃、12 000 r·min-1离心20 min,上清进行蛋白定量。取20 μg蛋白样品,10% SDS-PAGE电泳,300 mA转移2 h至硝酸纤维素薄膜,封闭1 h;分别加入一抗MMP-2、Akt、p-Akt、GAPDH(1 ∶500)4 ℃过夜。洗膜,二抗(1 ∶1 000)孵育1 h,显色发光,吸光度扫描,半定量分析显影条带[5-7]。
1.5 ELISA法检测MMP-2含量收集各组细胞上清液,1 500 r·min-1离心10 min,取上清液1 mL待测。实验步骤按ELISA试剂盒说明书进行。所有标本均进行3个复孔检测,并为同批测定,均值为终质量浓度。分别以标准物的质量浓度及450 nm波长的吸光度(A)值为横纵坐标,在半对数坐标纸上绘出标准曲线。在坐标曲线上通过样品A值,查出相应的样品质量浓度(μg·L-1)[8]。
1.6 Transwell小室检测细胞侵袭情况按照基质胶 ∶DMEM=1 ∶29比例稀释后,向上室铺基质胶。细胞分组同“1.3”,各组细胞分别离心后用无血清培养基重悬,调整细胞悬液浓度1.0×109·L-1种于上室,下室加入含有10% FBS的完全培养基600 μL,按照分组情况,分别于上室内加药后置于常氧及缺氧箱内培养24 h;将上室取出,用棉签擦去上室内未迁移的细胞,PBS冲洗2次;甲醇固定上室细胞20 min;PBS冲洗2次,适当风干后,0.5%结晶紫染色20 min,PBS冲洗2次,风干。倒置显微镜高倍镜下任意选取5个不相同的视野,拍照并计数细胞[9]。
1.7 划痕实验检测细胞迁移情况细胞分组同“1.3”。取2块6孔板,用marker笔分别在每块板背面划横线,每隔0.5~1 cm划一道,横穿过孔,每孔至少穿过5条线。每孔加入约5×105个细胞,以过夜能铺满为标准,细胞贴壁后去血清24 h。次日用200 μL的枪头比着直尺,垂至于背后的横线划痕。PBS冲洗3次,去除划下的细胞,按分组情况分别处理及加药,其中一块板置于正常培养箱内,另一块板置于缺氧箱内,分别培养24 h。取样,拍照[10]。分别测量0 h和24 h的划痕宽度,迁移距离=0 h的划痕宽度-24 h的划痕宽度。
2 结果
2.1 不同处理因素对CaSR表达的影响如Fig 1所示,与对照组比较,H组CaSR表达增加(P<0.05);与H组比较,GdCl3能增加CaSR表达(P<0.05),CaSR抑制剂NPS2143的作用相反,A549/DDP细胞CaSR蛋白表达结果与A549细胞一致。
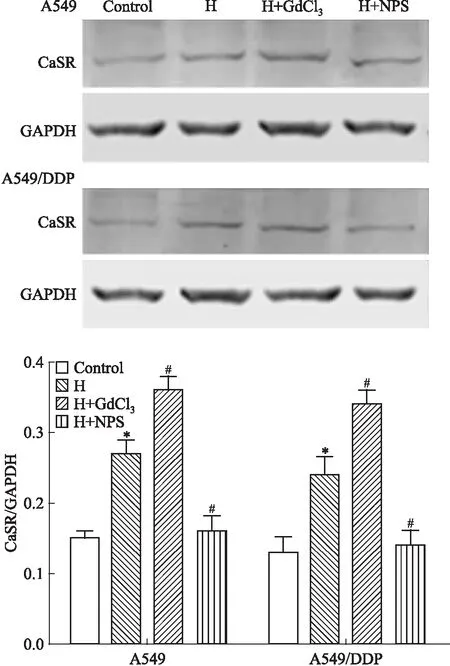
Fig 1 The protein expression of CaSR determined by Western blot in different groups of A549 and A549/DDP
H: hypoxia, NPS: NPS2143.*P<0.05vscontrol group;#P<0.05vsH group.
2.2 不同处理因素对细胞MMP-2蛋白表达的影响如Fig 2所示,与对照组比较,H组MMP-2蛋白表达增加(P<0.05);与H组比较,缺氧基础上GdCl3和NPS2143分别能上调和下调这种作用(P<0.05);与H+GdCl3组比较,LY294002能够抑制MMP-2蛋白的表达上调(P<0.05),A549/DDP细胞MMP-2的变化趋势与A549细胞一致。
2.3 不同处理因素对p-Akt蛋白水平的影响2种细胞Western blot检测结果显示(Fig 3),与对照组比较,缺氧能够上调Akt蛋白磷酸化水平(P<0.05);与H组比较,缺氧基础上GdCl3能够进一步增加其磷酸化的水平(P<0.05);与H+GdCl3比较,这种促进效应可以被PI3K通路阻断剂LY294002抑制(P<0.05);NPS2143则与GdCl3作用相反。

Fig 2 The protein levels of MMP-2 in A549 and A549/DDP cells determined by Western
H: hypoxia; NPS:NPS2143; LY: LY294002.*P<0.05vscontrol group;#P<0.05vsH group;△P<0.05vsH+GdCl3group.
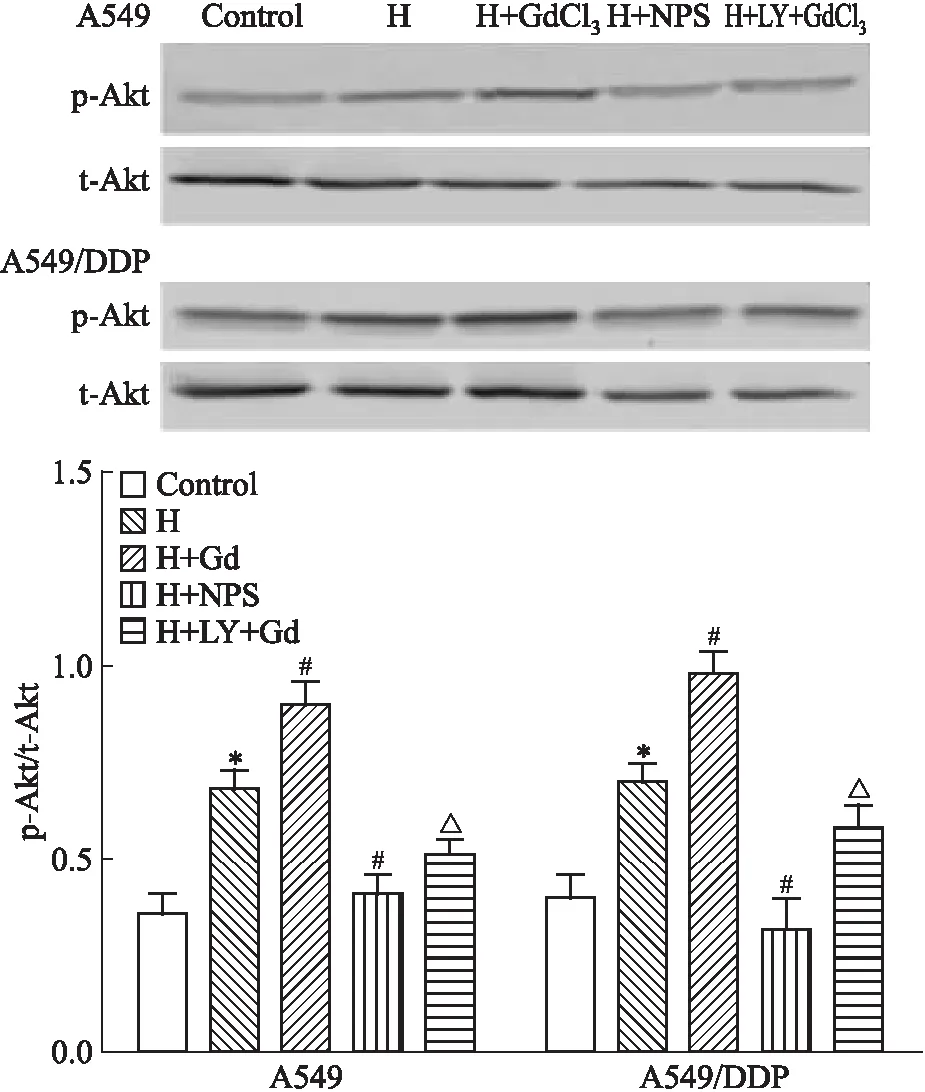
Fig 3 The protein levels of p-Akt in A549 and A549/DDP cells
*P<0.05vscontrol group;#P<0.05vsH group;△P<0.05vsH+GdCl3group
2.4 不同处理因素对细胞分泌MMP-2的影响如Fig 4所示,H组A549及A549/DDP细胞上清液中的MMP-2蛋白浓度高于对照组(P<0.05),但却明显低于H+GdCl3组(P<0.05),而缺氧和GdCl3的作用可被PI3K抑制剂LY294002所抑制(P<0.05),NPS2143则与GdCl3作用相反。
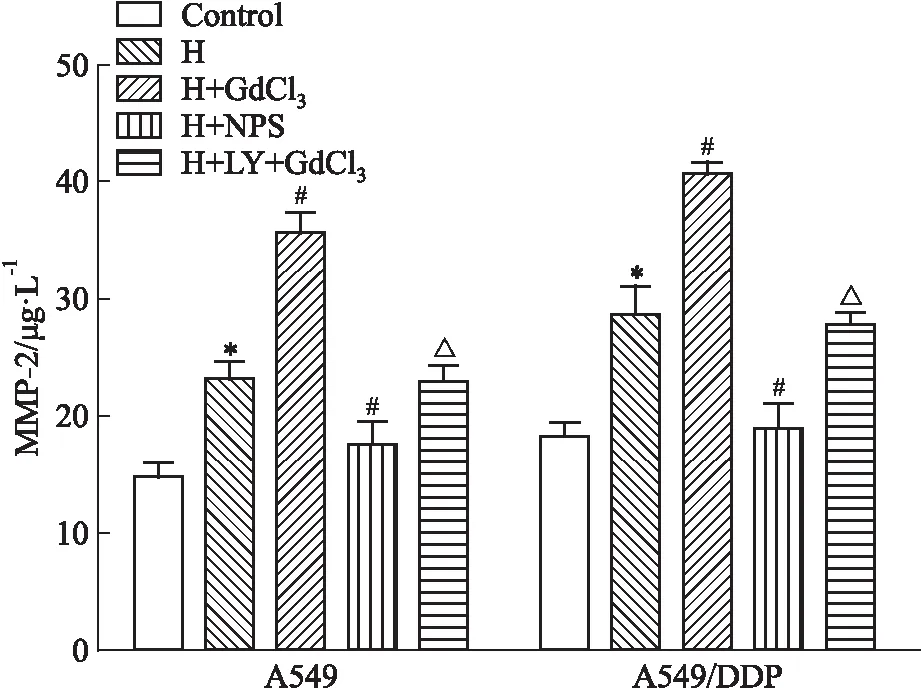
Fig 4 Level of MMP-2 in A549 and A549/DDP cell cultured
*P<0.05vscontrol group;#P<0.05vsH group;△P<0.05vsH+GdCl3group
2.5 不同处理因素对细胞侵袭的影响Transwell结果显示(Fig 5),在A549及A549/DDP细胞,与对照组比较,H组平均每个高倍(400倍)视野穿过滤膜的细胞数明显增加(P<0.05),提示缺氧可明显增加A549细胞的运动侵袭能力。缺氧基础上NPS2143能抑制A549细胞侵袭,GdCl3能促进其侵袭(P<0.05),但这种促进作用可被LY294002阻断(P<0.05)。
2.6 不同处理因素对细胞迁移能力的影响如Fig 6所示,在A549细胞H组较对照组迁移距离增加(P<0.05);与H组比较,NPS2143抑制细胞迁移(P<0.05),GdCl3能促进A549细胞的迁移(P<0.05),而PI3K抑制剂LY294002则可抑制GdCl3的作用(P<0.05),A549/DDP细胞迁移的变化趋势与A549细胞一致。
3 讨论
侵袭和转移是临床上恶性肿瘤患者治疗失败和死亡的主要原因,因此,揭示恶性肿瘤转移的机制,将有助于判断患者预后和选择合理、有效的治疗方案, 延长患者的生存期限及提高生活质量。目前,我国已为世界第一肺癌大国,因此肺癌的诊疗已成为我国临床工作者面临的严峻挑战。钙离子作为细胞内重要的信息分子,可以激活不同的信号通路,参
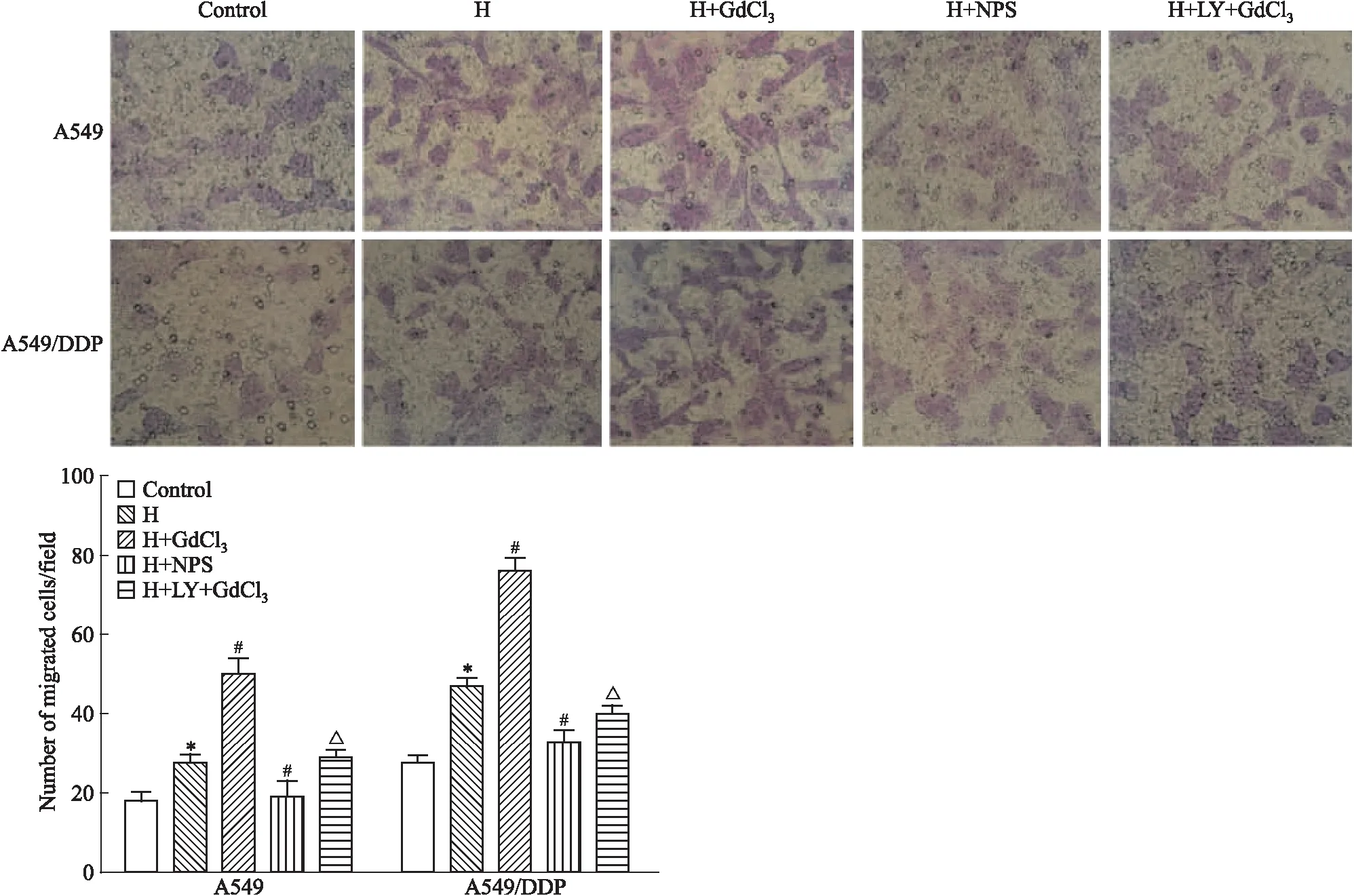
*P<0.05vscontrol group;#P<0.05vsH group;△P<0.05vsH+GdCl3group
与许多重要生命活动的调节。恶性肿瘤发生、发展过程常伴随钙离子信号的异常,但其发生机制不甚清楚。因此,认识钙信号在肺癌发生、发展中的作用,对于进一步揭示肺癌发生的分子机制,改善患者预后,提高其生存质量有重要意义。
CaSR是G蛋白偶联受体C家族成员之一。Brown等[2]于1993年首先从牛的甲状旁腺中克隆出CaSR。CaSR在维持全身钙的平衡系统中具有重要作用,此外,还可参与细胞增殖、分化、分泌、趋化、凋亡、基因表达、离子通道开关、维持膜电位、衰老等过程。大量研究表明,CaSR在肿瘤的发生、发展过程中发挥重要作用。CaSR是影响乳腺癌预后的独立风险因子[11-12]。本课题组前期研究发现,CaSR蛋白在非小细胞肺癌组织中表达增强,其表达强度与肿瘤大小、肿瘤分化程度、TNM分期及淋巴结转移情况密切相关,提示在非小细胞肺癌中CaSR的表达或活化可能与肿瘤细胞的增殖及侵袭、转移相关[3]。但其具体发生机制如何,目前尚无相关报道。
众所周知,实质性肿瘤细胞物理微环境的基本特征之一是缺氧,缺氧可活化多种细胞膜上的CaSR[13]。研究中,我们观察到缺氧能够上调A549及A549/DDP细胞CaSR蛋白的表达,在此基础上,GdCl3能够进一步加强CaSR的表达,而CaSR抑制剂NPS2143能减弱CaSR的表达,说明缺氧能够活化A549及A549/DDP细胞的CaSR。
Brennan等[14]研究表明,激活的CaSR能够促进乳腺癌及前列腺癌骨转移的发生。新近研究揭示,CaSR在体内和体外促进肾细胞癌的骨转移进程[15]。本研究结果显示,缺氧促进A549及A549/DDP细胞迁移距离,增加穿过滤膜细胞数量和侵袭能力。上述这些作用能够被CaSR激动剂GdCl3所增强,被CaSR激动剂NPS2143所抑制,提示缺氧活化的CaSR可能参与了A549及A549/DDP细胞的迁移和侵袭过程。
基底膜或细胞外基质的降解是肿瘤浸润转移的重要环节,MMP-2和MMP-9能有效降解基底膜或细胞外基质,在肿瘤的浸润和转移灶的形成过程中起重要作用。本研究显示,缺氧组A549及A549/DDP细胞MMP-2蛋白表达增多,同时分泌到培养液中的MMP-2蛋白浓度增加,GdCl3能上调缺氧的这种效应,NPS2143作用相反。说明缺氧活化的CaSR可能通过促进A549及A549/DDP细胞MMP-2蛋白的表达,进而促进A549及A549/DDP细胞的侵袭和转移的进程。
PI3K/Akt通路是肿瘤细胞侵袭转移的经典信号途径之一,为进一步探索PI3K/Akt通路在缺氧活化CaSR促进A549细胞侵袭的作用,我们选用了PI3K信号通路的抑制剂LY294002进行实验。结果显示,LY294002能够减弱GdCl3所引起的细胞侵袭效应,表现为细胞迁移距离减少,穿过滤膜细胞的数量减少;蛋白检测结果显示,缺氧能够增加Akt蛋白磷酸化水平,GdCl3能增强缺氧的作用,但该作用被LY294002所减弱。这些结果均提示,PI3K/Akt信号通路在缺氧活化CaSR促进A549及A549/DDP细胞侵袭中起重要作用。
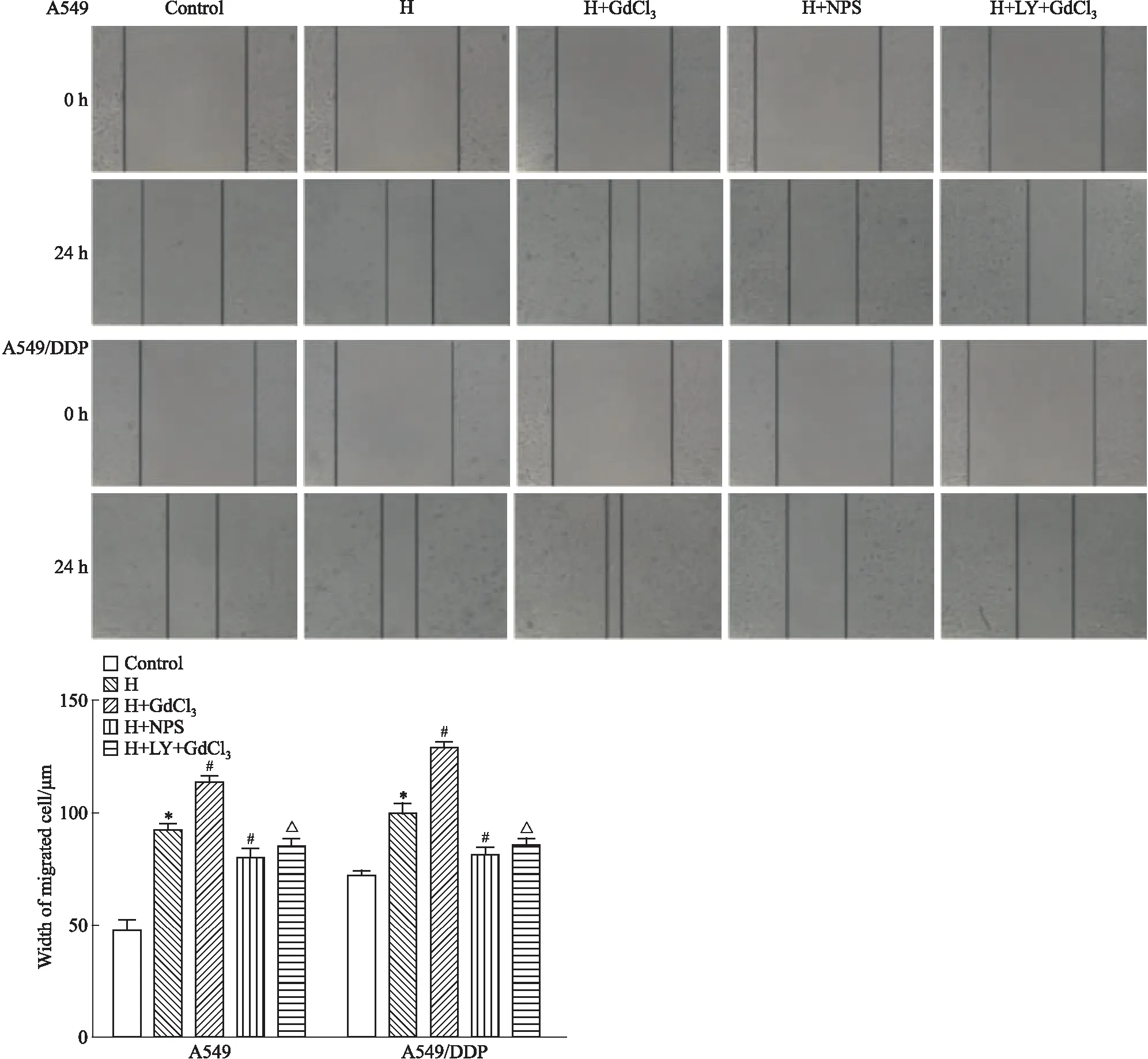

*P<0.05vscontrol group;#P<0.05vsH group;△P<0.05vsH+GdCl3group
(致谢:本实验在齐齐哈尔医学院基础医学院分子生物学实验室完成,感谢课题组成员的支持和协助。)