慢病毒介导TGF-β3转染兔脂肪间充质干细胞对其向成软骨细胞分化的影响
2019-06-22许颖捷曾雪敏尹小朋宋志强龚忠诚
许颖捷, 邵 博, 曾雪敏, 尹小朋, 王 冰, 宋志强, 龚忠诚
(1新疆医科大学第一附属医院/附属口腔医(学)院颌面肿瘤外科, 2新疆维吾尔自治区口腔医学研究所, 乌鲁木齐 830054)
髁突软骨部分缺损或退行性病变常由颞颌关节骨关节病、肿瘤、创伤等多种病因侵及软骨层面而导致发生。软骨自身因匮乏神经血管致使其恢复力受限,当其因任何原因损伤后,调动机体进行自身修复后结果不容考量。在临床上,目前用于颞下颌关节软骨缺损的治疗方案主要有三种[1],一是关节腔内注射促软骨修复药物和润滑补偿物质,二是外科手术进行自体软骨移植,三是人工髁突置换手术。虽然以上方法均有一定疗效,但同时也存在一些局限性和缺点。近年来,随着组织工程软骨技术的出现为软骨缺损的修复带来了新的契机。脂肪间充质干细胞(adipose-derived stem cells, ADSCs),取材步骤简单易行,量大且创伤小等特点是软骨组织工程种子细胞来源的绝对优势,脂肪干细胞可以在体外可以分化成软骨、骨、肌腱、骨骼肌和脂肪[2-3],这也使得ADSCs逐渐成为种子细胞研究焦点。转化生长因子-β(TGF-β)家族是成软骨细胞分化的主要调节因子。TGF-β主要通过调节种子细胞胞外胶原分子、蛋白多糖水平的表达,在此基础的同时降低了蛋白酶的含量。来源于TGF-β超家族的TGF-β3具有增加软骨外基质成分,并且能合成硫酸糖胺聚糖的作用。使用含有TGF-β3目的基因的慢病毒载体内源性转染ADSCs,诱导其向软骨细胞分化,从而促进组织再生。本研究旨在探究体外培养条件下利用含TGF-β3的慢病毒基因载体转染ADSCs,探索最佳转染滴度,观察转染后的ADSCs的活性和向软骨细胞分化潜能。
1 材料和方法
1.1 材料与仪器胎牛血清(Gibco);H-DMEM、DMEM/F12培养基、PBS、青霉素/链霉素、0.25%胰蛋白酶(Hyclone);TGF-β3慢病毒载体(Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin)购于上海吉凯基因有限公司;细胞活性检测(CCK-8)试剂盒(博士德);Trizol试剂(Invitrogen);反转录试剂盒、荧光定量试剂盒(Thermo);二氧化碳恒温箱(HF240,中国);荧光倒置显微镜(LEICA CTR400,德国);共聚焦显微镜(LASAF_CIP_HWS3LEICA,德国)。
1.2 实验动物新西兰大耳兔,体质量2.0~2.5 kg,雌雄不限,由新疆医科大学第一附属医院动物实验中心提供。实验过程中对动物的处置严格遵守《关于善待实验动物的指导性意见》相关要求。动物伦理审核项目编号(IACUC20180411-13)。
1.3 兔ADSCs的分离培养常规分离培养取自双侧腹股沟部脂肪组织中的ADSCs原代细胞,按照1∶4传代扩增ADSCs。原代细胞及传代细胞使用倒置显微镜每日观察细胞生长情况及形态变化。
1.4 慢病毒转染ADSCs取生长良好的第2代ADSCs,胰酶消化后离心重悬,以1×105/mL细胞悬液种于3.5 cm培养皿中,ADSCs转染时分为3个组:转染含有绿色荧光蛋白TGF-β3慢病毒的ADSCs作为LV-(TGF-β3)-ADSCs组,转染仅含有绿色荧光蛋白慢病毒空载体的ADSCs作为LV-ADSCs组,未转染慢病毒的细胞作为空白组。待细胞贴壁率约达30%时按感染条件(感染复数)MOI=50及MOI=100开始进行转染,分别在LV-(TGF-β3)-ADSCs组加入无血清DMEM/F12培养液、TGF-β3慢病毒载体及感染增强液;LV-ADSCs组加入无血清DMEM培养液、慢病毒空载体及感染增强液;空白组仅加入无血清DMEM/F12培养液。每瓶加入1 mL液体量,水平小幅震荡使病毒液与细胞充分接触,置于37℃、5% CO2饱和浓度的培养箱中培养。12 h后吸出病毒液,加入完全培养基,常规培养每2天换液1次,96 h后在荧光显微镜下观察。
1.5 流式细胞术及激光共聚焦检测转染效率在转染96 h后,各组培养皿中细胞分别经由0.25%胰蛋白酶消化,收集细胞,PBS清洗离心2次后重悬,调整细胞浓度为5×105个/mL,取200uL细胞悬液,上机测定增强绿色荧光蛋白(enhanced green fluorescent protein, EGFP)表达效率。各转染组分别使用0.25%胰蛋白酶消化,调整细胞浓度后按5×103个接种至共聚焦小皿内,24 h后拍摄共聚焦检测转染效率。具体观察内容如下:各组细胞在共聚焦显微镜下观察转染后荧光显影效果。低倍镜下取同一个视野,分别在明场及激发的荧光条件采图,同时叠加合并后可显示该视野下所含细胞负载并表达EGFP的占比。
1.6 CCK-8检测不同滴度慢病毒感染ADSCs细胞毒性慢病毒感染完成的细胞消化后按照密度为 2×104/mL,取100 μL细胞悬液接种于96孔板中。于37℃,5%CO2培养箱中培养,培养1 d后分别加入 10 μL CCK8试剂孵育3 h。对照组CCK8试剂加入不含细胞的培养液中。酶标仪读取450 nm处的吸光度,连续检测8 d观察慢病毒对细胞生长的影响。根据CCK-8法连续8 d检测各组细胞数量,由细胞的生长情况进一步评判慢病毒载体对脂肪间充质干细胞的毒性作用,未做任何处理的空白组细胞作为参照。
1.7 实时定量PCR分别在诱导分化7、14、21 d,Trizol法提取总RNA,Nanodrop核酸蛋白测定仪检测总RNA 的浓度与纯度,按照逆转录试剂盒说明书逆转录获得cDNA,DEPC水稀释5倍后进行荧光定量。构建的20uL反应体系如下: 2×SYBR green PCR Master mix 10 μL,Primer ( mix) 1 μL,RNase-Free water 7 μL,cDNA 2 μL。每个样本设3个复孔,在Real-time PCR仪上进行反应。反应条件:95℃ 2 min,95℃ 5 s,62℃ 15 s,共39个循环。以GAPDH为内参基因,采用Livak公式2-ΔΔCt法计算聚蛋白多糖(AGGRECAN)、Ⅱ型胶原(COL2A1)、性别决定区Y框蛋白(Sry related HMG box-9, SOX-9)的相对表达水平。各引物序列见表1。
2 结果
2.1 兔ADSCs形态倒置显微镜下观察,接种细胞后72 h可见少量细胞已贴壁,随着培养的时间延长原代细胞分裂增殖,包浆逐渐向外伸展变形为长梭形(图1a),约7~9 d贴壁细胞数量可覆盖培养瓶底面80%之多(图1b),呈扁平状。ADSCs按1∶4传代第3至5代时,细胞生长速度较快,约2~3 d贴壁面积可超过90%,生长呈典型的漩涡状或鱼群状聚集,ADSCs经传代后可纯化,形态多呈长梭形,较为均一。

表1 各引物序列及大小

a: ADSCs P0培养4 d(×100)

b: ADSCs P3培养3 d(×100)
图1 兔ADSCs干细胞形态
2.2 流式细胞仪及共聚焦检测转染效率
2.2.1 流式细胞术检测转染效率 慢病毒载体含有EGFP基因,其表达效率即转染效率。使用流式细胞仪测定EGFP表达效率结果显示:LV-(TGF-β3)-ADSCs组及LV-ADSCs组MOI=50时转染效率分别为82%、90.9%;LV-(TGF-β3)-ADSCs组及LV-ADSCs组MOI=50时转染效率分别为90.5%、93.5%。在ADSCs转染96h时,各转染组组间转染效率的差异无统计学意义(P>0.05),但LV-(TGF-β3)-ADSCs组及LV-ADSCs组的转染效率明显高于空白组,差异有统计学意义(P<0.05),见图2。
2.2.2 共聚焦显微镜观察转染效果 根据镜下观察荧光激发后显像结果,即可估算转染效率,观察ADSCs转染96 h后各组细胞传代继续培养24 h时的转染效率无明显差异,见图3。
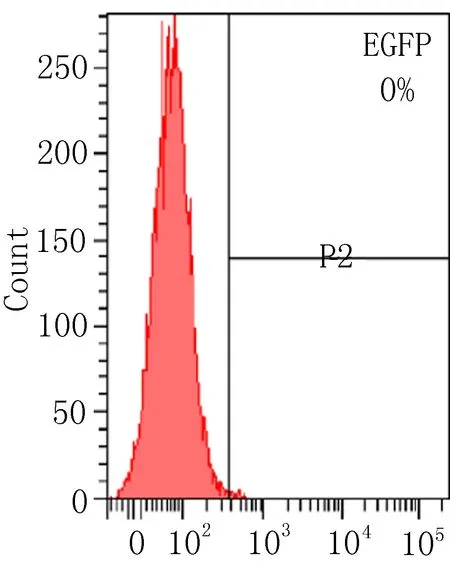
空白组
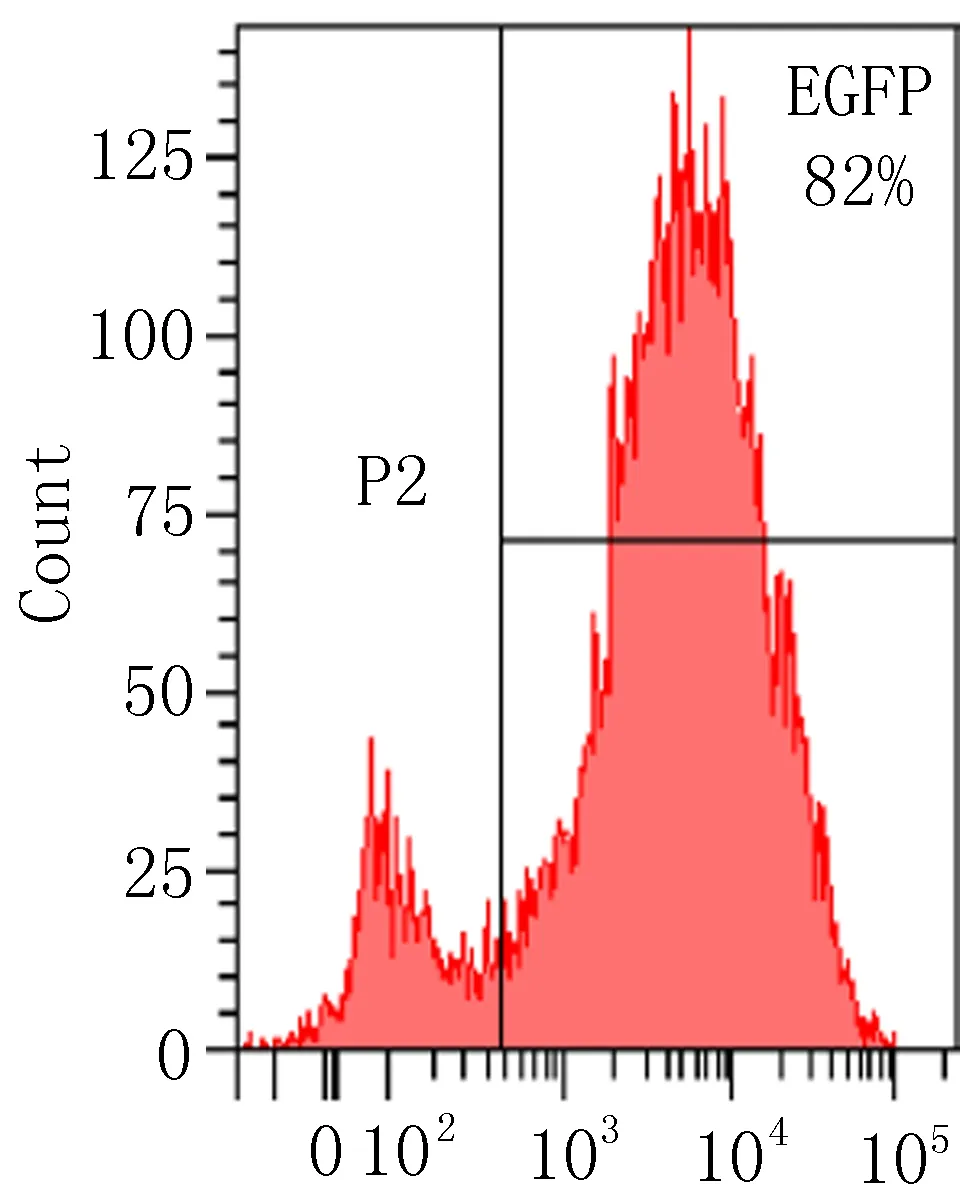
LV-(TGF-β3)-ADSCs组(MOI=50)

LV-ADSCs组(MOI=50)

LV-(TGF-β3)-ADSCs组(MOI=100)
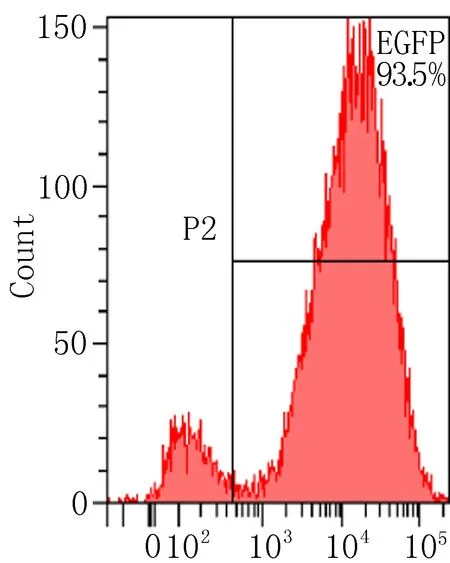
LV-ADSCs组(MOI=100)
图2 流式细胞仪检测转染效率

2.3 CCK-8检测不同滴度慢病毒感染ADSCs细胞毒性根据检测结果绘制生长曲线,各组脂肪间充质干细胞生长曲线约呈“S”形,见图4,生长潜伏期为1 d,细胞第2天进入对数生长期,慢病毒载体转染后的细胞第4天达生长高峰而后逐渐进入平台期,空白组细胞第3~7天平稳增加,至第8天变缓。慢病毒载体转染脂肪间充质干细胞后对细胞无明显毒性作用。
2.4 成软骨分化相关基因Aggrecan,COL2A1,SOX-9的表达研究结果显示,在分别诱导培养7、14、21 d时,相较于空载体转染组及空白组,转染含有TGF-β3目的基因的慢病毒的脂肪间充质干细胞从基因水平均可合成更多的成软骨分化相关的Aggrecan(P<0.01)、SOX-9(P<0.001)及COL2A1(P<0.001),见表2~4。

图4 慢病毒转染脂肪间充质干细胞的生长曲线
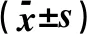
表2 慢病毒转染ADSCs诱导培养7d时成软骨分化相关基因的表达
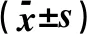
表3 慢病毒转染ADSCs诱导培养14 d时成软骨分化相关基因的表达
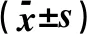
表4 慢病毒转染ADSCs诱导培养21 d时成软骨分化相关基因的表达
3 讨论
由于颞下颌关节软骨缺乏血管神经分布,任何形式的软骨损伤后其自身几乎无本体修复能力。因此对于软骨退行病变的解决方式青睐于组织工程化软骨的应用。组织工程的研究方向也从早期软骨膜及骨膜移植到自体软骨软骨细胞回植,目前干细胞联合生物材料及生长因子植入损伤部位为组织工程主要办法。
在软骨组织工程中细胞因子起到调控促进作用,TGF-β家族在诱导间充质干细胞向软骨细胞分化过程中至为关键。在成软骨分化的工程中TGF-β主要通过上调基质中胶原、蛋白多糖含量,下调金属蛋白酶含量途径二者协调以发挥最终作用。有研究指出TGF-β超家族分子参与了软骨内成骨的整个过程。在此需要指出的是,在TGF-β家族中TGF-β1、TGF-β2优势诱导细胞成骨[4-5],而TGF-β3[6]可诱导细胞成软骨分化,TGF-β3可增加软骨外基质成分,并且具有合成硫酸糖胺聚糖的作用。本实验通过使用TGF-β3生长因子以刺激ADSCs向软骨方化。
ADSCs在组织工程中的广泛应用[7-9],本研究前期研究已通过体外分离培养ADSCs并进行成脂、成骨及成软骨的诱导分化,证明干细胞的特性。生长因子在这一过程的作用尤为重要。在软骨组织工程中外源性添加生长因子对促进种子细胞生物活性的影响不稳定,细胞增殖传代后易丢失相关属性。内源性基因修饰的方式能够保持种子细胞的活性,可在软骨受损局部区域持续释放最佳浓度的细胞因子,使种子细胞分泌目的蛋白,从而促进组织再生。慢病毒载体 (lentivirus vector, LV)可感染分裂及非分裂期细胞[10],能将选定的目的基因转载至细胞中以调节细胞分泌,一方面这种作用可稳定存在,另一方面同时也有免疫原性低等优点[11],因此慢病毒载体一种较为理想介质运用在基因修饰中。
本研究根据前期预实验设置感染复数为50、100,将TGF-β3基因转染ADSCs中转染组结果无明显差异。激光共聚焦显微镜的结果中可以观察到TGF-β3慢病毒转染的ADSCs的长梭形细胞形态优于慢病毒空载体转染后ADSCs的形态,结果说明慢病毒对细胞形态有一定的影响,TGF-β3对脂肪间充质干细胞形态的维持有一定作用。根据CCK-8法检测转染后细胞的生长曲线结果显示,细胞生长状态良好,慢病毒对细胞的毒性小。可能的原因为:慢病毒中的对宿主及细胞由影响的片段已经被剔除,替换为外源性引入的TGF-β3目的基因,感染目的细胞后慢病毒并不会利用宿主细胞产生新的病毒颗粒,较为安全[12]。并且在实验过程中,慢病毒转染8~12 h后及时将病毒感染液弃除,每日更换完全培养基以供分裂增殖是需要的营养物质,也是对局部细胞生长微环境的更新及维持。但空白组细胞增殖平台期为第3~7天,维持时间较慢病毒转染组长,考虑原因为转染组细胞增殖速度较快,第3~5天CCK-8吸光度介于空白组上方,间接反映转染组细胞数量多于空白组,ADSCs贴壁生长,生长空间有限,细胞增殖较快易形成接触抑制,使得平台期维持较短,提前进入稳定期。TGF-β3诱导ADSCs向软骨细胞方向分化,软骨实质细胞增殖缓慢,且易去分化,可影响细胞增殖。且TGF-β3可诱导干细胞分泌软骨细胞外基质,细胞间交通发生变化。基于以上两点,TGF-β3转染组增殖平台期维持时间短于空白组。结合激光共聚焦细胞形态的获取,比较TGF-β3目的基因转染组,慢病毒空载体转染组细胞发生形态改变,由长梭形转变为短梭形或者不规则型,贴壁细胞在形态学发生转变的过程中易脱壁发生细胞数量的丢失,继而使得慢病毒空载体转染组平台期维持短于空白组。同时也可以解释后续PCR检测成软骨相关基因及蛋白在空载体组表达较低的原因。
Aggrecan、SOX-9及Ⅱ型胶原(COL2)与成软骨分化密切相关。其中COL2是软骨细胞外基质主要组成部分,SOX-9在软骨形成中至关重要[13],Aggrecan对软骨细胞外基质的有稳固作用。本实验研究中,将TGF-β3目的基因内源性通过慢病毒基因载体转染整合至ADSCs,从而过表达成软骨分化相关的基因及蛋白。通过实时定量PCR检测结果显示:与空白组比较,转染含有TGF-β3目的基因的慢病毒的脂肪间充质干细胞可以合成更多的成软骨分化相关的Aggrecan、SOX-9及COL2A1。这些软骨细胞外基质含量增多,构建局部微环境,促进细胞间通讯,这是一种相互促进的正反馈结果。综合以上三种细胞外基质成分及水平,从而可以得出以下结论:TGF-β3转染时慢病毒滴度越高,ADSCs合成的细胞外基质含量就高。慢病毒将TGF-β3目的基因转染至ADSCs中,慢病毒数量越多,代表着有更多的细胞遗传物质中有TGF-β3的整合参与,从而促进更多的细胞合成相关成软骨分化的基质。
随着Aggrecan、SOX-9及COL2A1的表达增高,可以形成更多的细胞外基质,构建一个良好的成软骨分化的微环境。但是本研究存在不足之处在于缺乏满意的支架材料来承载TGF-β3慢病毒转染的ADSCs,也缺乏相应的体内实验,后续研究内容应着重以上两个方面进行。综上,TGF-β3目的基因由慢病毒载体导入细胞内,是诱导ADSCs成软骨分化的理想的途径。因此经TGF-β3基因修饰的ADSCs可以作为软骨组织工程的种子细胞来源,为修复软骨缺损及关节退行性病变带来希望。
