柑橘U-box基因家族的鉴定及表达分析
2019-06-22李秋月张亚飞彭洁王旭张志强戴祥生江东
李秋月,张亚飞,彭洁,王旭,张志强,戴祥生,江东,2
柑橘U-box基因家族的鉴定及表达分析
李秋月1,张亚飞1,彭洁1,王旭1,张志强1,戴祥生3,江东1,2
(1西南大学柑橘研究所,重庆 400712;2中国农业科学院柑橘研究所,重庆 400712;3井冈山农业科技园管理委员会,江西井冈山 343000)
【】通过生物信息学分析U-box在柑橘基因组中的分布、结构及进化,研究家族成员在不同组织中的表达特异性以及对非生物胁迫和激素的响应,解析柑橘U-box基因家族的生物学功能。根据已经报道的拟南芥U-box基因,利用Phytozome数据库中的BLASTp工具鉴定柑橘基因组中的U-box基因。采用MEGA6.0、Cello、SMART、GSDS2.0、ExPASy和MapChart等软件构建系统进化树、亚细胞定位预测、预测蛋白的相对分子质量与等电点等理化性质、绘制家族成员Scaffold定位图等,分析U-box基因家族在低温胁迫下表达模式,利用实时荧光定量PCR技术(qRT-PCR)检测柑橘U-box基因家族部分成员在NaCl、PEG6000和不同激素处理下的表达情况。从柑橘克里曼丁()全基因组中鉴定出56个基因家族成员,可将其分为7类,即U-box only、U-box+ARM-1、U-box+WD40-1、TPR+U-box、Kinase+U-box、U-box+ARM-2和U-box+WD40-2。该家族蛋白理论等电点分布在5.19—9.14,编码的氨基酸数目介于281—1 441;亚细胞定位预测结果显示该基因家族成员位于细胞不同位置,主要位于细胞核或叶绿体,少数位于质膜;聚类分析发现,柑橘U-box与单子叶植物水稻的亲缘关系较远,柑橘中具有相同结构域的成员和拟南芥具有相同结构域的成员聚在一起,表明柑橘U-box成员具有不同生物学功能;Scaffold定位分析发现,56个U-box成员分布在1—9Scafflod上且呈不均分布。在冷胁迫下的RNA-Seq分析结果表明,U-box基因家族参与植物对冷胁迫的应答,并表现出4种不同的应答模式;从柑橘U-box基因家族的5个不同簇上分别选取1个代表基因进行qRT-PCR,分析结果表明,在金柑的各个组织中均有表达,和CcPUB4主要在茎和花中表达,CcPUB10主要在花、茎和幼果中表达,主要在叶和茎中表达,体现了不同U-box成员的组织特异性的表达差异。CcPUB4和在NaCl胁迫下表达均上调,而在盐胁迫下的表达无明显变化。在Na2CO3处理下表达明显上调,与NaCl处理存在一致的表达趋势,而CaCl2处理下的表达与NaCl处理下的表达趋势却存在差异。在PEG6000的处理条件下,的表达量呈现先上升后下降的趋势,CcPUB9、和在PEG6000的处理下无明显变化。在赤霉素(GA3)处理下,CcPUB4在3 h时明显上调,在生长素(IAA)和脱落酸(ABA)下呈现无规律变化,CcPUB10在ABA处理下表达量表现出逐渐上升。从柑橘克里曼丁全基因组上鉴定出56个U-box基因成员,各成员均含有U-box保守结构域,并位于细胞的不同位置。U-box基因家族参与植物对冷胁迫的应答并表现出4种不同的应答模式,在NaCl、PEG6000和激素处理下,CcPUB4和有不同程度的响应,而CcPUB9和响应不明显或未响应。
柑橘;基因家族;激素;胁迫;基因表达
0 引言
【研究意义】柑橘是世界范围内重要的热带、亚热带经济类果树之一,但由于生物胁迫、非生物胁迫等原因严重影响了其产量和品质,造成较大的经济损失。U-box基因参与生物胁迫与非生物胁迫的应答,并对不同的激素处理具有不同的应答模式。本研究利用生物信息学的方法对柑橘全基因组的U-box基因家族进行全面分析,深入了解柑橘生长发育和逆境响应的分子基础,研究结果对于认识柑橘U-box的功能和进一步培育或改良柑橘抗性品种具有重要意义。【前人研究进展】泛素26s蛋白酶体途径(ubiquity-26s proteasomepathway,UPP)是目前己知所有真核生物体内具有高度选择性的蛋白降解途径[1],早期的泛素化主要由E1、E2和E3这3种酶来完成。E1激活酶负责激活泛素,E2耦联酶可直接将泛素转移到底物蛋白质,或者同泛素一起转移给E3连接酶[2]。决定底物蛋白特异性识别的E3连接酶,根据作用机理和亚基的组成可以分为4类:单亚基泛素连接酶,包括HECT(homologous to E6-AP COOH-Terminus)、U-box、RING(really interesting new gene)、多亚基泛素连接酶,如cullin-RING(CRLs)[3]。U-box域在植物、动物和酵母等真核生物中高度保守,由70多个氨基酸残基构成,最早从酵母UFD2(ubiquitin fusion degradation protein-2)中发现[4]。U-box蛋白参与蛋白泛素化降解,同时也对细胞进行自身功能调控,并对生物胁迫、非生物胁迫、生长发育以及对激素做出响应[5-8]。GONZALEZ-LAMOTHE等[9]表明在烟草与番茄中参与多个抗病基因介导的抗性反应;同时,U-box泛素连接酶在低温、干旱、盐胁迫及光胁迫等非生物胁迫的过程中发挥重要作用,拟南芥中的、、、,辣椒的及大豆中的响应植物对低温、高盐和干旱的相应过程[10-12];除此之外,一些研究还发现U-box泛素连接酶调控植物的生长发育,BRAUMANN等[13]发现缺失U-box E3泛素连接酶能够导致brh2和ari-l突变体发生矮化;U-box蛋白可参与植物激素调控通路,拟南芥U-box泛素连接酶与脱落酸(ABA)信号通路有关[14],在ABA处理下,U-box蛋白在细胞中重新分配,与野生型相比,突变体种子在萌发时对ABA耐受性增强。综上所述,U-box蛋白具有多种生物学功能,在调节植物的生长发育及生物胁迫与非生物胁迫方面具有重要作用,因此备受研究者的关注。【本研究切入点】U-box基因家族广泛参与植物生物胁迫与非生物胁迫响应,但目前对U-box家族的研究主要集中在拟南芥、棉花、番茄、水稻和苜蓿等模式植物中,在柑橘中对U-box基因家族进行鉴定和分析尚未见报道。柑橘克里曼丁()的全基因组测序已经完成[15],为进一步研究柑橘相关基因的功能及其相互之间的关系奠定了基础。【拟解决的关键问题】本研究利用生物信息学的方法对柑橘U-box基因家族成员进行鉴定,并对该家族的基本信息、保守结构域、Scafflod定位等进行预测分析,利用qRT-PCR技术进行组织表达模式及对非生物胁迫和激素的响应进行表达分析,为阐明柑橘U-box基因家族成员的生物学功能奠定基础。
1 材料与方法
试验于2018年5—10月在中国农业科学院柑桔研究所资源育种室进行。
1.1 柑橘U-box基因家族成员鉴定
柑橘克里曼丁橘()的基因组和蛋白组数据下载于公共数据库Phytozome(https:// phytozome.jgi.doe.gov);在拟南芥数据库(http://www. arabidopsis.org/browse/genefamily/pub.jsp)下载拟南芥U-box基因家族基因序列和蛋白序列。利用3种方法鉴定柑橘中的U-box基因。(1)首先以拟南芥中已经鉴定出的64个U-box基因家族成员的蛋白序列在克里曼丁蛋白质组数据库进行在线BLAST搜索;(2)同时在Pfam数据库(http://pfam.xfam.org/)中下载所有物种U-box结构域序列(PF04564),利用Hmmer2.3.2(http://hmmer.janelia.org/)构建隐马氏模型,在Phytozome的克里曼丁蛋白数据库中搜索含有U-box结构域的序列;(3)合并(1)和(2)的结果,去除无完整读码框的序列。将得到的结果使用在线工具SMART(http://smart.embl-heidelberg.de/)进一步分析结构域,去除不包含U-box结构域的序列,最终得到柑橘U-box家族所有基因。将得到的U-box成员按照Scafflod定位进行命名,如:Cc为缩写,是基因家族的缩写,1是根据在Scafflod上的位置给这个成员的序号。对柑橘U-box蛋白的分子量和等电点预测使用ExPASy Proteomics Server(http://www.expasy.org/proteomics)。同时用在线软件MBC(http://cello.life.nctu.edu.tw)对柑橘U-box蛋白进行亚细胞定位预测。
1.2 柑橘U-box家族系统进化及蛋白结构域分析
利用MEGA5.2中的MUSCLE程序将鉴定到的柑橘U-box家族蛋白序列进行多重序列比对,并利用邻接法(Neighbor-Joining,NJ)构建系统进化树。U-box基因家族蛋白的结构域使用在线工具SMART。
1.3 柑橘U-box家族基因结构及Scafflod定位分析
在phytozome数据库中下载已鉴定的柑橘U-box基因的DNA序列,用GSDS(http://gsds.cbi.pku.edu. cn/)制作基因结构图。同时获得基因的位置信息,基因的Scafflod定位图用MapChart软件展示。
1.4 柑橘U-box基因家族的启动子分析
从克里曼丁全基因组数据库中提取每个柑橘U-box基因起始密码子上游2 000 bp基因组序列,顺式作用元件预测使用PlantCARE(http://bioinformatics. psb.ugent.be/webtools/plantcare/html/)。
1.5 试验材料与处理
选用锦橙(Osbeck.)为试材。2018年10月在中国农业科学院柑橘研究所国家果树种质(重庆)柑橘圃采集锦橙果实,将种子去皮,放在湿润的培养皿中;然后将其放入28℃的培养箱中进行催芽。选取萌发整齐一致的种子,播种于填装有混合基质的盆中,置人工气候箱培养(温度28℃,光照16 h/黑暗8 h),当第一片真叶充分展开后,选取长势一致的幼苗进行非生物胁迫和激素处理。激素包括GA3(0.5 mmol·L-1)、ABA(100 µmol·L-1)、IAA(20 µmol·L-1);非生物胁迫包括高盐NaCl(300 mmol·L-1)、10%(ω)PEG6000。具体步骤如下:在室温下,将幼苗洗净,放入盛有激素或10 µmol·L-1DMSO(激素处理的平行对照)或H2O(非生物胁迫的对照)的灭菌瓶中摇匀,使根系充分接触液体。分别在处理后的0、3、6、12和24 h收集幼苗,3次生物学重复,放入液氮速冻,-80℃保存备用。
为说明在NaCl条件下是受Na+还是Cl-影响,选用对盐敏感的大果枳(Raf.),用Na2CO3(6.25 g·L-1)和CaCl2(10.1 g·L-1)进行处理。处理方式同上。
采集同一时期罗浮金柑(Swing)的茎、嫩叶、花、幼果,液氮速冻,-80℃保存,用于分析U-box家族成员表达的组织特异性。
1.6 柑橘U-box家族基因的冷胁迫表达模式分析
在NCBI数据库中下载枳在冷胁迫、干旱胁迫和盐胁迫下及4个冷处理下的文库(GSE67439_pooled- Unigene.fa.gz)并建立本地数据库,用柑橘U-box家族基因的CDS序列在数据库中blast,找到相应基因的RNA-Seq编号,然后下载4个冷处理下表达数据,提取出U-box家族基因的表达量数据,利用在线软件Morpheus(https://software.broadinstitute.org/morpheus/绘制表达量热图。
1.7 总RNA提取与cDNA合成
使用RNAprep pure植物总RNA提取试剂盒(DP432,天根)提取植物总RNA。使用PrimeScriptTMRT reagent Kit With gDNA Eraser(Perfect Real Time)(RR047,TaKaKa)试剂盒,将RNA反转录成cDNA供荧光定量使用。
1.8 实时荧光定量 PCR
使用Prime3设计引物,引物信息见表1。内参为柑橘-,在CFX96 TouchTM荧光定量PCR仪上对柑橘U-box家族的部分成员的表达量进行分析。扩增体系含2 μL cDNA,上、下游引物各0.5 μL,SYBR 6.25 μL反应Mix,3.25 μL ddH2O,总体系12.5 μL。反应程序为:95℃ 30 s,95℃ 5 s,60℃ 34 s,95℃ 15 s,60℃ 60 s,95℃ 15 s,共40个循环。每个处理3次重复。用SPSS软件进行差异显著性分析,<0.05表示差异显著。

表1 本试验所用引物
2 结果
2.1 柑橘U-box基因家族成员信息
通过在线BLAST比对以及Hmmer搜索,经过SMART服务器分析去除不含U-box结构域的序列,从柑橘基因组中鉴定出56个U-box基因,并且56个柑橘U-box蛋白均含有62—68个氨基酸的U-box结构域,其中40个U-box蛋白的U-box保守结构域都含有63个氨基酸,表2所示。通过ExPASy工具分析,柑橘中最长的U-box蛋白(Ciclev10024300m)包含1 441个氨基酸残基,分子量也为56个蛋白质中最大,为160.62 kD,最短的U-box蛋白(Ciclev10032341m)包含281个氨基酸残基,分子量是56个蛋白中最小的。等电点范围为5.19(Ciclev10030837m)—9.14(Ciclev10011217m)。利用Cello软件对柑橘U-box家族成员进行亚细胞定位分析,结果显示该基因家族成员位于细胞不同位置,其中和定位于质膜,、、、、存在于细胞质,其他成员位于细胞核或叶绿体。
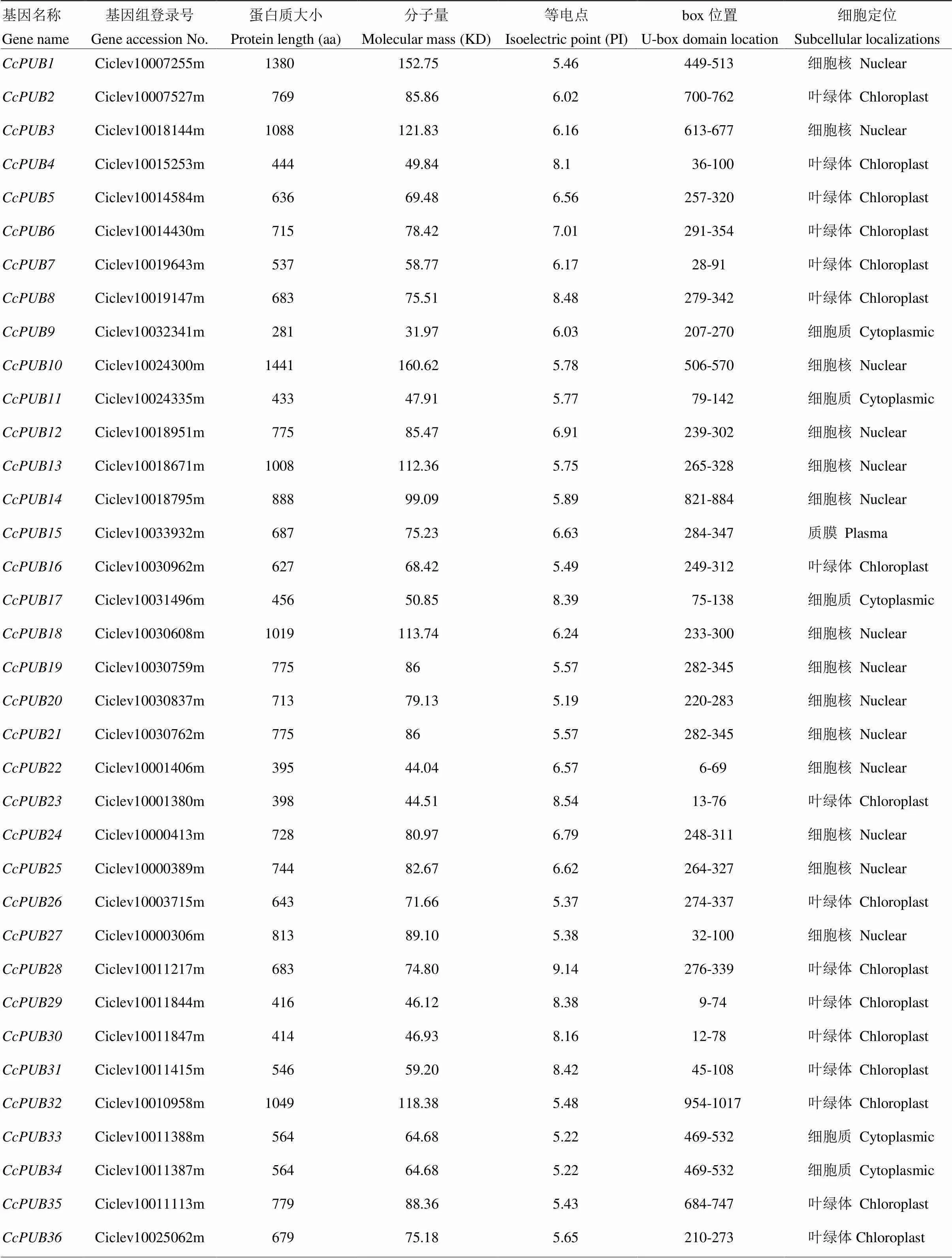
表2 柑橘基因组中的U-box基因

续表2 Continued table 2
2.2 柑橘U-box家族系统进化及蛋白结构域分析
为研究柑橘U-box基因家族系统进化关系,对56个柑橘U-box蛋白构建了系统进化树,经过SMART蛋白结构域分析,结果显示除U-box结构域外,柑橘U-box蛋白还含有其他结构域。根据进化树以及蛋白结构域(图1),将柑橘中的56个U-box蛋白分为7种类型,即U-box only、U-box+ARM-1、U-box+ARM-2、Kinase+U-box、U-box+WD40-1、U-box+WD4-2和TPR+U-box类,每一类型分别有17、16、5、8、3、2和5个U-box蛋白。U-box only结构的成员在柑橘中最多,共17个。ARM亚家族在植物中研究较多,并在水稻和拟南芥中都为最大亚类[16],而在柑橘中为第二大亚类。Kinase亚家族有8个成员,其中3个包含有丝/苏/酪蛋白激酶结构域(STYKc domain),另外5个为丝/苏氨酸蛋白激酶结构域(S_TKc domain)。同时本研究发现其中76%的U-box家族成员的U-box结构域位于N末端,而U-box结构域位于C末端的成员比较少,U-box结构域位于N末端的聚在一起,位于C端的聚为另一类。位于同一亚家族U-box蛋白含有的结构域种类和数量具有较高的一致性。
为深入研究单子叶植物水稻U-box基因家族与双子叶植物柑橘和拟南芥U-box基因家族的进化关系,对柑橘(56个)、水稻(77个)和拟南芥(64个)共197个U-box蛋白进行了系统进化树构建(图2)。根据亲缘关系远近可将197个U-box蛋白分为7个亚家族,分别含有52、59、46、13、2、3和20个U-box基因。双子叶和单子叶植物的U-box家族成员在7个亚家族内均有分布。第Ⅰ亚家族和第Ⅱ亚家族含有的结构域较单一,而其他亚家族含有多种不同的结构域。和单独聚在一个小分支上,在拟南芥中未发现与其高度同源的序列。和进化距离最近,推测其在功能上具有一定的相似性。
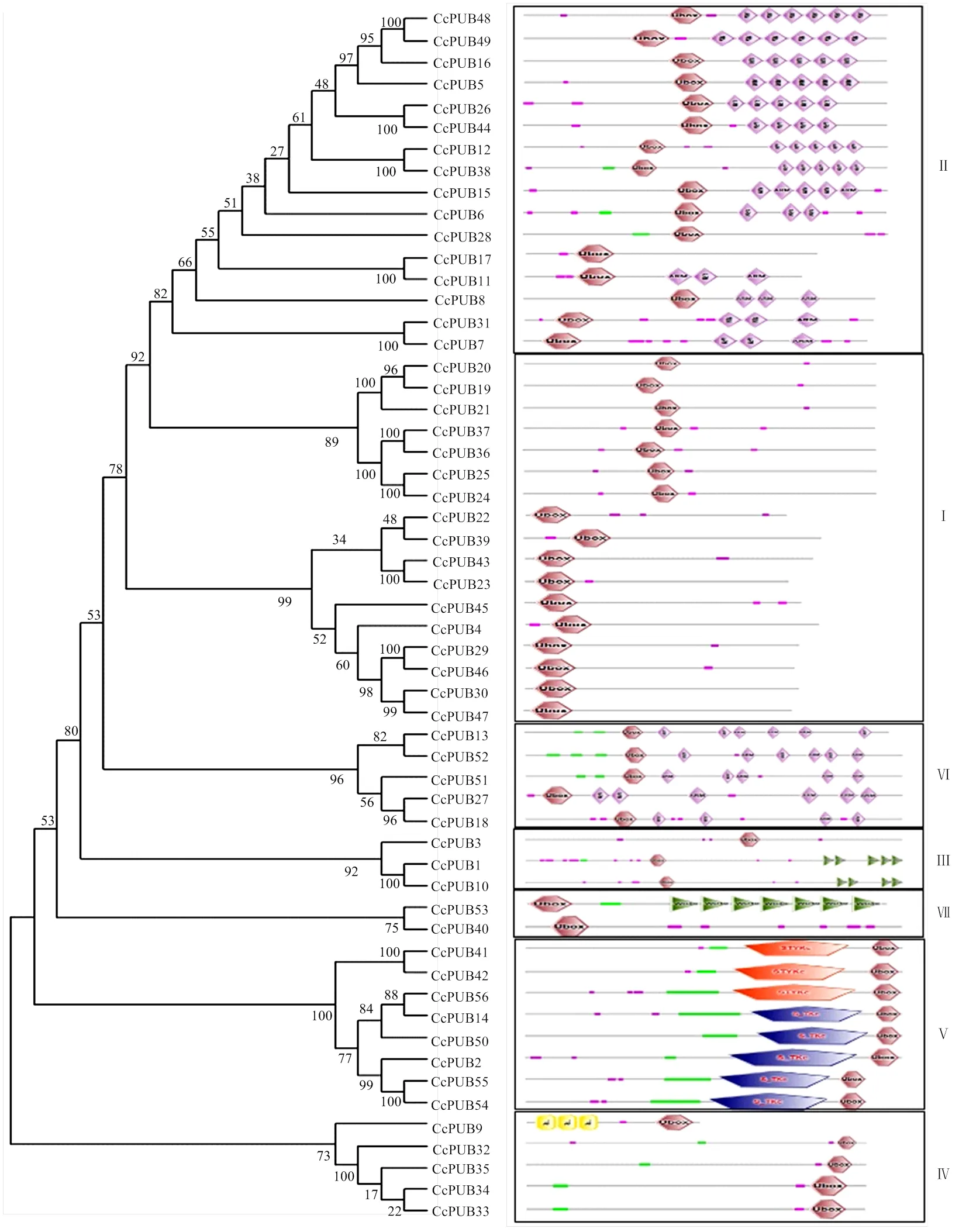
Ⅰ:U-box only;Ⅱ:U-box+ARM;Ⅲ:U-box+WD40_1;Ⅳ:TPR+U-box;Ⅴ:Kinase+U-box;Ⅵ:U-box+ARM_2;Ⅶ:U-box+WD40_2

图2 柑橘、拟南芥和水稻U-box家族蛋白的系统进化树
2.3 柑橘U-box家族基因结构及染色体定位分析
利用GSDS软件对U-box家族各成员的基因结构进行了分析。结果显示(图3),柑橘U-box家族的基因结构存在较大的差异,外显子数目为1—16个,内含子数目为0—15个。对基因结构进一步分析发现,U-box only亚家族的基因结构较简单,一半成员都不含内含子;含有U-box和ARM结构域的成员中多数基因含有3个内含子;含有U-box和Kinase结构域的成员的基因结构极为相似,内含子数目在6—9个;具有U-box和WD40结构域的成员所含内含子数目最多,内含子数在12—15个;含有TPR和U-box结构域的成员含有7个内含子。
根据U-box家族在Scafflod的位置信息,利用MapChart软件获得了56个U-box基因在柑橘Scafflod上的分布图(图4)。由图可知,柑橘U-box家族成员在Scafflod上呈不均分布。在3号、6号和8号Scafflod上分布最多,含有8个U-box基因,而1号Scafflod上分布的U-box基因最少,只含有2个U-box成员。进一步分析发现,U-box在Scafflod上呈现区域性,从4号、5号、6号、7号和8号Scafflod中可以看到,在Scafflod上的某个区域家族成员比较集中。

图3 56个柑橘U-box基因的结构分析

图4 柑橘U-box基因在Scafflod上的定位(Mb)
2.4 柑橘U-box基因家族的启动子分析
分析基因启动子的作用元件可以预测基因的潜在功能,为了解柑橘U-box家族应答生物胁迫和非生物胁迫反应的潜在机制,本研究分析了柑橘U-box家族的启动子的顺式作用元件。结果表明,该家族的启动子区域富含响应植物激素和逆境胁迫的顺式作用元件(表3)。几乎所有柑橘U-box基因启动子区至少含有一个植物激素响应元件,包括赤霉素响应元件GARE-motif,乙烯响应元件ERE,MeJA响应元件TGACG-motif和脱落酸(ABA)响应元件ABRE等,51个U-box基因(占总基因数91.1%)至少含有一种生物或非生物胁迫响应元件,非生物响应元件包括光响应元件G-box、低温胁迫响应元件LTR、冷和脱水响应元件DRE等。

表3 PlantCARE预测CcPUB基因家族启动子区顺式作用原件
2.5 U-box家族基因的表达分析
2.5.1 组织特异性 为了解柑橘U-box基因家族5种结构域(U-box only、U-box+ARM、U-box+WD40、Kinase+U-box、TPR+U-box)的组织表达模式,分别从5种结构域中选取1个代表基因进行组织特异性分析,利用qRT-PCR分析其在金柑嫩叶、幼果、茎和花中的相对表达量。由图(5)可看出,这5个基因在各个组织中均有表达。其中和8在幼果中表达量都较低,而CcPUB10主要在幼果中表达,CcPUB4主要在花中表达,CcPUB41和CcPUB48主要在茎中表达。

不同小写字母表示差异显著(P<0.05)。下同
2.5.2 激素对表达的影响 利用qRT-PCR分析柑橘U-box基因家族中5个代表基因在ABA、GA3和IAA处理下的相对表达量(图6)。除了CcPUB9、和不响应ABA、GA3和IAA外,CcPUB4和对各处理表现出不同的表达模式。在ABA和IAA处理下,CcPUB4的表达量在0—12 h无明显变化,在处理24 h后CcPUB4的表达明显受到抑制,而在GA3处理3 h后表现为上调,的表达量是对照的4倍。在ABA的处理下表达呈现上升的趋势,而在GA3处理24 h后表达下调,在IAA的处理下无明显变化。上述结果表明,激素能够诱导CcPUB4基因的表达。
2.5.3 非生物胁迫对表达的影响 在盐胁迫条件下,CcPUB4CcPUB9和表达均上调,且CcPUB4、呈现相似的表达趋势,而的表达不受NaCl的诱导(图7)。在PEG6000的处理条件下,的表达量呈现先上调后下降,而CcPUB9、和在PEG6000的处理下无明显变化,在PEG6000条件下无规律变化。
2.5.4 Na2CO3和CaCl2条件下,的相对表达量 由于植物在盐胁迫的条件下会改变细胞中已有的Na+和Cl-平衡,通过上述的非生物胁迫的结果发现,在NaCl条件下显著表达,但是并不能确定该基因是受NaCl中哪种离子的影响,因此,采用相同浓度的Na+和Cl-对枳壳进行处理。结果显示在Na2CO3条件下显著上调,并且与在NaCl条件下的表达趋势相似,在CaCl2条件下的表达趋势却与在NaCl条件下的表达趋势不同(图8)。
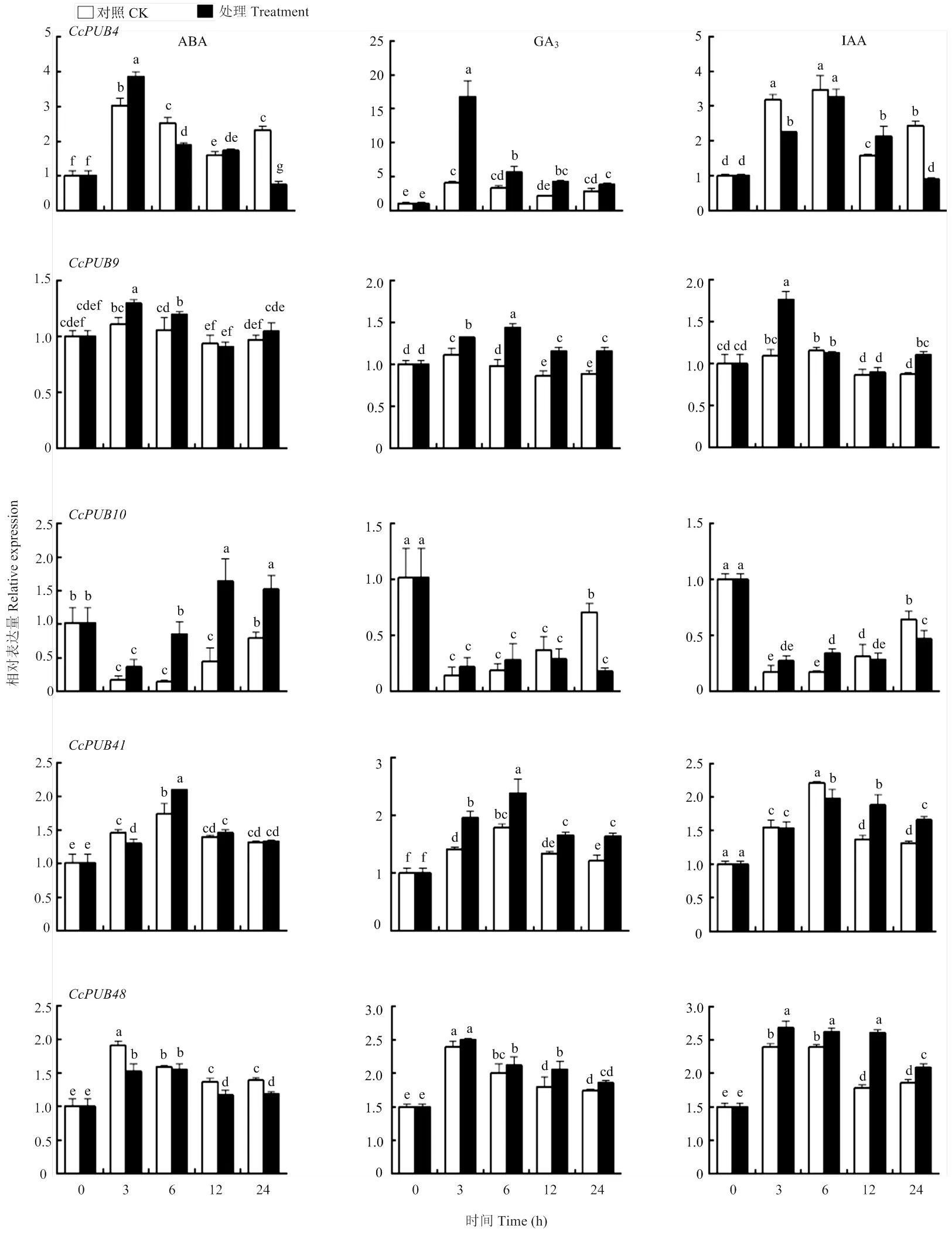
图6 不同外源激素处理条件下CcPUB4、CcPUB9、CcPUB10、CcPUB41和CcPUB48的相对表达量

图7 非生物胁迫下CcPUB4、CcPUB9 、CcPUB10、CcPUB41和CcPUB48的相对表达量
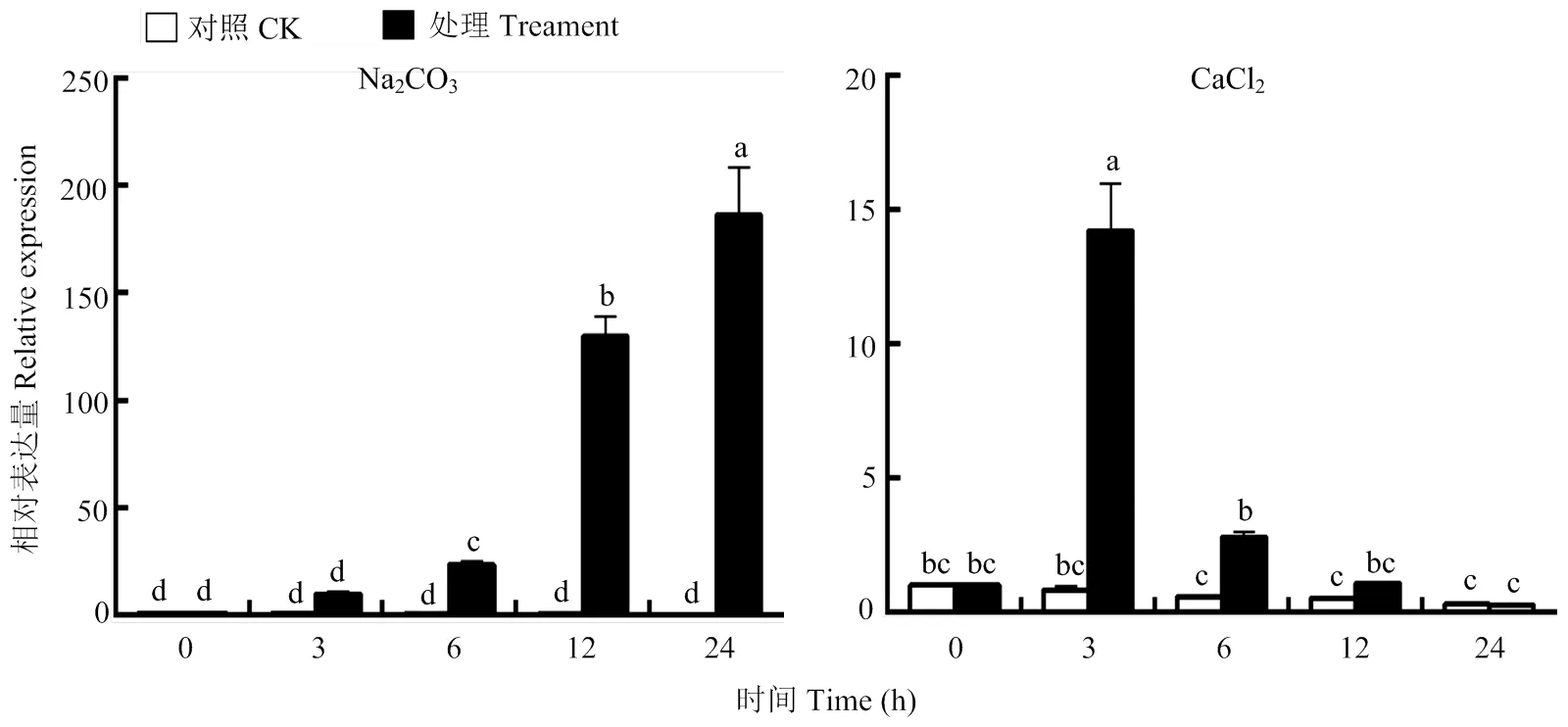
图8 在Na2CO3和CaCl2胁迫下CcPUB4的相对表达量
2.5.5在冷胁迫下的表达模式分析 柑橘U-box蛋白可参与调节植物对非生物胁迫的应答,因此,利用枳的RNA-Seq数据分析该基因家族在冷胁迫下的表达模式。在干旱胁迫、盐胁迫和冷胁迫的RNA-Seq文库中,找到47个U-box基因序列,其中35个基因在0、6、24和72 h冷胁迫下有表达数据,其他12个在冷胁迫下没有表达数据(、、、、、、、、、、、)。利用Morpheus绘制35个U-box基因的表达热图,分析显示,这35个基因在冷胁迫下具有表达差异,并且在冷胁迫下具有4种不同的应答模式(图9),、、、、聚在一分支,在冷胁迫下它们的表达量是先下降再上升;、、、、、和聚在一分支,在冷胁迫下它们的表达量降低;、、、、、、和聚在一分支,在冷胁迫下它们的表达量先上升再下降;、、、、、、、、、、和聚在一分支,该分支的基因都响应冷胁迫,所有基因的表达量都上升。进一步的分析发现,一些进化关系比较接近的U-box基因,在冷胁迫下具有相同的表达模式并聚在一起,如CcPUB40和CcPUB53,CcPUB36和CcPUB37,CcPUB19、CcPUB20和CcPUB21。
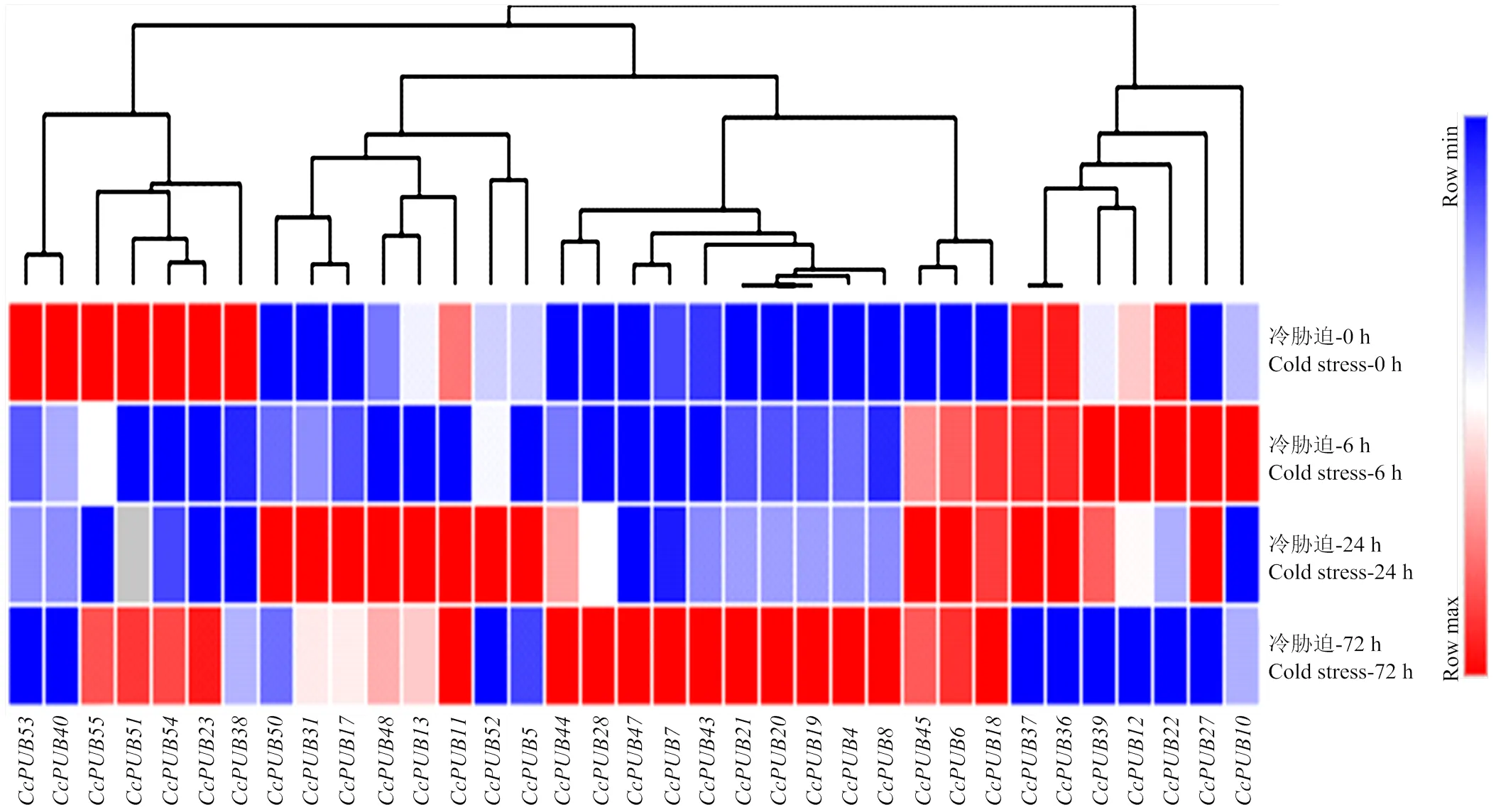
图9 柑橘U-box家族在冷胁迫下的表达谱分析
3 讨论
U-box基因家族是一类具有U-box结构域的基因家族,其所编码蛋白大部分是泛素系统中决定底物识别特性的泛素连接酶E3。从酵母到人类,几乎所有真核生物都含有U-box蛋白,尤其是植物体内大量存在该类蛋白,如苜蓿中有41个U-box基因[16],拟南芥基因组中存在64个U-box基因[17],水稻()中已鉴定出77个带有U-box结构的基因[18],番茄中鉴定出56个U-box基因[19],雷蒙德氏棉中有93个基因家族成员[20],人有21个U-box基因[21]。本研究从克里曼丁全基因组数据库中获得了56个U-box基因成员,与番茄中U-box成员数相同,而少于拟南芥和水稻中的成员数,表明不同物种的U-box成员数存在差异。虽然番茄的U-box数量与柑橘中的数量一样多,但其基因组大小约为900 Mb[22],远大于柑橘301.4 Mb[15],由此可见U-box基因家族成员的多少与基因组大小没有直接关系,这与郑兴卫等[16]在苜蓿U-box基因家族研究中的结论一致。柑橘U-box基因家族的蛋白质大小在31.97—160.62 kD之间,PI在5.19—9.14之间,表明柑橘U-box基因家族成员间的蛋白质大小、PI等特征差异较大。除了含有U-box结构域外,U-box蛋白中还存在ARM、WD40和TPR二级结构域,这些结构域主要用来介导U-box蛋白与底物蛋白的特异性识别。
为了对柑橘中的U-box家族进行功能归类,利用聚类分析法构建柑橘、水稻和拟南芥的U-box家族系统进化树,由于U-box基因的保守性,具有相似或者相同功能的基因位于同一组,这为研究该基因家族相关基因的功能提供了可靠的依据。在拟南芥中一些成员的功能已经得到验证:TPR+U-box亚家族中的参与非生物胁迫调节,在低温和黑暗条件下,改变应激反应信号转导中PP2A的活性,从而对非生物胁迫做出响应[23],柑橘与拟南芥聚在一起,具有较近的亲缘关系,猜测TPR+U-box亚家族其他成员在柑橘中起着同样的作用。U-box+ARM是研究最多的亚家族,属于U-box+ARM亚家族的、、和在干旱胁迫中起着重要作用[24-25],能正调控细胞凋亡和植物防御的过程[26],同时在磷酸盐饥饿条件下调控侧根的发育[27],由此推测U-box+ARM亚家族其他基因具有相同或相似的功能。U-box only亚家族的基因结构简单,在植物生长发育和非生物胁迫中发挥重要作用,齐晨辉等[28]发现过量表达的苹果愈伤组织和异位表达的拟南芥幼苗在盐胁迫条件下,生长势与野生型相比明显变弱,表明负调控盐胁迫。根据进化关系中基因的同源性,可以推测位于同一组的拟南芥在柑橘中的直系同源基因也可能参与相似的调控途径。
本研究对单子叶和双子叶植物中的U-box基因家族成员的进化关系进行分析,单子叶植物和双子叶植物在7个亚家族中均有分布,说明U-box家族在进化上较保守,U-box家族的起源出现在单双子叶植物分化之前。本研究发现第Ⅰ亚家族和第Ⅱ亚家族的U-box成员数较多,推测该亚家族中的U-box基因可能在植物的生命进程中发挥了重要的作用。在第Ⅴ亚家族中没有拟南芥的成员,可能是该亚家族的基因发生了丢失现象。和位于同一聚类组中并且位于相同的染色体上,和也出现这种紧密连锁,推测在进化的过程中这些基因可能通过染色体内的复制发生了特异性扩张,这些基因的功能有待进一步研究。
U-box基因参与了叶、花、茎和果的生长发育[29-30],本试验中的CcPUB10主要在果和花中表达,在叶中几乎不表达;CcPUB4主要在花和茎中表达,而CcPUB41和CcPUB48在茎中显著表达,表明柑橘U-box基因调控叶、花、茎和果生长发育。近年来,大量研究表明,E3泛素连接酶是一种极其活跃的激素感知成分,在激素途径的抑制解除以及激素生物合成的调控中具有重要作用[31]。本试验通过外施IAA、GA3和ABA激素处理,实时荧光定量结果显示,在GA3的处理下,上调,在ABA和IAA处理24 h表达受到抑制;在ABA的处理下呈现逐渐上调,在GA3和IAA的处理下无明显规律。U-box only亚家族的、TPR+U-box亚家族的、U-box+WD40-1亚家族的以及Kinase+U-box亚家族的均受NaCl的影响呈现上调,且在NaCl处理12 h后其表达量是对照的270倍,说明该基因可能参与了植物的盐胁迫响应,Hwang等[32]抑制拟南芥导致发芽期间对盐胁迫的耐受性增加,同时,Cho等[33]发现在拟南芥中超表达辣椒的植株耐盐性增加。在盐胁迫的条件下可破坏细胞中已有的Na+和Cl-平衡,因此本试验用Na2CO3和CaCl2对枳壳进行处理,进一步探明是外源的Na+还是Cl-会引起CcPUB4表达量上升,结果显示在Na2CO3处理下CcPUB4表达明显上调且和NaCl呈现相似的表达模式,而CaCl2处理只在处理后3 h有较高的表达水平,之后CcPUB4的表达水平降低到正常值,证实了盐胁迫下,细胞中的Na+平衡被打破。如何在盐胁迫下发挥作用,是下一步研究的重点内容。CcPUB4在PEG6000下的条件下表达量先上升再下降,其结果与拟南芥的同源基因AtPUB20在干旱胁迫下的结果一致[34],Seo等[35]研究证实U-box家族中的/和/在干旱胁迫下分别是ABA依赖和ABA非依赖途径的负调控因子。不同成员间在冷胁迫下具有不同的应答模式。通过对这35个基因的启动子分析发现,其中17个基因包含冷胁迫响应元件DRE或低温响应元件LTR,表明对冷胁迫具有响应。其中,在冷胁迫下是上调表达的并且都属于U-box only亚族,由此预测U-box only亚族在冷胁迫过程中存在着正调控作用,与同源的在冷胁迫下上调[11],Yee等[36]对拟南芥的U-box家族在冷胁迫下的表达进行分析,发现大多数U-box基因对冷胁迫都具有响应,该结果与本试验结果一致。在冷胁迫下只有35个U-box基因有表达数据,其他12个没有在冷胁迫下的表达数据,可能是由于该测序的混合池中包括盐胁迫和干旱胁迫下的表达数据[37],这12个基因只在盐胁迫和干旱胁迫下特定响应。综上可知,U-box基因家族可能参与了植物激素以及逆境响应调控。对CcPUBs基因家族的启动子分析发现,其启动子均含有逆境、激素、温度等响应顺式作用元件如G-box光响应元件、DRE冷和脱水响应元件、MBS、MYB结合位点参与干旱诱导响应元件等,该结果为柑橘U-box基因对逆境和激素的应答机制提供了理论依据。
4 结论
本研究从柑橘全基因组上鉴定出56个U-box基因成员,其蛋白均含有U-box保守结构域。除U-box only亚家族和U-box+ARM-1亚家族部分成员不含内含子外,其余成员均含有内含子,内含子数在0—15个。亚细胞定位显示柑橘U-box家族基因成员在细胞质、叶绿体、细胞核、细胞质膜中均存在。56个U-box基因分布在1—9号Scaffold且分布不均,U-box基因家族参与植物对冷胁迫的应答,并表现出4种不同的应答模式。实时荧光定量PCR结果表明,柑橘U-box基因家族表达具有组织特异性,且对激素和非生物胁迫有不同程度的响应。
[1] SMALLE J, VIERSTRA R D. The ubiquitin 26S proteasome proteolytic pathway., 2004, 55: 555-590.
[2] 刘锴栋, 袁长春. 泛素/26S蛋白酶体途径及其在植物生长发育中的功能. 基因组学与应用生物学, 2009, 28(6): 1219-1228.
LIU Y D, YUAN C C. The ubiquitin/26S proteasome pathway and the function in plant development., 2009, 28(6): 1219-1228. (in Chinese)
[3] 宋素胜, 谢道昕. 泛素蛋白酶体途径及其对植物生长发育的调控. 植物学通报, 2006, 23(5): 564-577.
SONG S S, XIE D X. The ubiquitin-proteosome pathway and plant development., 2006, 23(5): 564-577. (in Chinese)
[4] VANDEMARK A P, HILL C P. Structural basis of ubiquitylation., 2002, 12(6): 822-830.
[5] HATAKEYAMA S, YADA M, MATSUMOTO M, ISHIDA N, NAKAYAMA K I. U-box proteins as a new family of ubiquitin- protein ligases., 2001, 276(35): 33111-33120.
[6] PATTERSON C. A new gun in town: the U-box is a ubiquitin ligase domain., 2002, 2002(116): pe4.
[7] FARMER L M, BOOK A J, LEE K H, LIN Y L, FU H,VIERSTRA R D. The RAD23 family provides an essential connection between the 26S proteasome and ubiquitylated proteins in., 2010, 22(1): 124-142.
[8] VIERSTRA R D. The ubiquitin-26S proteasome system at the nexus of plant biology., 2009, 10(6): 385-397.
[9] GONZALEZ -LAMOTHE R, TSITSIGIANNIS D I, LUDWIG A A, Panicot M, Shirasu K, JONES J D G. The U-Box protein CMPG1is required for efficient activation of defense mechanisms triggered by multiple resistance genes in tobacco and tomato., 2006, 18(4): 1067-1083.
[10] CHO S K, CHUNG H S, RYU M Y, PARK M J, LEE M M, BAHK Y, KIM J, PAI H S, KIM W T. Heterologous expression and molecular and cellular characterization ofencoding a hot pepper U-box E3 ubiquitin ligases homolog., 2006, 142(4): 1664-1682.
[11] LIU Y C, WU Y R, HUANG X H, SUN J, XIE Q., a U-Box E3 ubiquitin ligase, negatively regulates abscisic acid and drought responses in., 2011, 4(6): 938-946.
[12] HWANG J H, SEO D H, KANG B G, KWAK J M, KIM W T. Suppression ofresulted in increased tolerance to salt stress during germination., 2015, 34(2): 277-289.
[13] BRAUMANN I, URBAN W, PREUβ A, DOCKTER C, ZAKHRABEKOVA S, HANSSON M. Semi-dwarf barley (L.) brh2 and ari-l mutants are deficient in a U-box E3 ubiquitin ligase., 2018, 86(2): 223-234.
[14] SAMUEL M A, MUDGIL Y, SALT J N, DELMAS F, RAMACHANDRAN S, CHILELLI A, GORING D R. Interactions between the S-Domain receptor kinases and-ARM E3 ubiquitin ligases suggest a conserved signaling pathway in., 2008, 147(4): 2084-2095.
[15] WU G, TEROL J, IBANEZ V, LOPEZ-GARCIA A, PEREZ-ROMAN E, BORREDA C, DOMINGO C, TADEO F R, CARBONELL- CABALLERO J, ALONSO R, CURK F, DU D, OLLITRAULT P, ROOSE M L, DOPAZO J, GMITTER F G, ROKHSAR D S, TALON M. Genomics of the origin and evolution of Citrus., 2018, 554(7692): 311-316.
[16] 郑兴卫, 邵麟惠, 李聪. 蒺藜苜蓿全基因组中U-box 基因家族的筛选与特征分析. 草业学报, 2015, 24(8): 130-141.
ZHENG X W, SHAO L H, LI C. Genome-wide screening and characterization of the U-box gene family in., 2015, 24(8): 130-141.(in Chinese)
[17] WIBORG J, O'SHEA C, SKRIVER K. Biochemical function of typical and variantU-box E3 ubiquitin-protein ligases., 2008, 413(3): 447-457.
[18] 曹英豪. 水稻U-box基因家族的特征及转录表达模式分析[D]. 保定: 河北农业大学, 2010.
CAO Y H. The characteristics of Rice U-Box gene family with its transcription and expression pattern analysis [D]. Baoding: Agricultural University of Hebei, 2010.(in Chinese)
[19] 李菲, 何小红, 龚记熠. 番茄基因组中U-box基因家族的鉴定与分析.分子植物育种. 2018, 16(11): 3468-3476
LI F, HE X H, GONG J Y.Identification and analysis of U-box gene family in tomato genome., 2018, 16(11): 3468-3476.(in Chinese)
[20] 刘永昌,曾丽亚,盘俊,齐成媚,袁志辉,何福林,胡克坚,刘小文. 雷蒙德氏棉Plant U-box()基因家族生物信息学分析. 分子植物育种, 2018, 16(13): 4157-4171.
LIU Y C, ZENG L Y, PAN J, QI C M, YUAN Z H, HE F L, HU K J, LIU X W. Bioinformatics analysis of the plant U-box gene families () in, 2018, 16(13): 4157-4171. (in Chinese)
[21] IGNACIO M. Ancient origin of animal U-box ubiquitin ligases., 2010, 10(1): 331.
[22] CONSORTIUM T T G. The tomato genome sequence provides insights into fleshy fruit evolution., 2012, 485(7400): 635.
[23] LUO J, SHEN G, YAN J, HE C, ZHANG H. AtCHIP functions as an E3 ubiquitin ligase of protein phosphatase 2A subunits and alters plant response to abscisic acid treatment., 2006, 46(4): 649-657.
[24] ADLER G, KONRAD Z, ZAMIR L, MISHRA A K, RAVEH D, BAR-ZVI D. Theparalogs,and, encoding U-box E3 ubiquitin ligases, are essential for plant response to drought stress., 2017, 17(1): 8.
[25] BERGLER J, HOTH S. Plant U-box armadillo repeat proteinsandare involved in salt inhibition of germination in., 2011, 13(5): 725-730.
[26] SADANANDOM A. The U-box proteinis a functional ortholog of NtACRE276 and its E3 ubiquitin ligase activity is required for plant cell death and defence. C, 2007, 146(4): S203-S203.
[27] SANKARANARAYANAN S, SAMUEL M A. A proposed role for selective autophagy in regulating auxin-dependent lateral root development under phosphate starvation in., 2015, 10(3): e989749.
[28] 齐晨辉, 赵先炎, 韩朋良. 苹果U-box型E3泛素连接酶的耐盐性和ABA敏感性鉴定. 园艺学报, 2017, 44(12): 2255-2264.
QI C H, ZHAO X Y, HAN P L. Functional identification of salt tolerance and ABA sensitivity of apple U-box E3 ubiquitin ligase., 2017, 44(12): 2255-2264. (in Chinese)
[29] LIU J, LI W, NING Y, SHIRSEKAR G, CAI Y, WANG X, DAI L, WANG Z, LIU W, WANG G L. The U-Box E3 ligase/is a convergence point of defense and flowering signaling in plants., 2012, 160(1): 28-37.
[30] SHARMA M, PANDEY G K. Expansion and function of repeat domain proteins during stress and development in plants., 2016, 6: 1218.
[31] SANTNER A, CALDERON-VILLALOBOS L I A, ESTELLE M. Plant hormones are versatile chemical regulators of plant growth., 2009, 5(5): 301-307.
[32] HWANG J H, DONG H S, KANG B G, KWAK J M, KIM W T. Suppression of,, resulted in increased tolerance to salt stress during germination., 2015, 34(2): 277-289.
[33] CHO S K, CHUANG H S, RYU M Y, PARK M J, LEE M M, BAHK Y, KIM J, PAI H S, KIM W T. Heterologous expression and molecular and cellular characterization ofencoding a hot pepper U-Box E3 ubiquitin ligase homolog., 2006, 142(4): 1664-1682.
[34] KOBAYASHI S, TSUGAMA D, LIU S, TAKANO T. A U-Box E3 ubiquitin ligase,, interacts with theG-Protein β subunit, AGB1., 2012, 7(11): e49207.
[35] SEO D H, RYU M Y, JAMMES F, HWANG J H, TUREK M, KANG B G, KWAK J M, KIM W T. Roles of FourU-Box E3 ubiquitin ligases in negative regulation of abscisic acid-mediated drought stress responses., 2012, 160(1): 556-568.
[36] YEE D, GORING D R. The diversity of plant U-box E3 ubiquitin ligases: from upstream activators to downstream target substrates., 2009, 60(4): 1109-1121.
[37] WANG M, ZHANG X, LIU J H. Deep sequencing-based characterization of transcriptome of trifoliate orange ((L.) Raf.) in response to cold stress.,2015, 16(1): 555.
Genome Wide Identification and Expression Analysis of the U-box Gene Family in Citrus
LI QiuYue1, ZHANG YaFei1, PENG Jie, WANG Xu1, ZHANG ZhiQiang1, DAI XiangSheng3, JIANG Dong1,2
(1Citrus Research Institute, Southwest University, Chongqing 400712;2Citrus Research Institute of Chinese Academy of Agricultural Sciences, Chongqing 400712;3Management Committee of Jinggangshan Agricultural Science and Technology Park, Jinggangshan 343000, Jiangxi)
【】The objectives of this study were to analyze the distribution, structure and evolution of U-box in citrus genome by bioinformatics, to study the expression specificity of family members in different tissues and their responses to abiotic stress and hormones, and to investigate the biological function of U-box gene family in citrus. 【】According to the reported U-box gene of Arabidopsis thaliana, the U-box gene in citrus genome was identified by BLASTp tool in Phytozome database. Phylogenetic tree, subcellular localization prediction, relative mass and isoelectric point and other physical and chemical properties, and scaffoldlocation of U-box member were analyzed with MEGA6.0, Cello, SMART, GSDS2.0, ExPASy and MapChart, respectively. The expression pattern of U-box gene family under low temperature stress was analyzed, and the expression of some members of U-box gene family in citrus treated with NaCl, PEG6000 and different hormones was detected by real-time fluorescence quantitative PCR (qRT-PCR)【】Fifty-six members ofgene family were identified from the whole genome of, and they could be divided into 7 categories, namely as U-box only, U-box+ARM-1, U-box+WD40-1, TPR+U-box, Kinase+U-box, U-box+ARM-2 and U-box+WD40-2. The theoretical isoelectric point of the family protein was ranged from 5.19 to 9.14, and the number of amino acids encoded was 281 to 1 441. The results of subcellular localization prediction showed that the members of the gene family were located in different positions of the cell, mainly in the nucleus or chloroplast, and a few in the plasma membrane. Cluster analysis showed that citrus U-box was closely related to monocotyledonous rice, and members with the same domain in citrus andwere clustered together. The results showed that U-box members of citrus had different biological functions, and scaffold localization analysis showed that 56 U-box members were unevenly distributed on citrus 1-9 scaffold. The results of RNA-Seq analysis under cold stress showed that U-box gene family was involved in the response of plants to cold stress and showed four different response patterns. One representative gene was selected respectively from five different clusters of citrus U-box gene family for qRT-PCR analysis. The results showed thatwas expressed in all tissues of kumquat, andandwere mainly expressed in stems and flowers,was mainly expressed in flowers, stems and young fruits, andwas mainly expressed in leaves and stems. It reflected the tissue-specific expression difference of different U-box members. The expression of,andwas up-regulated under NaCl stress, but the expression ofhad no significant change under salt stress. The expression ofwas up-regulated under Na2CO3treatment, which was consistent with that of NaCl treatment, but the expression trend of CaCl2treatment was different from that of NaCl treatment. Under the treatment of PEG6000, the expression ofincreased at first and then decreased, while,anddid not change significantly under the treatment of PEG6000. Under gibberellin (GA3) treatment,was significantly up-regulated at 3 h, while under auxin (IAA) and abscisic acid (ABA), the expression ofshowed irregular changes, and the expression ofincreased gradually under gibberellin (gibberellin) treatment.【】Fifty-six members of U-box gene were identified from the whole genome of. All members contained U-box conserved domain and were located in different positions of cells. U-box gene family was involved in the response of plants to cold stress and showed four different response patterns. Under NaCl, PEG6000 and hormone treatment,andhad different degrees of response, but,andhad no obvious or no response. This experiment provided a theoretical guidance for the further study of U-box gene family in citrus stress resistance and growth and development mechanism.
citrus;gene family; hormone; stress; gene expression
10.3864/j.issn.0578-1752.2019.11.009
2018-12-29;
2019-02-18
国家重点研发计划(2018YFD1000101)、重庆市科委重点项目(cstc2016shms-ztzx80004)
李秋月,E-mail:437010037@qq.com。通信作者江东,E-mail:jiangdong@cric.cn
(责任编辑 赵伶俐)
