亚慢性铜暴露对背角无齿蚌鳃抗氧化系统的影响
2019-06-21林子根井维鑫
林子根,井维鑫,王 兰
(山西大学生命科学学院,太原 030006)
铜(Copper,Cu)是机体必需的微量元素之一[1],是超氧化物歧化酶(Superoxide dismutase,SOD)、细胞色素c氧化酶(Cytochrome c oxidase)、铜氧化酶(Ceruloplasmin)等许多抗氧化酶的辅因子,且具有促进机体造血、加快生长繁殖和增强机体免疫力的功能[2]。然而,过多的Cu可诱发机体产生大量活性氧(Reactive oxygen species,ROS),引起生物膜损伤、蛋白质变性、酶失活及DNA突变[3-4]。
近年来,巢湖、太湖、鄱阳湖Cu污染均已达中度以上水平,其污染来源主要是采矿废水、化肥施用等[5-7]。研究表明,Cu可通过呼吸、进食和体表渗透等途径被水生动物吸收[1],对水生动物的毒性较哺乳动物更大[8-9]。贝类被认为是监测水体重金属污染的理想指示生物[10-11],其体内的抗氧化酶及小分子抗氧化剂可作为生物标志物用来监测和评价水体Cu等重金属的污染程度[12-15]。
背角无齿蚌(Anodonta woodiana)是在我国分布广泛的淡水蚌,对Cu具有较强的富集能力[16],曾作为指示生物用于太湖五里湖重金属污染监测评估[17]。然而,有关Cu对背角无齿蚌毒性的研究较少,且鳃是重金属蓄积的重要靶器官[15]。因此,本研究通过检测亚慢性Cu2+暴露后背角无齿蚌鳃中抗氧化指标,包括超氧化物歧化酶、过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPx)和谷胱甘肽转硫酶(Glutathione S-transferase,GST)活性,还原型谷胱甘肽(Reduced glutathione,GSH)和丙二醛(Malondialdehyde,MDA)的含量及总抗氧化能力(Total antioxidant capacity,T-AOC)水平,筛选可指示Cu污染的合适的生物标志物,为背角无齿蚌用于淡水Cu污染监测和评估提供科学依据。
1 材料与方法
1.1 实验材料
实验所用背角无齿蚌(以下简称“河蚌”)购自湖南省郴州市苏仙区栖凤渡镇水产市场,将其置于盛有曝气48 h以上自来水(pH 6.8,溶氧6.0~6.3 mg·L-1,水温20±2℃)的塑料箱(长×宽×高为60 cm×42 cm×35 cm)中暂养3周,驯养期间每2 d换1次水,每日每只河蚌喂3.5×104个小球藻,并维持室温20℃左右。
1.2 实验方法
1.2.1 主要仪器及试剂
仪器:高速冷冻离心机(Eppendorf,5804R型),电动匀浆仪(FLUKO,F6/10型),电热恒温水浴锅(Eppendorf,HHS型),多功能酶标仪(SpectraMax M5型)。
试剂:氯化铜(CuCl2·2H2O,分析纯)、氯化钠(NaCl,分析纯),蛋白定量测定试剂盒,SOD、CAT、GPx、GST测定试剂盒,GSH和MDA含量测定试剂盒,T-AOC测定试剂盒,均购于南京建成生物工程所。
1.2.2 实验设计
称取5.884 g CuCl2·2H2O于小烧杯中,加入200 mL双蒸水充分溶解配制10 955 mg·L-1的Cu2+母液。根据Cu2+对河蚌96 h的LC50(109.55 mg·L-1)设置3个Cu2+(0.137、0.548、2.192 mg·L-1)暴露组和1个空白对照组,实验共进行28 d。选取个体大小相近(壳长6.4±2.7 cm、壳宽4.0±1.7 cm、壳顶高2.2±2.0 cm)的河蚌分别置于4个塑料箱(长×宽×高为51 cm×35 cm×30 cm)中,每箱随机投放20只,对照组加入20 L曝气48 h以上的自来水,暴露组加入20 L不同浓度的Cu2+溶液。暴露期间与驯养期间饲养条件保持一致。定时检查河蚌的死亡情况(本实验期间河蚌死亡率为87.5%),并及时挑出死亡个体。每组设4个平行。
1.2.3 样品制备
Cu2+暴露7、14、21、28 d后,每组随机取4只河蚌置于冰上,迅速剖取其鳃组织约0.1 g(称质量前用滤纸吸净组织表面水分),置于离心管中,用液氮速冻后转移至-80℃低温冰箱待测。按质量∶体积为1∶4的比例加入预冷的生理盐水,在冰上用电动匀浆器(FLUKO,F6/10型)制备匀浆,然后4℃下2800 r·min-1离心10 min,取其上清液暂置于冰上。
1.2.4 测定方法
用考马斯亮蓝法测定组织蛋白含量,羟胺法测定组织SOD活力,可见光法测定CAT活力,比色法测定GPx和GST活力,TBA法测定MDA含量,微板法测定GSH含量,FRAP法测定T-AOC。
1.3 数据处理
采用SPSS 18.0软件对实验数据进行单因素方差分析(One-way ANOVA),运用Duncan法比较各暴露组和对照组间的差异,组间不同字母表示差异显著(P<0.05)。实验结果均以“平均值±标准差”表示。
2 结果与分析
2.1 Cu2+暴露对河蚌鳃SOD活性的影响
如图1所示,随着暴露时间的延长,各暴露组河蚌SOD活性均表现为“诱导-恢复-诱导”的变化趋势。其中,低、中浓度组SOD活性在Cu2+暴露14 d以及高浓度组SOD活性在Cu2+暴露21 d时恢复到对照组水平。在Cu2+暴露28 d时,随着Cu2+浓度的增加,SOD活性先升高后降低,且均显著高于对照组(P<0.05)。
2.2 Cu2+暴露对河蚌鳃CAT活性的影响
由图2可知,经Cu2+暴露后,除高浓度组Cu2+暴露28 d CAT活性较对照组无显著差异外,其余各组与对照组相比均被显著抑制(P<0.05)。从Cu2+暴露7 d到14 d,中浓度组CAT活性下降,从Cu2+暴露21 d到28 d,中浓度组CAT活性上升。
2.3 Cu2+暴露对河蚌鳃GPx活性的影响
由图3可知,经Cu2+暴露后,河蚌鳃GPx活性较对照组被显著诱导(P<0.05)。低、高浓度组GPx活性随着暴露时间的延长呈现先升后降的变化趋势,且各暴露组GPx活性均在Cu2+暴露28 d时达到最低,但仍显著高于对照组(P<0.05)。Cu2+暴露7、21、28 d时,中、高浓度组GPx活性较低浓度组均显著降低(P<0.05)。

图1 Cu2+对背角无齿蚌鳃组织SOD活性的影响Figure 1 Effect of Cu2+on SOD activities in gills of A.woodiana
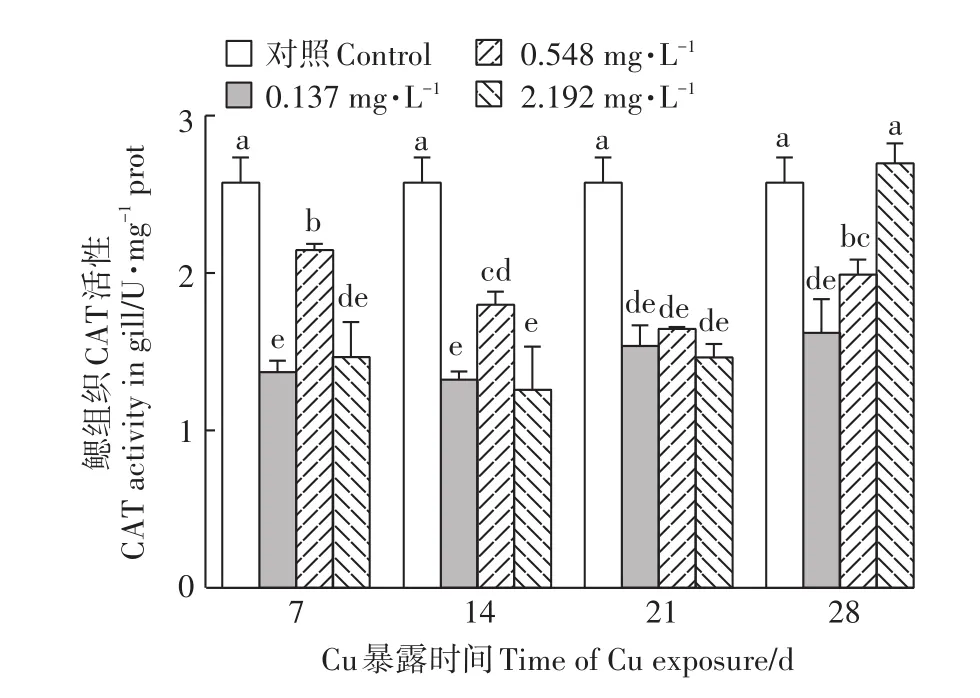
图2 Cu2+对背角无齿蚌鳃组织CAT活性的影响Figure 2 Effect of Cu2+on CAT activities in gills of A.woodiana
2.4 Cu2+暴露对河蚌鳃GST活性的影响
如图4所示,经Cu2+暴露后,河蚌鳃GST活性较对照组被显著诱导(P<0.05)。随着暴露时间的延长,低浓度组GST活性无显著变化,中浓度组GST活性显著降低,高浓度组GST活性先升高后降低,且中、高浓度组GST活性均在Cu2+暴露28 d时达到最低,但仍显著高于对照组(P<0.05)。Cu2+暴露21、28 d时,中、高浓度组GPx活性较低浓度组均显著下降(P<0.05)。
2.5 Cu2+暴露对河蚌鳃GSH含量的影响
由图5可知,经Cu2+暴露后,河蚌鳃GSH含量较对照组显著降低(P<0.05)。低、中浓度组GSH含量随着暴露时间的延长均先升高后降低,且均在Cu2+暴露28 d时达到最低。Cu2+暴露7、21、28 d时,高浓度组GSH含量均显著高于低浓度组(P<0.05)。
2.6 Cu2+暴露对河蚌鳃T-AOC的影响
如图6所示,Cu2+暴露14、21、28 d时,河蚌鳃TAOC较对照组均显著升高(P<0.05),且各暴露组TAOC随着暴露时间的延长均有所上升。Cu2+暴露21、28 d时,随着Cu2+浓度的增加,T-AOC均先升后降,但均显著高于对照组(P<0.05)。
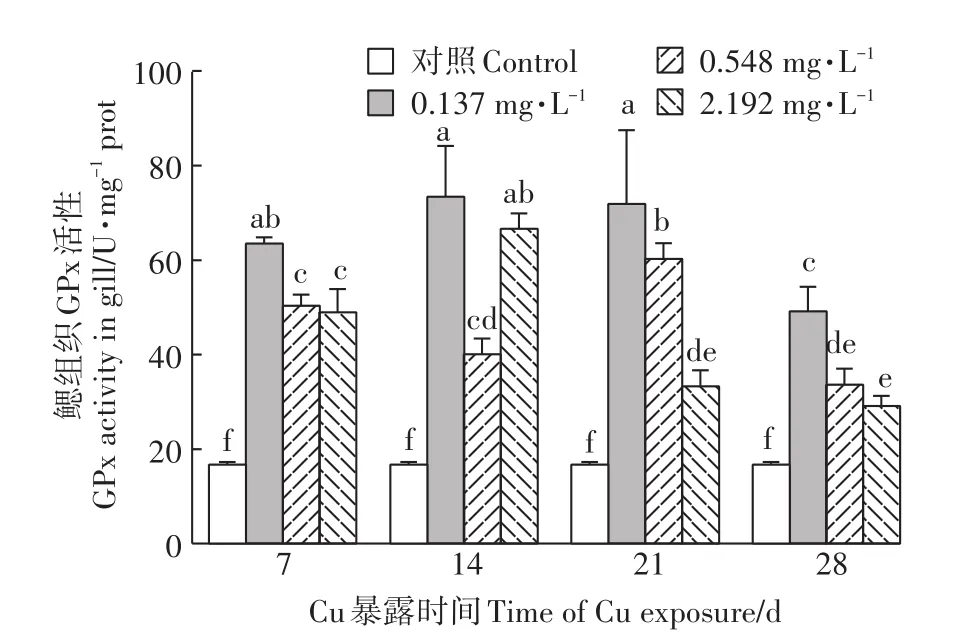
图3 Cu2+对背角无齿蚌鳃组织GPx活性的影响Figure 3 Effect of Cu2+on GPx activities in gills of A.woodiana
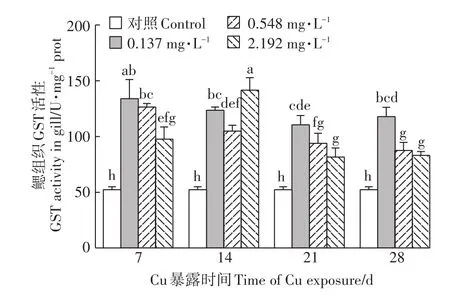
图4 Cu2+对背角无齿蚌鳃组织GST活性的影响Figure 4 Effect of Cu2+on GST activities in gills of A.woodiana
2.7 Cu2+暴露对河蚌鳃MDA含量的影响
由图 7可知,Cu2+暴露 14、21、28 d时,河蚌鳃MDA含量较对照组均显著升高(P<0.05)。各暴露组MDA含量均随着暴露时间的延长而上升。Cu2+暴露14、21、28 d时,高浓度组MDA含量较低、中浓度组均显著升高(P<0.05)。
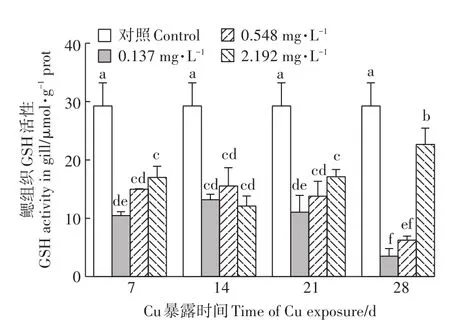
图5 Cu2+对背角无齿蚌鳃组织GSH含量的影响Figure 5 Effect of Cu2+on GSH content in gills of A.woodiana
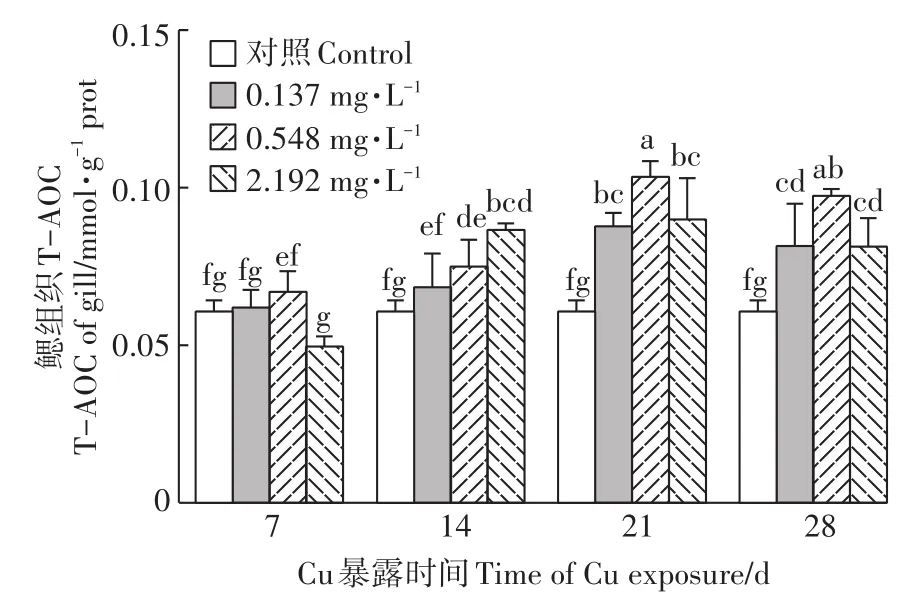
图6 Cu2+对背角无齿蚌鳃组织T-AOC的影响Figure 6 Effect of Cu2+on T-AOC in gills of A.woodiana
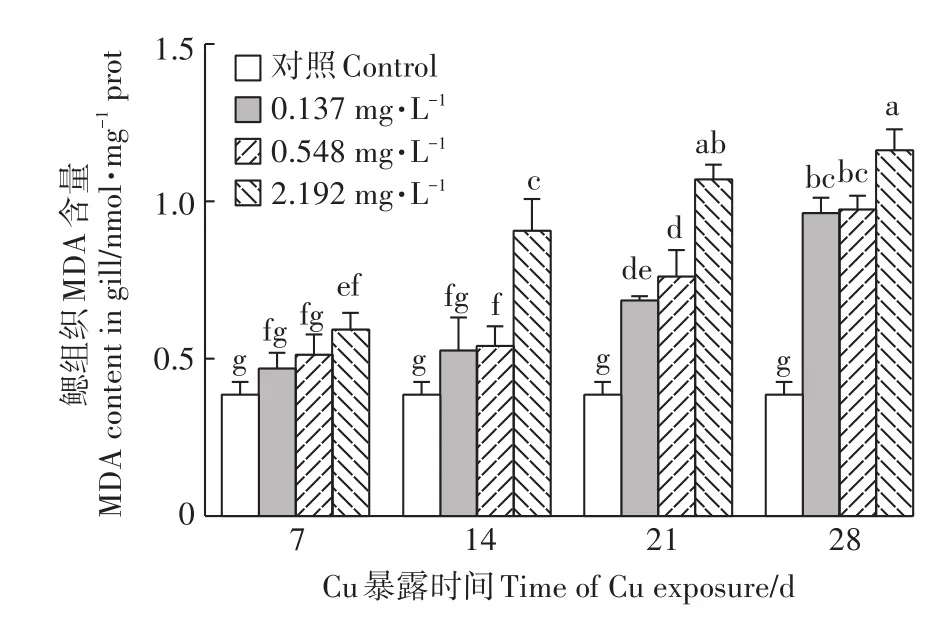
图7 Cu2+对背角无齿蚌鳃组织MDA含量的影响Figure 7 Effect of Cu2+on MDA content in gills of A.woodiana
3 讨论
SOD是生物体内重要的抗氧化酶,可清除生物体内超氧阴离子(Superoxide anion,O-·2)[18]。CAT是一种主要存在于生物线粒体和过氧化物酶体中富含巯基的氧化还原酶,可直接快速催化分解过氧化氢(Hydrogen peroxide,H2O2)转化为水和氧气[19]。两者共同组成机体抗氧化系统的第一道防线[20]。有研究报道,厚壳贻贝(Mytilus coruscus)和河蚬(Corbicula fluminea)经Cu2+暴露后,其鳃SOD活性均被显著诱导[21-22]。在本研究中,背角无齿蚌鳃SOD活性在Cu2+暴露下也被诱导,可能是因为进入鳃中的Cu2+诱发产生的O-2·促使SOD基因的表达上调,SOD蛋白的合成增加,酶活水平上升[23-24]。Cu2+暴露28 d时,各暴露组SOD活性均显著高于对照组,但高浓度组SOD活性较中浓度组显著降低,这与对葡萄牙牡蛎(Crassostrea angulata)研究所得到的结果类似[25]。可能由于在长时间高浓度Cu2+暴露下,背角无齿蚌鳃中产生了大量金属硫蛋白(Metallothionein,MT),MT可直接快速与Cu2+结合来解毒重金属,使O-2·生成量减少,以O-2·为底物的SOD活性下降[26],随着暴露时间的延长,各暴露组SOD活性均呈现“诱导-恢复-诱导”的变化趋势,表明Cu2+暴露期间,背角无齿蚌鳃中O-2·生成量处于波动状态,受机体抗氧化系统动态调节。经Cu2+暴露后,背角无齿蚌鳃CAT活性受到抑制,这与对厚壳贻贝的研究结果一致[21]。可能由于背角无齿蚌鳃中积蓄的Cu2+在参与机体内氧化还原反应(例如,芬顿反应)的过程中转化为Cu+,而Cu+又可与H2O2反应生成羟自由基,使得机体H2O2的含量降低,由于底物浓度的降低,引起CAT活性下降[27-28]。随着暴露时间的延长,中浓度组CAT活性先降后升,但均显著低于对照组,这可能与中浓度组SOD活性变化有关。从Cu2+暴露7 d到14 d,中浓度组SOD活性下降,H2O2生成量的减少不足以为CAT提供底物,使CAT活性降低;从Cu2+暴露21 d到28 d,中浓度组SOD活性上升,H2O2生成量增加,CAT活性上升[26]。
GPx在H2O2存在的情况下,可促进H2O2与GSH反应生成水及氧化型谷胱甘肽(Oxidized glutathione,GSSG)[29]。GST是机体内具有清除有机过氧化物和解毒双重功能的酶,可催化某些外源有害物质的亲电子基团与GSH的巯基偶联,增强外源毒物疏水性,使其易于被分解排出体外,从而发挥解毒作用以保护机体细胞免受毒害[29-30]。GSH是机体内的非蛋白巯基化合物,具有清除自由基、解毒、维持红细胞膜完整性等多种重要生理功能[31]。研究发现,河蚬及淡水贝Anodonta anatina经Cu2+暴露后,其鳃GPx活性均被诱导[32-33];菲律宾蛤仔(Ruditapes philippinarum)和翡翠贻贝(Perna viridis)经Cu2+暴露后,其鳃GST活性均被诱导[34-35]。在本研究中,经Cu2+暴露后,背角无齿蚌鳃GPx活性被显著诱导,推测这可能是机体对CAT活性受到抑制作出代偿性调节的表现[36]。背角无齿蚌鳃GST活性在Cu2+暴露下也被显著诱导,可能由于在Cu2+刺激下,GST基因表达上调,GST蛋白合成量增加,酶活水平升高[37],加快催化了Cu2+与GSH的巯基相结合,从而达到解毒目的[30-31]。然而,经Cu2+暴露后,背角无齿蚌鳃GSH含量显著降低,这与对背角无齿蚌进行急性镉暴露实验所得出的结果一致[38]。可能是因为GSH一方面在GPx的催化下还原H2O2,并在此过程中最终转化为GSSG[29],另一方面在GST催化下通过自身分子中的巯基或肽键等结构绑定结合重金属,从而降低重金属毒性[30-31]。GSH作为GPx和GST两种酶的共同底物,在GPx和GST两者活性均被显著诱导的情况下被大量消耗。Cu2+暴露7、21、28 d,各暴露组GPx和GST活性均显著高于对照组,GSH含量显著低于对照组,高浓度组GPx和GST活性较低浓度组显著降低而高浓度组GSH含量较低浓度组显著上升,可能是因为当Cu2+浓度升高到超出机体调节能力范围时,机体内ROS的产生与消除间的动态平衡被打破,ROS不断增加,机体细胞毒性反应加重,酶合成受阻,GPx和GST两者活性下降,GSH消耗减少,GSH 含量回升[27,31]。
T-AOC是衡量机体抗氧化酶系统与非酶促系统整体功能状态的综合性指标,表现为机体内各种抗氧化大分子、小分子和酶的总体水平[39-40]。本研究结果显示,Cu2+暴露14、21、28 d,背角无齿蚌鳃T-AOC较对照组均显著升高,且随着暴露时间的延长,各暴露组T-AOC均有所上升,表明随Cu2+暴露时间延长,背角无齿蚌鳃中产生较为剧烈的氧化应激反应,TAOC适应性增高[41]。在对美丽蚌(Lampsilis siliquoidea)和三疣梭子蟹(Portunus trituberculatus)的研究中也得到了类似的结果[42-43]。
MDA是脂质过氧化的重要产物之一,其含量常可直接反映机体脂质过氧化的程度,间接反映出细胞损伤的程度[44]。研究表明,ROS可攻击生物膜中的多不饱和脂肪酸,产生脂质过氧化物,从而对细胞造成损伤[2]。本研究发现,Cu2+暴露14、21、28 d,背角无齿蚌鳃MDA含量较对照组均显著升高,且随Cu2+浓度增加和暴露时间延长,MDA含量逐渐上升,表现出明显的“剂量-效应”和“时间-效应”关系,类似的结果在对紫贻贝(Mytilus galloprovinciali)和沟纹蛤仔(Ruditapes decussatus)的研究中也被发现[40,45]。可能由于在长时间高浓度Cu2+暴露下,背角无齿蚌鳃中ROS累积超过一定限度,尽管机体充分调动抗氧化系统来应对Cu2+引起的氧化胁迫,但仍不足以保护鳃免受氧化损伤,脂质过氧化程度加深。
4 结论
(1)亚慢性Cu2+暴露对背角无齿蚌鳃SOD、GPx、GST活性均有诱导作用,对CAT活性有抑制作用。背角无齿蚌鳃抗氧化系统在Cu2+暴露下被激活,但仍受到了氧化损伤。
(2)背角无齿蚌鳃中GPx、GST和GSH对Cu2+暴露响应最为灵敏,可以作为生物标志物用于水体Cu污染的监测和评估。
