霜疫霉侵染后荔枝果皮结构变化的扫描电镜观察
2019-06-20孙进华曹璐璐李焕苓王果王树军李芳王家保张蕾
孙进华 曹璐璐 李焕苓 王果 王树军 李芳 王家保 张蕾
摘 要 霜疫霉病严重危害荔枝果实的产量和质量,其病原菌是霜疫霉(Phytophthora litchii Chen ex Ko et al.)。以4×104 cfu/mL霜疫霉孢子悬浮液分别接种抗病品种‘黑叶和感病品种‘桂味的果实,通过扫描电子显微镜观察接种0、1、6、12、24、48、72、96 h后荔枝外果皮显微结构的变化。扫描电镜观察发现,‘黑叶果皮的龟裂片平整,主要组成单元为微小乳突状结构,其中间微微凸起且结构致密紧实;‘桂味果皮的裂片谷较深,主要组成单元为微小蜂窝状结构,其中间凹陷且壁薄挺立。随着贮藏时间的延长,2个品种外果皮均出现不同程度的损伤,但‘黑叶比‘桂味损伤较轻。用相同浓度霜疫霉孢子接种后,‘桂味果皮附着孢子的数量是‘黑叶的近5倍,说明‘桂味果皮显微结构更易于霜疫霉孢子的附着和侵染。接种霜疫霉后,病原菌侵染加剧荔枝外果皮结构的崩解,但‘黑叶外果皮崩解速度较慢。在‘黑叶上霜疫霉的孢子萌发、菌丝生长和孢子囊形成都晚于‘桂味,说明其对霜疫霉的生长有一定的抑制作用。‘黑叶和‘桂味果皮显微结构的差异是其对霜疫霉表现不同抗性的重要原因。
关键词 荔枝;霜疫霉;外果皮结构;扫描电子显微镜
中图分类号 S436.67+1 文献标识码 A
Abstract Litchi downy blight is a damaging oomycete disease, caused by Phytophthora litchii. The 4×104 cfu/mL sporangium suspension was used to inoculate the fruit of the resistant cultivar ‘Heiye and susceptible cultivar ‘Guiwei. The ultra-structural changes of exocarps was investigated by the Scanning Electron Microscopy (SEM) method at 0, 1, 6, 12, 24, 48, 72, and 96 h post-inoculation. The results indicated that the lobe of exocarp was flat and consisted of convex and compact honeycomb in ‘Heiye, while the valley of lobe was deep, and the honeycomb was thin and erect in ‘Guiwei. The integrity of exocarps was damaged with the prolonging of the harvest time. The infection of P. litchii promoted the dissociation of exocarps, as well as the damage degree of ‘Hieye” was lower than that of ‘Guiwei. Under the same inoculation condition, the exocarps of ‘Guiwei harbored nearly five times sporangia than that of ‘Heiye. The character of lobe and honeycomb was more easily agglutinated and infected by the spores of P. litchii in ‘Guiwei. The infection of P. litchii accelerated the breakdown of exocarp structure, which had a small impact on ‘Heiye. Comparing with ‘Guiwei, the gemination of spores, as well as growth of mycelium and formation of sporangia, was lagging in ‘Heiye. It is suggested that the growth of P. litchii is repressed in the exocarps of resistant cultivars. The structure difference of the exocarp is the reason why ‘Guiwei is more susceptible to P. litchii than ‘Heiye.
Keywords litchi; Phytophthora litchii; structure of exocarp; scanning electron microscopy
DOI 10.3969/j.issn.1000-2561.2019.05.016
荔枝(Litchi chinensis Sonn.)原產于中国南部和越南北部,是我国热区重要的特色水果[1]。荔枝霜疫霉病(Litchi downy blight)由霜疫霉菌(Phytophthora litchii Chen ex Ko et al.)引起,是荔枝生产上的主要病害之一。该病主要危害荔枝近成熟果实,引发大量的裂果、落果和烂果,降低果实产量和品质[2-8]。目前,荔枝霜疫霉病的防治主要通过施用化学药剂,如大生、代森锰锌和甲霜灵等。虽然药剂防治效果较好,但长期大量施用对生态、环境和食品安全都造成了一定程度的影响。利用植物自身的抗病性防治病虫害,不仅绿色环保,而且高效安全。抗性机制的研究能为培育抗性品种奠定理论基础。
果实表皮是抵御病原菌侵染的第一道屏障,在芒果、龙眼、苹果、鸭梨和油茶等果树中证实了其结构与抗病性紧密相关[9-20]。关于荔枝的果皮结构,已有学者开展了一些研究。荔枝果皮由外、中、内三层组成,其外表面有龟裂片。通过观察比较不同荔枝品种的表皮结构,彭永宏等[21]发现品种间果皮结构差异明显。具体表现为:一部分荔枝品种的龟裂片突起较明显且排列不整齐,而另一部分品种龟裂片较平整、突起小且排列整齐。潘洵操和胡新宇等[22-23]用电子显微镜观察发现,荔枝外果皮由半球状突起物组成,其表面分布着不规则的蜂窝状坑洼。朱若馨[24]观察到荔枝果皮的表面由很多低谷和嵴峰构成,果皮表面分散着微小裂口。不同荔枝品种的果皮显微结构存在差异,且与其果实抗病性有一定的关系。通过霜疫霉孢子接种‘陈紫果实,蔡学清等[25]利用扫描电镜初步研究了霜疫霉侵染荔枝果皮的过程。
虽然荔枝果皮结构已有一些研究进展,但果皮显微结构与其对霜疫霉病抗性之间的关系尚未见报道。前期研究发现,不同荔枝品种果实对霜疫霉病表现不同的抗性。其中,‘黑叶在多个年份对霜疫霉病表现稳定抗病性,而‘桂味则表现稳定感病性[26]。本研究在此基础上,利用体式显微镜和扫描电子显微镜观察比较‘黑叶与‘桂味果皮显微结构差异,分析接种霜疫霉对其果皮显微结构的影响,以期阐明荔枝果皮显微结构与其对霜疫霉抗性之间的关系。
1 材料与方法
1.1 材料
1.1.1 荔枝材料 采摘‘黑叶(抗病品种)和‘桂味(感病品种)约八成熟果实[26],4 h内运回实验室。挑选成熟度相对一致、大小均一、无病虫害和机械损伤的果实。先用自来水冲洗干净,再用无菌去离子水冲洗2遍,自然晾干(约10 min左右)后立即用于接种处理。
1.1.2 霜疫霉菌株 菌株为本实验室从荔枝品种‘三月红病果上分离,经形态学和分子生物学鉴定其为霜疫霉后纯化并保存。接种前活化菌株,然后在28 ℃,10% V8培养基上培养7~9 d,收集孢子囊用于荔枝果实接种处理。
1.2 方法
1.2.1 孢子囊悬浮液配制 参照曹璐璐等[26]的方法,在霜疫霉培养皿中加入10 mL无菌水,浸泡菌丝10 min后用双层无菌纱布过滤收集孢子。显微镜观察计算孢子囊数量,并调整孢子囊浓度为4×104 cfu/mL。
1.2.2 果实接种 参照曹璐璐等[26]的方法,将自然晾干的果实置于4×104 cfu/mL孢子囊悬浮液中浸泡5 min,取出后稍稍沥干水分,放置在底部铺有双层吸水纸的保鲜盒中(预先用无菌水润湿以保持湿度)。浸泡5 min无菌水的荔枝果实作为对照组。果实单层摆放,相互之间无挤靠。盖紧保鲜盒,28 ℃恒温放置。20个果实作为一次重复,每个处理重复3次。
1.2.3 扫描电镜样品制备和观察 果实接种霜疫霉0、1、6、12、24、48、72、96 h后,首先用镊子撕取果实缝合线两侧部位的果皮,然后病斑部位用双面刀片切取成3 mm×3 mm大小的方块(对照组做同样处理)。参照李和平[27]的方法制备扫描电镜样本并稍有改动,其改动处为分别用丙酮∶醋酸异戊酯按照3∶1、1∶1、1∶3与纯醋酸异戊酯进行置换,其他步骤相同。样品制备后通过扫描电子显微镜(ZEISS EVO18)观察果皮显微结构的变化。
1.2.4 外果皮结构参数测量 荔枝果皮结构参数如下:
裂片峰高度(Peak hight, H1):裂片峰到内果皮的距离(图1A,图1F)。
裂片谷厚度(Valley hight, H2):裂片谷中央到内果皮的距离(图1A,图1F)。
龟裂片半径(Protuberance radius, R):从裂片峰到裂片谷边缘的距离(图1B,图1G)。
裂片谷宽度(Valley width, W):相邻龟裂片间的距离(图1B,图1G)。
果皮厚度(Pericarp thickness, T):邻接裂片峰高度和裂片谷厚度的平均值(T=H1/2+H2/2)。
孢子附着密度(Density of sporangia, D):接种霜疫霉1 h后每平方厘米果皮附着的孢子囊、次生孢子囊和孢子的总和。
其中,H1和H2值为在体视显微镜(ZEISS V12)下测量的数值,R和W值在扫描电镜下测量。每个值测量25个样本,最终计算平均值。D值为扫描电镜下观察记录每个视野的孢子数,共记录200个视野,换算成单位面积附着孢子数并取整。
1.3 数据分析
实验数据采用Excel软件和DPS数据处理系统[28]进行统计分析。
2 结果与分析
2.1 ‘黑叶和‘桂味果皮的显微结构观察
荔枝果皮由外、中、内3层组成。‘黑叶和‘桂味的外果皮为栅状组织,含有丰富的花色素苷,因而较中果皮和内果皮的颜色更深(图1A,图1F)。外果皮由龟裂片和连接紧邻龟裂片的裂片谷组成(图1B,图1G)。两个品种的裂片谷都较为平滑(图1C,图1H)。龟裂片可分为三个部分:裂片峰、从裂片峰向下发散的条状脊背和除这两者之外的其他区域(图1B,图1G)。‘黑叶的龟裂片比较平滑,裂片峰微尖(图1A,图1B);‘桂味的龟裂片隆起明显,裂片峰呈楔形(图1F,图1G)。两个品种龟裂片的脊背都由微小的突起结构组成,排列整齐(图1D,图1I)。与‘桂味相比,‘黑叶脊背的突起面积较小,而且凸起不明显(图1B,图1G)。其它区域是龟裂片的主体部分,占龟裂片面积的90%以上,也由类似的微小单元结构组成。‘黑叶的其他区域由類似脊背的乳状突起组成,其结构比较致密,中间凸起,突起间排列紧实(图1E)。‘桂味的其他区域由微小的蜂窝状结构组成,其排列比较稀疏,中间凹陷,连接每个凹陷的壁比较薄且挺立(图1J)。
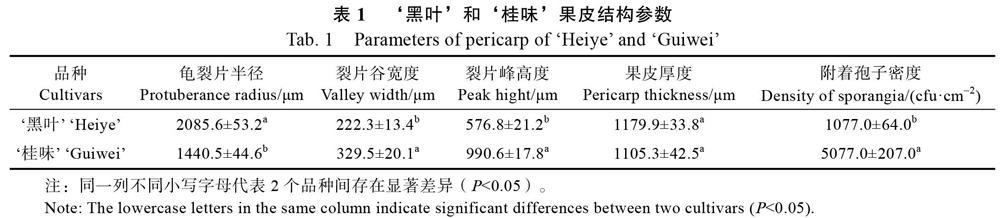
‘黑叶和‘桂味的龟裂片半径(R)分别为2085.6、1440.5 μm(表1),两者的比值为1.45。‘黑叶的裂片峰高度(H1)为576.8 μm,不及‘桂味裂片峰高度的三分之二(表1)。综合考虑龟裂片半径和裂片峰高度,相同投影面积‘桂味果皮比‘黑叶具有更大的实际面积。‘黑叶 的裂片谷宽度(W)也显著小于‘桂味,而两者的果皮厚度差异不显著(表1)。‘桂味每平方厘米(投影面积)的果皮附着5077个孢子,几乎是‘黑叶的5倍(表1)。接种霜疫霉后,孢子和孢子囊大部分吸附在裂片谷、乳突结构(黑叶)连接处或蜂窝状结构(桂味)的凹陷里(图2C1~图2C3,图2D1~图2D4)。‘桂味相比‘黑叶果皮的裂片谷深且宽,更易与孢子和孢子囊的吸附。另外,‘桂味外果皮的蜂窝状结构非常适合孢子和孢子囊的附着(图2D3)。
2.2 采后‘黑叶和‘桂味外果皮结构的变化
在0~48 h时,‘黑叶对照果实的外果皮未观察到损伤,其结构完整(图2A1~图2A6);在72 h时,观察到龟裂片的部分突起开始塌陷,果皮开始出现损伤(图2A7);在96 h时,龟裂片的突起塌陷加重(图2A8)。在0~12 h时。‘桂味对照果实的蜂窝状结构褶皱明显而且完整,未发现损伤(图2B1~图2B4);在24 h时,蜂窝状结构的褶皱变得模糊,开始趋于平滑(图2B5);在48 h时,观察到龟裂片部分凸起的壁出现缺口,开始出现损伤(图2B6);在72 h时,部分蜂窝状结构被破坏(图2B7);在96 h时,蜂窝状结构破坏更加严重,凸起的薄壁崩解成碎片(图2B8)。
2.3 霜疫霉侵染荔枝果实及其对外果皮结构的影响
‘黑叶接种霜疫霉后,在0~12 h时,观察到其外果皮上附着有孢子和孢子囊(图2C1~图2C4);在24 h时,附着的孢子囊延伸出菌丝,且贴着表面生长(图2C5);在48 h时,菌丝从乳突结构的间隙侵入中果皮(图2C6);在72 h时,侵入中果皮内的菌丝开始向四周发散延伸(图2C7);在96 h时,侵染成功的菌丝体形成二指叉状孢囊梗和成熟的孢子囊(图2C8)。‘桂味接种霜疫霉后,在0~6 h时,观察到孢子附着在龟裂片的蜂窝状结构中,且6 h时孢子开始萌发(图2D1~图2D3);在12 h时,在裂片谷中发现贴壁延伸的菌丝(图2D4);在24 h时,侵入到中果皮内的菌丝开始呈发散状延伸(图2D6);在48 h时,有大量的菌丝体紧贴外果皮表面向四周发散状延伸(图2D6);在72 h时,成熟的菌丝体交织在外果皮表面,并观察到少量散落的成熟孢子囊(图2D7);在96 h时,菌丝体布满果实表面,形成大量散落的成熟孢子囊(图2D8)。
霜疫霉的孢子囊呈柠檬形,与其侵染荔枝外表皮后形成的成熟孢子囊相同(图2C2,图2C5,图2C8,图2D7~图2D8)。孢子囊生长形成的营养体为无隔菌丝,孢囊梗呈多级有限生长(图2C5,图2C7,图2C8,图2D5~图2D8),与前人的研究结果相同[8, 22-24]。霜疫霉孢子囊接种‘黑叶和‘桂味果实后有2种侵染方式:(1)孢子囊首先释放游动孢子,然后游动孢子依靠鞭毛移动到合适的位点并吸附到果皮的表面,接着萌发并从外果皮的嵴点裂缝处侵入,随后在侵入点生长出菌丝,菌丝扩张并形成孢子囊,进而进行第二轮的侵染(图2C4,图2C6);(2)附着在外果皮的孢子囊直接萌发出菌丝,菌丝紧贴外果皮表面进行延伸,破坏果皮结构(图2C5)。这两种侵染方式可以通过菌丝生长方式进行区分,前一种的菌丝呈发散状向外延伸(图2C5,C7,图2D5~6),而后一种是贴着外果皮表面进行生长(图2C6,图2D4,图2D7)。
在0~1 h时,‘黑叶接种霜疫霉和对照的外果皮结构一样完整,龟裂片的乳突结构凸起明显(图2A1,图2C1);在6 h 时,龟裂片的乳突结构的凸起部分出现损伤(图2C3),而对照果皮的乳突结构直到72 h才观察到损伤(图2A7);其后随着霜疫霉侵染时间的延长,‘黑叶果皮的损伤越来越严重(图2C4~图2C6,图2C7~图2C8)。在0~1 h时,‘桂味接种霜疫霉与对照相比,外果皮结构没有明显的区别; 在6 h时,外果皮的蜂窝状结构的凸起部分有损伤开始塌陷(图2D3),较对照出现相似的损伤提前42个小时(图2D3);其后随侵染时间的延长果皮损伤越发严重,直至96 h时完全崩解。霜疫霉的侵染同时加剧了抗、感病品种果皮显微结构完整性的崩解,但抗性品种的崩解速度相对较慢。
3 讨论
荔枝果皮龟裂片和裂片峰形态(突起或者平滑)是较为稳定的遗传性状,是品种分类的一个主要依据。‘黑叶的龟裂片平整,裂片峰微尖;而桂味的龟裂片隆起非常明显,裂片峰尖锐。二者间龟裂片微观上的差异反映在触感上‘桂味较为刺手。抗、感病品种间,龟裂片半径和裂片峰高度都存在显著差异。感病品种‘桂味不仅具有较小的龟裂片半径,而且裂片峰较高,导致其相同投影面积果皮比‘黑叶具有更大的表面积。接种相同浓度的霜疫霉,‘桂味较‘黑叶能吸附更多的孢子和孢子囊。数据显示,‘桂味果皮吸附的孢子数量近‘黑叶的5倍。与‘黑叶相比,‘桂味果皮能吸附较多的霜疫霉孢子,这是‘桂味对霜疫霉病表现感病的原因之一。
‘黑叶果皮的龟裂片主要由微小的乳突状结构单元组成,其排列紧致。‘桂味的龟裂片主要由微小的蜂窝状结构单元组成,连接各个蜂窝孔之间的壁薄且挺立。潘洵操和胡新宇等[22-23]发现荔枝外果皮由许多半球形突起物构成,突起物表面有条状角质层或蜡被,表面有许多不规则的坑洼呈蜂窝状。彭永宏等[21]观察表明,龟裂片较平整的品种,如‘黑叶和‘糯米糍,其小突起排列较整齐;龟裂片突起较明显的品种,如‘桂味和‘禾虾串,其小突起排列不整齐。这些研究都与本实验结果一致。需要注意的是,抗、感病品種间果皮龟裂片组成单元结构迥异。‘黑叶的组成单元为乳突状结构,其中间向外凸起;而‘桂味的组成单元为蜂窝状结构,其中间向内凹陷。组成单元的结构差异对荔枝的抗病性有直接的影响。
霜疫霉孢子在‘黑叶中主要吸附在乳突状结构凸起的连接处,孢子数量较少;而‘桂味中主要吸附在蜂窝状结构的凹陷中,孢子数量较多。蜂窝状结构较乳突状结构更利于孢子的吸附。不仅如此,24 h时‘桂味果皮的显微结构开始崩解,而‘黑叶中直到72 h才观察到损伤,说明乳突状结构比蜂窝状结构有更强的抵御损伤的能力。接种霜疫霉6 h后,在两个品种的果皮结构都观察到损伤,霜疫霉侵染破坏了荔枝外果皮显微结构的完整性,加剧了果皮的损伤程度。‘黑叶乳突状结构的排列较为紧密,连接处的凹陷较浅,病原菌侵染穿透果皮的难度较大。‘桂味蜂窝状结构的壁较薄,中间的凹陷较深,病原菌能很容易的穿透果皮。乳突状结构和蜂窝状结构的差异是抗、感病品种抗性差异的另一个重要原因。
霜疫霉侵染荔枝果實有两种方式:一是释放游动孢子从果皮裂缝侵入内果皮,菌丝发散生长并形成孢子囊;二是孢子囊直接萌发形成菌丝,菌丝紧贴外果皮表面生长。蔡学清等[25]发现,霜疫孢子囊聚集在接种果皮的嵴点裂缝处,一部分萌发成芽管直接从果皮嵴点裂缝处和皮孔侵入,另一部分释放游动孢子,游动孢子再萌发形成芽管从果皮的嵴点裂缝处侵入。两种侵染方式本研究中都观察到,由于技术原因未能判断哪种方式为主要的侵染形式,留待下一步的研究。接种霜疫霉6 h后,‘桂味果皮表面观察到孢子的萌发,而在‘黑叶中未见,‘黑叶中霜疫霉孢子的萌发时间较晚。接种24 h时,两个品种的果皮表面都已长出菌丝;48 h时,菌丝体已侵入内果皮,随后菌丝体大量生长。霜疫霉在‘黑叶果皮形成孢子需要96 h,生成的孢子囊较少;在‘桂味果皮上仅72 h就能形成的孢子囊,时间较短。两品种间霜疫霉侵染过程存在一定的差异,主要为在‘黑叶果皮表面霜疫霉的孢子萌发、菌丝生长和孢子囊的形成要滞后于‘桂味。抗病品种‘黑叶对霜疫霉生长的抑制是其表现抗性的原因之一。
4 结论
通过显微观察荔枝抗、感病品种果皮结构,发现抗性品种‘黑叶果实具有较小的比表面积,外果皮组成单元主要为乳突状结构,其排列紧致;而感病品种‘桂味果实具有较大的比表面积,外果皮组成单元主要为蜂窝状结构,其排列稀疏。随着时间的延长,荔枝采后果皮结构会出现一定程度的损伤,而霜疫霉菌的侵染加剧了这一过程。荔枝外果皮的微观结构与其对霜疫霉病的抗性紧密相关。一方面,‘黑叶较小的比面积导致较少的霜疫霉孢子吸附;另一方面,‘桂味稀疏排列的蜂窝状结构利于霜疫霉孢子从缝隙处侵染果实。加之抗性品种‘黑叶对霜疫霉的孢子萌发、菌丝生长和孢子形成具有抑制作用,导致‘黑叶和‘桂味对霜疫霉菌的侵染表现不同的抗性。荔枝外果皮结构特征可作为鉴定果实对霜疫霉病抗性的重要依据,在荔枝抗病育种中加以应用。
参考文献
Vien N V, Benyon F H L, Trung H M, et al. First record of Peronophythora litchii on litchi fruit in Vietnam[J]. Australasian Plant Pathology, 2001, 30(3): 287-288.
刘秀娟, 胡美娇. 荔枝果实采后病害和防腐保鲜技术[J]. 热带农业科学, 2000, 20(1): 67-73.
Wang H C, Zou M G. Baseline and differential sensitivity of Peronophythora litchii (lychee downy blight) to three carboxylic acid amide fungicides[J]. Plant Pathology, 2009, 58: 571-572.
戚佩坤. 广东果树真菌病害志[M]. 北京: 中国农业出版社, 2000: 41-42.
戚佩坤, 潘雪萍, 刘 任. 荔枝霜疫病的研究Ⅰ—病原菌的鉴定及其侵染过程[J]. 植物病理学报, 1984, 14(2): 113-119.
赖传雅. 农业植物病理学: 华南本[M]. 北京: 科学出版社, 2003: 211-213.
Liu J, Liu A, Chen W. Studies on the biological characteristics of lychee downy blight[J]. Acta Horticulturae, 2005(665): 415-420.
Kao C W, Leu L S. Sporangium germination of Peronophythora litchii, the causal of litchi downy blight[J]. Mycologia, 1980, 72(4): 737-748.
翁 巧, 刘锡滨, 李小舍, 等. 几种杀菌剂防止荔枝霜疫霉病的田间药效试验[J]. 广东农业科学, 2010, 37(8): 142-143.
彭埃天, 凌金锋, 习平根, 等. 我国荔枝产区杀菌剂的使用现状及建议[J]. 中国热带农业, 2011(5): 64-67.
周俞辛, 韦 伟. 荔枝霜疫霉病的发生及综合防治[J]. 汉中科技, 2013(6): 54-55.
易 赛, 潘汝谦, 徐大高, 等. 荔枝霜疫霉对烯酰吗啉的敏感性测定[J]. 广东农业科学, 2014, 41(2): 87-91.
杨德东. 荔枝霜疫霉病的发生与防治[J]. 植物医生, 2015, 28(5): 14-15.
常金梅, 张鲁斌, 柳 凤, 等. 芒果果实抗病性差异及其与果皮结构相关性初探[J]. 热带作物学报, 2012, 33(11): 2040-2043.
林河通, 陈绍军, 席玙芳, 等. 龙眼果皮微细结构的扫描电镜观察及其与果实耐贮性的关系[J]. 农业工程学报, 2002, 18(3): 95-99.
杨丽丽, 庄 艳, 王 忆, 等. 不同抗性苹果果实受轮纹病菌侵染后亚显微结构的变化[J]. 园艺学报, 2012, 39(5): 963-969.
关晔晴. 苹果果面结构与轮纹病抗病性关系的研究[D]. 北京: 中国农业大学, 2015: 4.
Konarska A. The structure of the fruit peel in two varieties of Malus domestica Borkh. (Rosaceae) before and after storage[J]. Protoplasma, 2013, 250: 701-714.
王艳娜. 鸭梨果实轮纹病寄主—病原菌互作机理[D]. 北京: 中国林业科学研究院, 2007: 7.
沈雅飞, 段文军, 胡娟娟, 等. 油茶果皮解剖结构与炭疽病抗性的关系[J]. 植物保护, 2015, 41(6): 98-102.
彭永宏, 林国辉. 荔枝果皮超微结构的比较观察[J]. 果树科学, 1999, 16(1): 18-23.
胡新宇. 荔枝采后生理与常温保鲜的研究[D]. 广州: 华南理工大学, 2001: 12.
潘洵操, 谢宝贵. 荔枝果皮的扫描电镜观察[J]. 园艺学报, 1996, 23(3): 227-230.
朱若鑫. 福建主栽荔枝品种的果实对霜疫霉的抗病性及机理初探[D]. 福州: 福建农林大学, 2011.
蔡学清, 林 娜, 陳 炜, 等. 荔枝霜疫霉的生物学特性[J]. 热带作物学报, 2009, 30(9): 1126-1131.
曹璐璐, 孙进华, 王家保. 荔枝果实对霜疫霉侵染抗性评价体系建立及初步应用[J]. 热带作物学报, 2017, 38(1): 126-130.
李和平. 植物显微技术[M]. 北京: 科学出版社, 2014: 85-89.
唐启义. DPS数据处理系统[M]. 北京: 科学出版社, 2010.
