番杏TtASR基因的克隆及其抗逆功能分析
2019-06-20叶玉妍罗鸣陈红锋张美何金实杨礼香
叶玉妍 罗鸣 陈红锋 张美 何金实 杨礼香
摘 要 ASR(ABA, Stress and Ripening)蛋白是植物中特有的亲水性小分子蛋白,在植物细胞失水条件下对细胞器起保护性作用。本研究在构建番杏[Tetragonia tetragonioides (Pall.) Kuntze]全长cDNA文库中通过随机克隆测序分析基础上,获得了一个编码番杏ASR蛋白的全长cDNA序列,命名为TtASR(GenBank登录号:MH454101)。TtASR的cDNA全长序列包含一个为723 bp完整开放阅读框,编码蛋白TtASR含有240个氨基酸,等电点为5.26,分子量为25.29 ku。对TtASR与其他植物中同源蛋白的进化分析表明,与辽宁碱蓬SlASR和海蓬子SbASR-1亲缘关系较近。将TtASR的cDNA阅读框插入到原核表达载体pGEX 6p-1中,通过转化大肠杆菌进行原核表达分析。结果表明,重组大肠杆菌菌株能表现出良好地抗逆性,特别是对NaCl、高渗透压和氧化胁迫的抗逆性增强。
关键词 番杏;ASR基因;逆境胁迫
中图分类号 Q949.745.5 文献标识码 A
Abstract ABA, stress and ripening (ASR) protein belongs to a plant-specific small family of proteins with low molecular weight and high hydrophobicity, and is supposed to play protective roles in plant cells under abiotic stresses. An ASR gene, designated as TtASR (GenBank accession no.: MH454101), was isolated from a cDNA library prepared from Tetragonia tetragonioides (Pall.) Kuntze and both the nucleotide and the deduced protein sequences were analyzed. The full length cDNA of TtASR contained a 723 bp long open reading frame, which would encode a peptide of 240 amino acid residues with a molecular weight of 25.29 ku and an isoelectric point of 5.26. TtASR shared a high amino acid sequence homology with the ASRs from Suaeda liaotungensis (SlASR) and Salicornia brachiata (SbASR-1). The open reading frame of TtASR was inserted into the prokaryotic expression vector of pGEX 6p-1 and transformed into E. coli. The E. coli cells under the induction of IPTG showed higher tolerance to NaCl, osmotic stress and oxidative stress than control cells.
Keywords Tetragonia tetragonioides (Pall.) Kuntze; ASR gene; abiotic stress
DOI 10.3969/j.issn.1000-2561.2019.05.011
番杏[Tetragonia tetragonioides (Pall.) Kuntze]又名新西兰菠菜、野菠菜、洋菠菜、白番苋,为番杏科番杏属一年生或二年生半蔓性草本植物,分布于亚热带及温带地区的滨海富盐区域,是一种具有经济价值和生态价值的盐生蔬菜[1–3]。番杏营养价值高,富含矿物质及多种维生素,营养丰富,肉质茎叶鲜嫩,口味清爽。番杏可全株入药,有清热、解毒的功效,对消化道癌症有一定的缓解和治疗作用[3]。番杏全株还含有抗菌的番杏素,是近几年我国新兴的一种很受人们欢迎的新型保健型蔬菜[2]。此外,番杏作为一种高耐盐性的盐土植物(halophyte),可耐受海水盐度,在海水倒灌引起的盐滞地区可正常生长,可用于对滨海滩涂地、盐荒地、海水倒灌农田改良和利用,是一种具有重要生态价值的经济作物[3-4]。
盐土植物是挖掘耐盐遗传资源、分离耐盐基因和启动子的重要来源[5]。土壤盐渍化是我国农业生态环境退化的重要问题之一,严重影响我国农业经济的发展。土壤盐渍化不仅影响土壤的利用率及农作物的种植面积,还会引起农作物营养缺陷和产量下降[6]。通过植物遗传改良提高作物的耐盐性是现代植物分子育种的重要手段,而通过分子生物学手段发掘耐盐基因是不可或缺的工作基础。植物的耐盐分子机理可归纳为3种类型:离子外排、渗透压耐受和组织耐受[7];或者总结为两类耐受机制:渗透压耐受和离子耐受[8]。研究表明,在上述不同的耐受机理中,有几类关键的基因在提高植物耐盐性方面发挥重要的作用,这些基因主要通过介导Na+/K+吸收、转运、外排,从而缓解离子毒害,提高植物细胞渗透胁迫的耐受性[8]。已经鉴定的耐鹽功能基因主要包括离子通道蛋白、转录因子、代谢酶类及一些保护性蛋白[9]。
ASR(ABA, stress and ripening)基因是植物中特有的一类主要参与调控细胞耐受水分缺失的抗逆基因,通常只含有较少的基因家族成员,且编码高度亲水的小分子蛋白[10]。该类基因在包括模式植物拟南芥在内的十字花科植物中明显缺失[11]。番茄Asr1基因是植物中首次克隆的ASR基因成员,参与调控番茄果实发育成熟及叶片应答干旱胁迫及ABA处理等,之后又在番茄基因组中依次发现了4个ASR基因成员。番茄中该基因家族的不同成员因其表达的差异性可能参与调控不同组织和器官的抗逆应答反应[12]。目前已在多种植物中克隆获得了ASR基因成员[10],其编码蛋白的典型特征为C端包含一个高度保守的ABA/WDS结构域(ABA/water deficit stress domain; PF02496 in PFAM)[13]。研究表明,ASR蛋白不仅可以作为分子伴侶对细胞成分在缺水情况下行使保护作用,而且还可以作为转录因子调控抗逆基因的表达,提高细胞抗逆能力[14]。
除了介导植物参与应答干旱/水分缺失等胁迫外,ASR蛋白参与调控植物耐盐应答也受到了人们的重视。百合ASR基因LLA23能够提高转基因超表达拟南芥的耐盐性[15];同样,香蕉ASR基因MpAsr也能够提高转基因超表达拟南芥的耐盐性和渗透压胁迫耐受性[16];海蓬子(Salicornia brachiata)和辽宁碱蓬(Suaeda liaotungensis K.)均为生长于温带地区的滨海盐生植物,具有高度的耐盐性和耐旱性。海蓬子ASR基因成员SbASR和辽宁碱蓬ASR基因SlASR在烟草[17]、花生[18]和拟南芥[19]中超量表达均能够提高转基因植物的耐盐性;农作物小米(Setaria italica)ASR基因SiASR4的超量表达也能够提高转基因植物对盐旱胁迫的耐受性[20]。
迄今为止,有关盐土植物番杏(T. tetragonioides)的耐盐机理还未见报道,对其耐盐基因TtASR的研究不仅有助于深入阐述盐土植物的耐盐机理,还能对提高植物耐盐性的遗传育种提供可操作候选基因。本研究从番杏的cDNA文库中随机测序获得TtASR基因(GenBank登录号:MH454101),并对其进行序列分析和原核表达研究。
1 材料与方法
1.1 材料
番杏植株种植于于华南植物园育苗基地(23°18′75.91″N,113°37′02.38″E)。栽培条件为生长温度25~35 ℃、相对湿度50%~90%、遮阴棚、自然光照时,可完成生长周期及收获种子。番杏种子经37 ℃萌发24 h后,种植于湿润的蛭石中,置于恒温培养室(25 ℃)中,约2个月可生长成番杏小苗。采用番杏幼苗全株构建番杏cDNA文库。
番杏DH10B大肠杆菌菌株cDNA文库由本实验室构建并保存;大肠杆菌(Escherichia coli)菌株JM109和BL21(DE3)、蛋白表达载体pGEX 6p-1均为本实验室保存。载体无缝克隆所用的In-Fusion HD Cloning Kit购于Clontech(TaKaRa Bio USA)公司。
1.2 方法
1.2.1 番杏文库目标克隆子TtASR的获得 将文库菌液涂布LB培养基平板至生长出单克隆,随机挑选文库克隆,并采用碱裂解法提取质粒,采用载体pYES-DEST52插入位点上游的通用引物T7(5′-TAATACGACTCACTATAGGG-3′)对获得的番杏文库单克隆质粒中插入的cDNA序列进行测序分析,将测序获得的序列在NCBI上进行Blast比对。经分析获得一个编码番杏ASR(ABA, stress and ripening)蛋白的cDNA全长,命名为
TtASR。
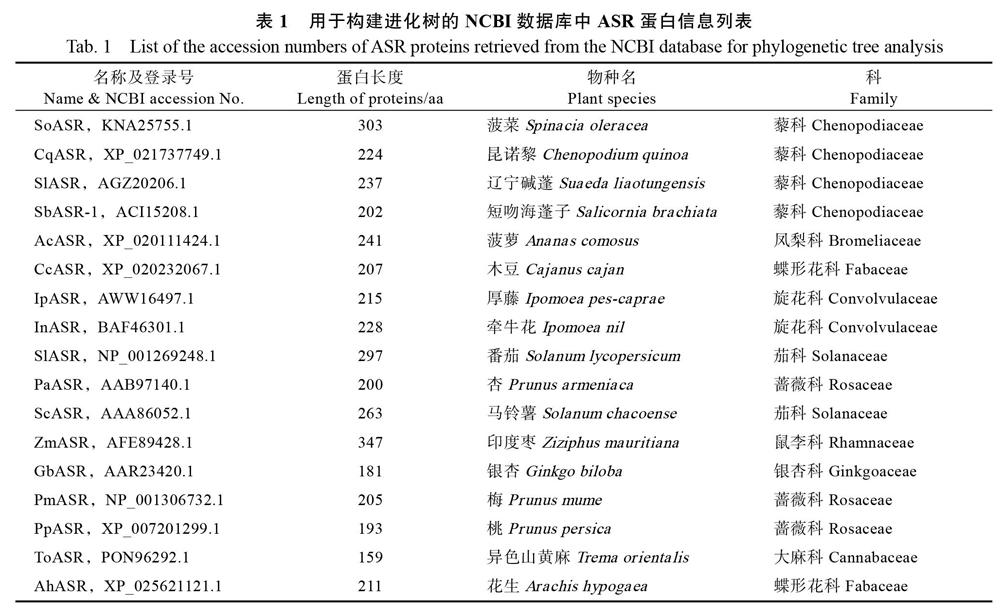
1.2.2 序列的生物信息学分析 根据番杏TtASR的氨基酸序列信息,采用SmartBLAST(https:// blast.ncbi.nlm.nih.gov/smartblast/?LINK_LOC=BlastHomeLink)查找NCBI数据库中登陆的ASR蛋白同源序列。采用MEGA6中的Clustal W程序进行序列同源性比对并构建Neighbor-joining analysis(分析重复数为1000)的进化树。参与构建TtASR进化树的其他17种植物ASR成员信息如表1所示。
采用PHYRE2程序(http://www.sbg.bio.ic. ac.uk/phyre2/html/page.cgi?id=index)分析TtASR蛋白无序度和三维结构。TtASR的氨基酸含量,稳定性和亲水性等其他理化性质采用ExPASy数据库中的ProtParam程序(http://web.expasy.org/ protparam/)进行预测。
1.2.3 大肠杆菌蛋白表达载体的构建和蛋白的诱导 以含有TtASR的cDNA的质粒为模板,采用高保真DNA聚合酶ProbestTM DNA Polymerase扩增番杏TtASR基因的阅读框序列。所采用的引物为TtASREF(5′-GGGGCCCCTGGGATCCAT GGCCGAAAGCCGTGACAG-3′)和TtASRER(5′-GGAATTCCGGGGATCCTTAAAAGAAGTGGTGCTTCT-3′),PCR反应体积为50 μL。PCR扩增反应体系为:10 × PCR Buffer 5 μL,10 mmol/L dNTP Mixture 4 μL,10 μmol/L TtASREF 1 μL,10 μmol/L TtASRER 1 μL,ProbestTM DNA Polymerase 0.5 μL,cDNA模板2 μL(10 ng/μL),ddH2O 36.5 μL。各种成分混匀后置于PCR仪上进行反应。反应程序为:94 ℃预变性4 min;94 ℃变性45 s、56 ℃退火50 s、72 ℃延伸50 s,30个循环;最后72 ℃延伸5 min。
PCR产物通过1%的琼脂糖凝胶电泳检测,可获得单一的DNA条带(约750 bp),此即为PCR扩增得到的TtASR基因的cDNA阅读框片段。该DNA片段依照Magen公司HiPure Gel Pure DNA Kits说明书进行琼脂糖凝胶电泳回收。
大肠杆菌蛋白表达载体pGEX 6p-1经BamHI单酶切处理,回收线性化载体。回收TtASR的PCR片段和线性化pGEX 6p-1载体经NanoDrop公司紫外分光光度计测定浓度,采用TaKaRa公司的In-Fusion? HD Cloning Kit进行DNA片段和载体的同源重组连接。按照说明书的方法将反应产物转化大肠杆菌JM109(TaKaRa公司)感受态菌株。挑取单克隆,提取质粒,经测序鉴定为正确的阳性克隆后,提取质粒转化大肠杆菌蛋白表达菌株BL21(DE3)。
挑取阳性克隆接種于3 mL含氨苄霉素的液体LB培养基中,37 ℃,200 r/min振荡培养过夜至OD600为0.5~0.8,以1∶100的比例扩大培养,当OD600至0.5左右时,加IPTG至终浓度为0.2 mmol/L,诱导4 h。离心收集菌体,加入1/10体积的2SDS上样缓冲液,煮沸10 min,进行SDS-PAGE电泳。其中转化空载体pGEX 6p-1的BL21(DE3)菌株作为对照。
1.2.4 大肠杆菌表达TtASR蛋白对细菌抗逆性的影响 取0.2 mmol/L IPTG诱导4 h后的菌液(包括插入TtASR的pGEX6p-1和空载体pGEX6p-1对照),调整浓度为OD600约等于1,按照1∶1、1∶10、1∶100、1∶1000将菌液进行逐级稀释,分别吸取2 ?L逐级稀释的菌液滴至添加有1% NaCl(对照,170 mmol/L NaCl)、3% NaCl(高盐胁迫,510 mmol/L NaCl)和4% NaCl(高盐胁迫,680 mmol/L NaCl)的LB培养基(培养基中添加终浓度为0.2 mmol/L的IPTG和0.1 μg/mL的氨苄抗生素)上,37 ℃培养12~36 h,观察表达GST- TtASR蛋白的大肠杆菌耐盐生长情况。
同样,将上述菌液逐级稀释后,分别吸取2 ?L菌液滴至添加有1、1.5 mol/L甘露醇以及2、4 mmol/L的H2O2的LB培养基(培养基中添加终浓度为0.2 mmol/L的IPTG和100 μg/mL的氨苄西林)上,37 ℃培养12~36 h,观察表达GST-TtASR蛋白的大肠杆菌耐渗透压和抗氧化生长情况。
2 结果与分析
2.1 TtASR基因编码一个富含甘氨酸的亲水性固有无序蛋白
通过对番杏cDNA文库单克隆的随机测序,获得一个编码ASR蛋白的全长cDNA,命名为TtASR。TtASR共长1112 bp,其中5′非翻译区为75 bp,3′非翻译区为314 bp,编码区长度为723 bp,编码一个含有240氨基酸的ASR蛋白TtASR。TtASR的N端富含甘氨酸;而其靠近C端含有ASR蛋白共有的ABA和水分胁迫结构域(ABA/WDS domain);在C末端含有一个核定位序列NLS(nuclear localization signal),推测TtASR可能分布于细胞核。
采用PHYRE2程序分析TtASR的无序性,显示84%的TtASR氨基酸序列为无序状态,表明该蛋白为固有无序蛋白(intrinsically disordered protein,IDP)。
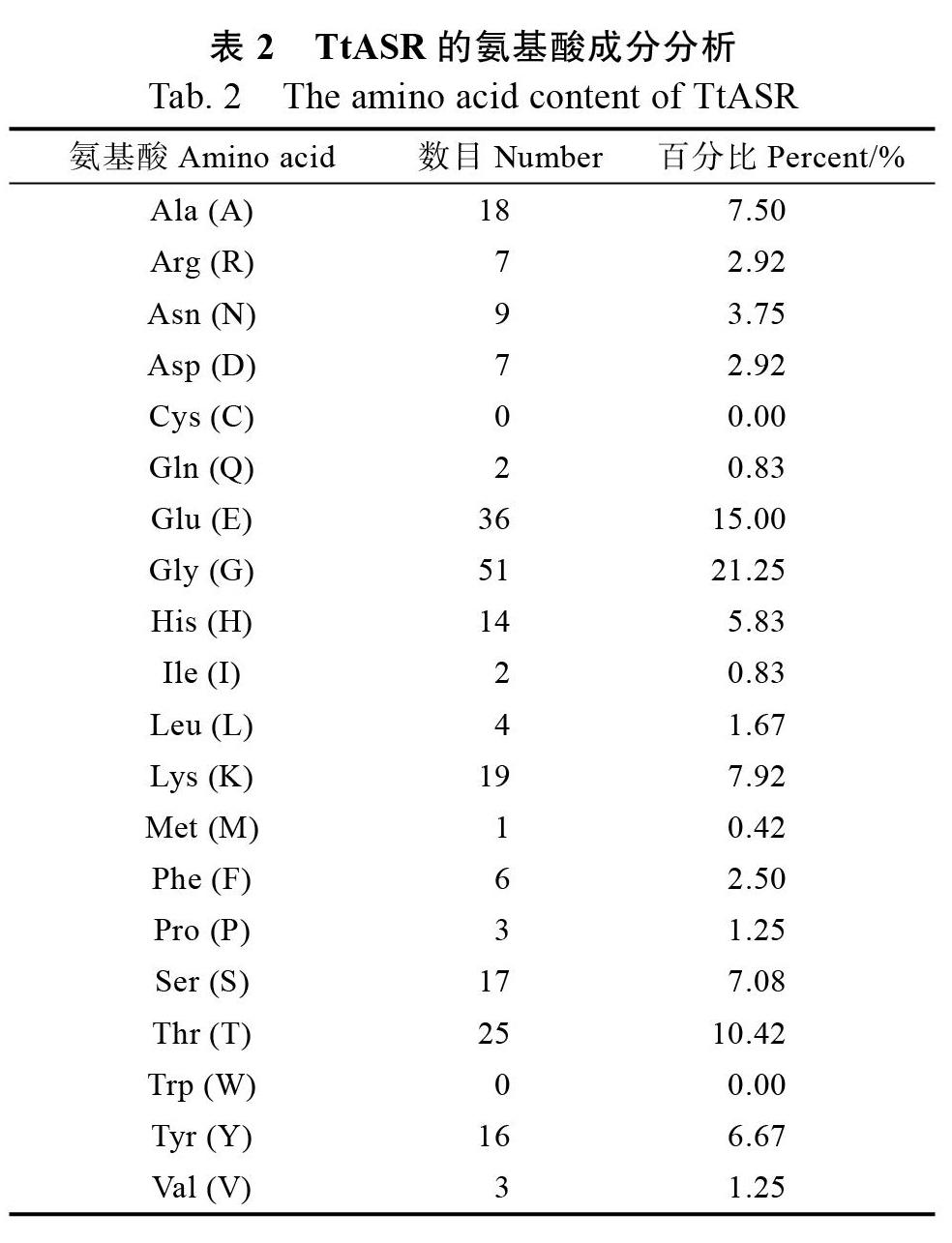
采用ProtParam程序分析TtASR的氨基酸成分及稳定性和亲水性,表明TtASR的理论分子量为25.29 ku,理论等电点为5.26。TtASR的蛋白不稳定指数为30.51,是一个比较稳定的蛋白分子。TtASR的总平均亲水指数(GRAVY)为?1.369,属于高度亲水性蛋白(<0)。如表2所示,TtASR富含中性氨基酸Gly(G,21.25%);亲水性氨基酸Glu(E,15%),Ser(S,7.08%)和Thr(T,10.42%)含量也较高;而疏水性氨基酸Ile(I,0.83%),Leu(L,1.67%),Met(M,0.42%),Phe(F,2.5%),Pro(P,1.25%)和Val(V,1.25%)含量较低。Trp(W)和Cys(C)2种氨基酸含量为0。
2.2 TtASR编码氨基酸序列的同源性及系统进化分析
经MEGA6中的Clustal W程序分析,TtASR的与菠萝AcASR(XP_020111424.1)和野生马铃薯ScASR(AAA86052.1)2个ASR蛋白的进化关系较近。构建TtASR与其他17种植物的ASR氨基酸序列系统进化树,结果表明番杏TtASR与滨海植物海蓬子SbASR-1(ACI15208.1)和辽宁碱蓬SlASR(AGZ20206.1),以及耐旱作物藜麦CqASR(XP_021771569.1)和菠菜SoASR(KNA25755.1)也具有较高的同源性。
2.3 GST-TtASR融合蛋白的诱导表达
将鉴定为阳性的含有TtASR-pGEX 6p-1重组质粒的BL21(DE3)菌体经过终浓度为0.2 mmol/L的IPTG分别诱导不同时间。将诱导表达的蛋白经SDS-PAGE电泳检测,结果表明在诱导4 h后出现一条明显的诱导蛋白带,与预期大核苷酸序列上的2个方框分别是翻译起始密码子ATG和终止密码子TAA。蛋白质序列上的2个方框分别是ABA和水分胁迫结构域(ABA/WDS domain),双向细胞核定位信号NLS(Nuclear localization signal)。
小一致(GST-TtASR融合蛋白,约53 ku),而转化pGEX 6p-1空载体的BL21(DE3)菌体在诱导4 h后在27 ku位置出现的明显的GST诱导条带,二者的分子量差别约为25 ku,与TtASR预测的分子量大小一致,表明带有GST标签的TtASR蛋白在大肠杆菌中得到了正确的表达,且在IPTG诱导4 h具备较大的表达量。
2.4 TtASR蛋白在大肠杆菌中的诱导表达能够提高细菌对高盐、渗透压和氧化胁迫的耐受性
诱导表达GST-TtASR的转基因大肠杆菌相比较于转化空载体pGEX 6p-1的大肠杆菌而言,能够在添加3%、4% NaCl的高盐培养基平板上生长,也能在添加1、1.5mol/L甘露醇的LB培养基平板上生长;而单独表达GST的大肠杆菌(转化空载体pGEX 6p-1)则几乎不能生长,表明TtASR蛋白在大肠杆菌中的表达能够提高细菌对高盐和高渗透压胁迫的耐受性。同样,诱导表达GST-TtASR的转基因大肠杆菌相比较于转化空载体pGEX 6p-1的大肠杆菌而言,能够在添加2 mmol/L H2O2的LB培养基平板上生长,且生长状况良好,而在添加4 mmol/L H2O2的LB培养基平板上也可以较好生长;而单独表达GST的大肠杆菌(转化空载体pGEX 6p-1)则生长受到轻微抑制,表明TtASR蛋白的表达能够提高大肠杆菌对氧化胁迫的耐受性。
3 讨论
植物在生长发育过程中,通常会遭遇多种逆境胁迫并对生长产生不利的影响,而高盐、干旱以及冷冻造成的细胞内水分缺失是常见的逆境胁迫。植物在适应这些逆境的长期进化过程中,发展了一系列的生理及分子机制减缓逆境对其自身生长发育的伤害,并维持植物体完成正常的生长周期和世代交替。盐生植物可在高盐环境下正常生长并完成其生活周期,是因其长期适应环境中高盐、高渗透压的缺水环境,在体内产生了独特的细胞内抗逆机制[21],故而是耐盐功能基因及启动子的重要来源[5]。
番杏是一种盐生型保健蔬菜,可在海水倒灌的高盐地区生长并改良土壤[1, 3]。本研究从番杏中挖掘了一个耐盐功能基因TtASR。序列分析表明,TtASR蛋白除了含有ASR蛋白高度保守的ABA/WDS结构域外,还有一个明显的特征是富含甘氨酸(G,glycine,21.25%)。进化树分析表明,另外2个盐生植物的ASR成员SlASR(AGZ20206.1)和SbASR-1(ACI15208.1)也富含甘氨酸,含量分别为24.47%和25.25%。已有研究报道,SlASR和SbASR-1均可以提高转基因植物的耐盐性[17-19],表明这两者均为植物耐盐功能基因。本研究中,序列同源性分析及在大肠杆菌中的功能初步分析表明,TtASR基因也可能是番杏体内重要的耐盐功能基因。
植物富含甘氨酸的蛋白(glycine-rich protein,GRP)构成了植物体内重要的一类抗逆功能蛋白超家族,参与调控植物应答温度胁迫、高盐、干旱、渗透压以及机械伤害和生物胁迫的多重反应[22-23]。植物GRP基因参与调控盐旱及氧化胁迫已在多个物种中得到了验证[22]。拟南芥AtGRP2和AtGRP4均提高转基因超表达植株的耐盐性[24]。烟草NtGR-RBP1在大肠杆菌中表达提高细菌对高盐、高温和高渗透压的耐受性[25]。小立碗藓(Physcomitrella patens)的GRP型脱水素基因PpDHNA参与小立碗藓调控细胞的耐盐耐旱性[26]。考虑番杏TtASR具有植物GRP蛋白的特征,以及含有ABA/WDS结构域,且能提高大肠杆菌的耐盐耐旱能力,我们可以进一步推断番杏TtASR基因可以提高植物对盐旱胁迫的耐受性,相关的植物方面的功能研究以及转TtASR基因作物能否成功用于抗逆育种并有待于进一步研究。
参考文献
赖正锋, 李华东. 番杏的生物学特征及其栽培新技术[J]. 福建热作科技, 2007, 32(3): 22, 46.
林更铭, 骆建宁, 项 鹏. 利用冬闲海水养殖池塘种植番杏的初步探讨[J]. 农业科技通讯, 2014, 11: 117-119.
王 蕾, 吴朝波, 徐微风, 等. 海水胁迫对番杏生长、渗透调节物质和细胞膜透性的影响[J]. 江苏农业科学, 2016, 44(7): 248-251.
Wilson C, Lesch S M, Grieve C M. Growth stage modulates salinity tolerance of New Zealand spinach (Tetragonia tetragonioides, Pall.) and red orach (Atriplex hortensis L.)[J]. Annals of Botany, 2000, 85: 501-509.
Mishra A, Tanna B. Halophytes: potential resources for salt stress tolerance genes and promoters[J]. Frontiers in Plant Science, 2017, 8: 829.
王永泰. 鹽土植物和盐土改良[J]. 生物学通报, 1991, 6: 12-17.
Roy S J, Negr?o S, Tester M. Salt resistant crop plants[J]. Current Opinion in Biotechnology, 2014, 26: 115-124.
Munns R, Tester M. Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology, 2008, 59: 651-681.
Zhu J K. Salt and drought stress signal transduction in plants[J]. Annual Review of Plant Biology, 2002, 53: 247-273.
González R M, Iusem N D. Twenty years of research on Asr (ABA-stress-ripening) genes and proteins[J]. Planta, 2014, 239: 941-949.
Frankel N, Carrari F, Hasson E, et al. Evolutionary history of the Asr gene family[J]. Gene, 2006, 378: 74-83.
Golan I, Dominguez P G, Konrad Z, et al. Tomato abscisic acid stress ripening (ASR) gene family revisited[J]. PLoS ONE, 2014, 9: e107117.
Canel C, Bailey-Serres J N, Roose M L. Pummelo fruit transcript homologous to ripening-induced genes[J]. Plant Physiology, 1995, 108: 323-1324.
Dominguez P G, Carrari F. ASR1 transcription factor and its role in metabolism[J]. Plant Signaling & Behavior, 2015, 10: e992751.
Yang C Y, Chen Y C, Jauh G Y, et al. A Lily ASR protein involves abscisic acid signaling and confers drought and salt resistance in Arabidopsis[J]. Plant Physiology, 2005, 139(2): 836-846.
Dai J R, Liu B, Feng D R, et al. MpAsr encodes an intrinsically unstructured protein and enhances osmotic tolerance in transgenic Arabidopsis[J]. Plant Cell Reports, 2011, 30: 1219-1230.
Jha B, Lal S, Tiwari V, et al. The SbASR-1 gene cloned from an extreme halophyte Salicornia brachiata enhances salt tolerance in transgenic tobacco[J]. Mar Biotechnol(NY), 2012, 14(6): 782-792.
Tiwari V, Chaturvedi A K, Mishra A, et al. Introgression of the SbASR-1 gene cloned from a halophyte Salicornia brachiate enhances salinity and drought endurance in transgenic groundnut (Arachis hypogaea) and acts as a transcription factor[J]. PLoS ONE, 2015, 10: e0131567.
Hu Y X, Yang X, Li X L, et al. The SlASR gene cloned from the extreme halophyte Suaeda liaotungensis K. enhances abiotic stress tolerance in transgenic Arabidopsis thaliana[J]. Gene, 2014, 549: 243-251.
Li J, Dong Y, Li C, et al. SiASR4, the target gene of SiARDP from Setaria italica, improves abiotic stress adaption in plants[J]. Frontiers in Plant Science, 2017, 7: 2053.
Glenn E P, Brown J J, Blumwald E. Salt tolerance and crop potential of halophytes[J]. Critical Reviews in Plant Sciences, 1999, 18: 227-255.
Czolpinska M, Rurek M. Plant glycine-rich proteins in stress response: an emerging, still prospective story[J]. Frontiers in Plant Science, 2018, 9: 2.
Mangeon A, Junqueira R M, Sachetto-Martins G. Functional diversity of the plant glycine-rich proteins superfamily[J]. Plant Signaling & Behavior, 2010, 5(2): 99-104.
Kim Y O, Pan S, Jung C H, et al. A zinc finger-containing glycine-rich RNA-binding protein, atRZ-1a, has a negative impact on seed germination and seedling growth of Arabidopsis thaliana under salt or drought stress conditions[J]. Plant Cell and Physiology, 2007, 48(8): 1170-1181.
Jabeen B, Naqvi SM, Mahmood T, et al. Ectopic expression of plant RNA chaperone offering multiple stress tolerance in E. coli[J]. Molecular Biotechnology, 2017, 59(2-3): 66-72.
Saavedra L, Svensson J, Carballo V, et al. A dehydrin gene in Physcomitrella patens is required for salt and osmotic stress tolerance[J]. The Plant Journal, 2006, 45(2): 237-249.
