注射器和酵母菌液在“pH影响过氧化氢酶活性”实验中的应用
2019-06-19张粒
张 粒
(浙江省宁波北仑泰河中学 宁波 315800)
1 引言
“影响酶活性的因素”是浙科版高中生物学必修1《分子与细胞》中第一个探究实验,是引导学生进行探究性学习、发展科学思维的好材料。浙科版、苏教版、人教版在“探究pH对酶活性影响实验”的酶种选择上都采用过氧化氢酶,浙科版建议以猪肝研磨液作为过氧化氢酶的来源,采用排水集气法测定单位时间内产生气体的体积定量分析过氧化氢酶活性。是否能改进装置,使操作更简便,同时可定量且同步测定不同pH条件下过氧化氢酶的活性;能否优化实验设计,深入探讨过酸或过碱对过氧化氢酶活性有何影响。笔者结合教学实践,进行了如下改进。
2 实验方法与优化
2.1 装置优化——两通注射器 50 mL注射器两支,通过两通管连接,一支注射器加入酶溶液,另一支加入H2O2溶液;将H2O2溶液注射到酶溶液中,反应开始记录单位时间内注射器中气体的变化量作为酶活性的检测指标。改进后的装置使反应发生和定量测定在同一个注射器中进行,操作更简便,数据更易获得,同时可以定量控制酶和底物的用量。装置的气密性检测可通过一支注射器活塞拔出5 mL,组装成两通注射器后浸没在水面之下,推动活塞将注射器中气体推入另一支,此过程若无气泡产生,即装置气密性良好。

图1 改进的实验装置两通注射器
2.2 材料优化——单细胞真菌酵母 为解决传统实验材料鲜肝匀浆和马铃薯匀浆的制备过程中需要研磨、保存不便的弊端,以及多细胞生物内环境中pH缓冲对可能引起的对实验变量的干扰,联想到酶的发现史中早期酶的研究是从酿酒酵母开始,因此选择安琪干酵母粉,用蒸馏水配制2%酵母溶液备用(不使用葡萄糖溶液配制是为防止酵母自身呼吸作用产生的CO2影响因变量的检测),酵母菌作为单细胞生物,不存在内环境中pH缓冲对,可减少对自变量设置的干扰;同时酵母菌中过氧化氢酶含量和活性都大大超过鲜肝,效果理想,反应迅速。
2.3 pH缓冲液范围及处理优化 H2O2对酸碱度变化(特别是碱性条件下)相比温度升高更敏感[1],随着pH的增大,H2O2自分解明显加快,而酸性环境中H2O2较稳定。为此,用Na2HPO4-柠檬酸缓冲液(0.2 mol/L Na2HPO4和0.1 mol/L柠檬酸)作为母液,并减少碱性pH梯度的设置,利用笔式酸度计调节pH4.0、pH5.0、pH6.0、pH7.0、pH8.0五个梯度,将2%酵母溶液和4% H2O2同时调节至相应pH。
2.4 定量实验设计优化 将对应pH处理的4%H2O2溶液和2%酵母溶液各4 mL加入到注射器中,搭建好装置,利用装置同步向对应酵母菌溶液中推入H2O2,记录1 min、2 min、3 min注射器内O2变化量,统计O2平均释放速率(mL/min),以实现pH对过氧化氢酶活性影响的探究。
将pH4.0和pH8.0处理的酵母菌溶液恢复到适宜的pH条件,催化效率会变化吗?基于学生提出的问题,利用该装置设计将缓冲液pH4.0和pH8.0处理酵母菌溶液后再恢复至上个实验中酵母过氧化氢酶活性较高的pH6.0条件,以探究过酸或过碱处理对酶活性的不同影响。
3 实验结果
3.1 pH对酵母菌过氧化氢酶活性的影响实验 pH对过氧化氢酶活性影响明显(表1),随着pH增大,酶活性先增强后减小,pH6.0时酵母菌中过氧化氢酶活性较强(图2)。
3.2 过酸或过碱处理对酵母菌过氧化氢酶活性的影响 当pH4.0和pH8.0处理的酵母菌过氧化氢酶恢复至最适pH,催化H2O2分解产生O2的速率(表2)并未明显提升(图3),由此可知过酸、过碱使酶不可逆地部分失活。
4 讨论
本实验也有类似装置的研究成果发表,如利用塑料软泡做反应室与注射器相连制作定量测定装置[2],或用注射器吸取过氧化氢酶,用针头扎穿试管塞使反应在试管中发生[3]。笔者认为其都有一弊端: 反应室与集气室的分离会导致剧烈反应产生的气泡堵住连接处而引起集气量的误差,而本实验中反应室与集气室在同一注射器中进行,另一注射器由于隔板的固定作用而活塞无法移位,这样大大减少集气误差。本装置的适用性和实用性较广,在酶实验中涉及酶的专一性、高效性的探究,甚至包括不同酶浓度和不同底物浓度对反应速率的影响均可以使用该装置,实现一装置,多用途。传统材料的摒弃,取而代之是市售干酵母,排除自身pH缓冲对的干扰,也更加简便,成本低廉,实验效果和效率都能大幅提升,使“影响酶活性的因素”的探究在一节课中完成变为可能;也有教师用固定化技术固定酵母[4]或用滤纸片固定肝脏研磨液中过氧化氢酶[5],同样也可达到较理想的效果。在pH缓冲液设置中避免强碱对H2O2自分解的影响,选用较低浓度4%H2O2溶液,且pH梯度设置在较为合理的pH4.0~pH8.0范围;在教材实验基础和学生的质疑中优化方案,尝试探究了过酸、过碱处理的酶恢复至最适pH后酶活性的差异,更直观有效地说明过酸、过碱使酶失活。
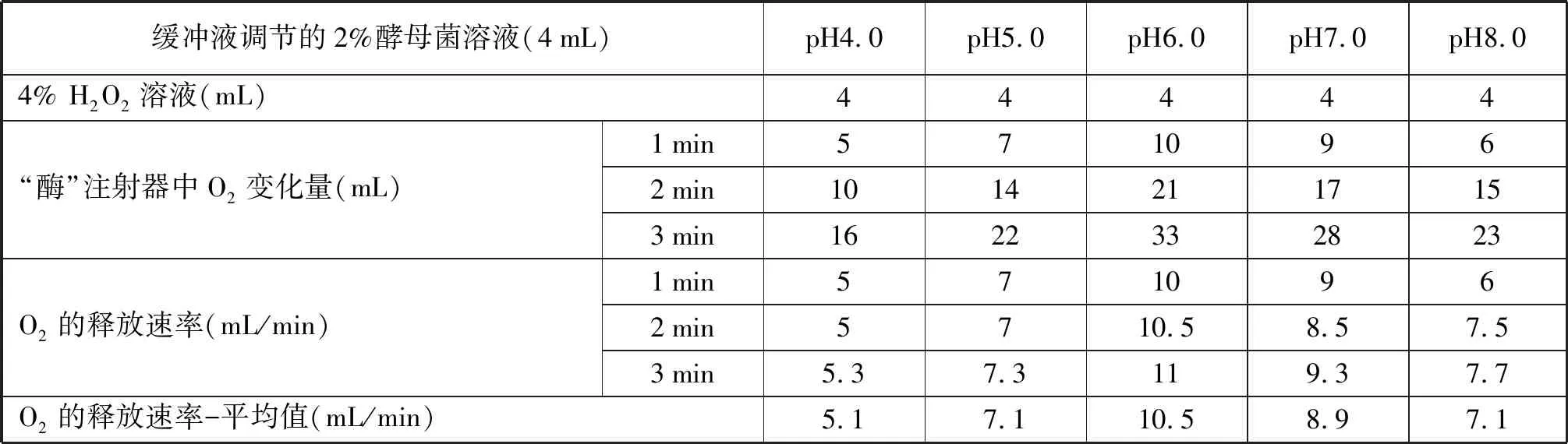
表1 不同pH下酵母菌中过氧化氢酶催化H2O2产生O2的速率
A. 3 min时注射器体积

B. 不同pH下过氧化氢酶的催化反应速率

缓冲液调节的2%酵母菌溶液(4mL)pH4.0pH4.0恢复至pH6.0pH6.0pH8.0恢复至pH6.0pH8.04%H2O2溶液(mL)44444“酶”注射器中O2变化量(mL)1min5610762min10122213143min1617322322O2的释放速率(mL/min)1min5610762min56116.573min5.35.710.77.77.3O2的释放速率-平均值(mL/min)5.15.910.67.16.8

A. 3 min时注射器体积

B. pH恢复后过氧化氢酶的催化反应速率
