低乳糖发酵乳的制备
2019-06-18陶志强王丽马雁陈萱赵瑞峰张栋陆震印伯星关成冉
陶志强 王丽 马雁 陈萱 赵瑞峰 张栋 陆震 印伯星 关成冉

摘 要:目的:制备一款低乳糖发酵乳。方法:以12%全脂乳粉与6%蔗糖为基础,利用乳糖酶直接酶解,通过单因素实验及正交实验对乳糖酶的添加量、酶解温度及酶解时间进行优化,并对制备的发酵乳的发酵特性及质构进行分析。结果:酶添加量0.8μL/g,酶解温度46℃,水解时长4.5h,乳糖的水解率为99.54%。在此条件下制备低乳糖发酵乳,低乳糖发酵乳发酵过程中酸度变化快,酸度值为78.20°T,表观黏度在9.82~15.82Pa·s,觸变性最大值为8.96Pa·s。
关键词:低乳糖发酵乳;乳糖酶;水解;质构
中图分类号 TS252.54 文献标识码 A 文章编号 1007-7731(2019)09-0025-5
Abstract:Objective:Preparation fermented milk with low lactose.Method:The 12% whole milk powder and 6% sucrose was digested by lactase enzyme.By single factor test and orthogonal test, the optimization of lactase dosage, temperature and time of enzymolysis were optimized.And then the fermentation characteristics and texture of the prepared fermented milk were analyzed.Result:The results showed that the optimized amount of enzyme addition, the hydrolysis temperature and the hydrolysis time were seperately 0.8μL/g, 46℃and 4.5h.The hydrolysis rate of lactose in fermented milk is 99.54%.Under this condition, the low lactose fermented milk was prepared.The acidity of the low lactose fermented milk was rapidly changed, and the acidity value was 78.2。T.The apparent viscosity was between 9.82Pa·s and 15.82Pa·s, and the maximum thixotropy was 8.96Pa·s.
Key words:Low lactose fermented milk; Lactase; Hydrolysis; Texture
随着我国经济社会的迅速发展,人民生活的持续改善,人们对食品的要求也越来越高。近几年来,我国乳业发展十分迅速,与世界平均水平的差距正逐渐缩小。目前,制约我国乳业发展的一个重要原因就是消费者中普遍存在乳糖不耐症[1]。乳糖需要乳糖酶的协助才能被消化吸收,而我国大多数人都存在不同程度的乳糖酶缺乏症,肠上皮细胞的乳糖酶在体内缺乏或处于活性不足的边缘,乳糖不能被完全消化吸收,大量的短链脂肪酸和氢气在肠内积聚,从而出现腹胀甚至呕吐、腹泻、消化不良等症状[2-3]。乳酸菌发酵乳可在一定程度上缓解乳糖不耐症[4],然而在乳酸菌发酵乳发酵过程中,仅有20%~30%的乳糖被乳酸菌分解,其乳糖水解率相比较于酶解法来说很低。为此,研究者利用商品级乳糖酶[5],配合进口奶粉和混合菌株,应用酶解技术和发酵技术制备低乳糖发酵乳,以改善国内乳制品市场结构,满足更多的消费者的需求。
1 材料与方法
1.1 材料
1.1.1 菌株与主要试剂 本实验所用嗜热链球菌和保加利亚乳酸杆菌混合菌株HT456B购自意大利SACCO。全脂乳粉,扬大康源;脱脂乳粉,新西兰;乳糖、蔗糖、乳糖酶、胰蛋白胨、葡萄糖吐温-80甲醇、1-苯基-3-甲基-5-吡唑酮(PMP)等化学试剂,国药集团。
1.1.2 仪器与设备 JF-SX-500高压蒸汽灭菌锅,日本TOMYG公司;PL2002电子天平,梅特勒公司;GYB60-08高压均质机,上海东华高压均质机厂;HH-6数显恒温水浴锅,国华电器有限公司;DNP-9272恒温培养箱,上海精宏实验设备有限公司;ZXWY-Vortex-Genie涡旋仪,美国Scientific Industries公司;高效液相色谱仪,Agilent 1260 Infinity;TMS-PRO质构仪,美国TMS公司。
1.1.3 培养基 MRS液体培养基:牛肉浸膏10g、酵母浸膏5g、无水醋酸钠5g、胰蛋白胨10g、葡萄糖20g、吐温-80 1mL、K2HPO4 2g、MgSO4·7H2O 0.58g、MnSO4·4H2O 0.25g、水1000mL(固体培养基按1.5%加入琼脂)。12%脱脂乳培养基:脱脂乳粉120g,水880g。
1.2 实验方法
1.2.1 菌株活化 取实验室冻藏的菌粉,于MRS液体培养基中活化3代,12%脱脂乳培养基活化第4代,将活化好的菌株4℃保存备用。
1.2.2 原料乳的配制 将全脂乳粉与蔗糖以12%和6%的质量比进行配置,过筛;将牛乳进行均质,低压40~50Bar,高压200~220Bar;将均质后的牛乳定容150g装瓶,放入水浴锅进行巴氏杀菌。待产品冷却后,4℃冷藏备用。
1.2.3 酶解条件的优化
1.2.3.1 添酶量的优化 将配置好的乳在43℃分别以0.13μL/g、0.27μL/g、0.40μL/g、0.53μL/g、0.67μL/g、0.80μL/g的浓度添加乳糖酶,水解2h后,95℃灭酶5min,冷却后于4℃冷藏备用。将上述样品进行样品前处理后进行HPLC色谱分析,确定乳糖酶的最适添加量。
1.2.3.2 酶解温度的优化 将配置好的乳在37℃、40℃、43℃、46℃、49℃、52℃、55℃时,分别以0.40μL/g的浓度比添加乳糖酶,水解2h后,95℃灭酶5min,冷却后于4℃冷藏备用。将上述样品进行样品前处理后进行HPLC色谱分析,确定乳糖酶酶解的最适温度。
1.2.3.3 酶解时间的优化 将配置好的乳在43℃分别以0.40μL/g的浓度比添加乳糖酶,在43℃分别水解0.5h、1h、1.5h、2h、2.5h、3h、3.5h、4h、4.5h,水解結束后,95℃灭酶5min,冷却后于4℃冷藏备用。将上述样品进行样品前处理后进行HPLC色谱分析,确定乳糖酶酶解的最适时间。将以上牛乳以3%的接菌量,在42℃发酵至酸度60℃,并在4℃后酸化12h,取10mL样品备用[6]。
1.2.4 酶解条件正交优化 确定了乳糖酶酶解的添酶量、酶解温度和酶解时间以后,将筛选出来的最佳添酶量、酶解温度和酶解时间设计3因素3水平正交实验对低乳糖牛乳进行优化。正交因素水平见表1。
1.2.5 发酵乳参数测定
1.2.5.1 乳糖含量 样品衍生采用王柳[7]等方法进行,利用高效液相色谱进行乳糖含量的测定。测定条件:ZORBAX Eclipse XDB-C18色谱柱(4.6×150mm,5μm),流动相为纯乙腈和浓度为100mmol/L,pH5.5的乙酸铵溶液,体积比为22∶78;流速为1mL/min;柱温为30℃;进样量为10μL;测定波长选择244nm。
1.2.5.2 酸度 参照国标[8]的方法采用NaOH滴定法进行测定。
1.2.5.3 乳酸菌活菌总数 参照国标[9]的方法采用平板记数法进行测定。
1.2.5.4 低乳糖发酵乳流变特性 利用Malvern Kinexus Pro旋转流变仪,选用CP2/50 SR0162 SS锥板,对样品的触变性和表观粘度进行测定[8]。
1.2.5.5 表观粘度 在25℃、恒定剪切速率1.0-1的条件下,剪切时间为2min,每10h采集1个数据点,检测样品的表观粘度随时间的变化情况。
1.2.5.6 触变性及触变环面积 在25℃,分升速和降速2个步骤进行测定,首先升速过程剪切速率由0.1-1线性升高到100-1,每2h采集1个数据,测定时间为2min;降速过程剪切速率到达100-1后再线性降速到0.1-1,每2h采集1个数据,测定时间为2min,检测样品剪切应力随剪切速率的变化关系。
2 结果与分析
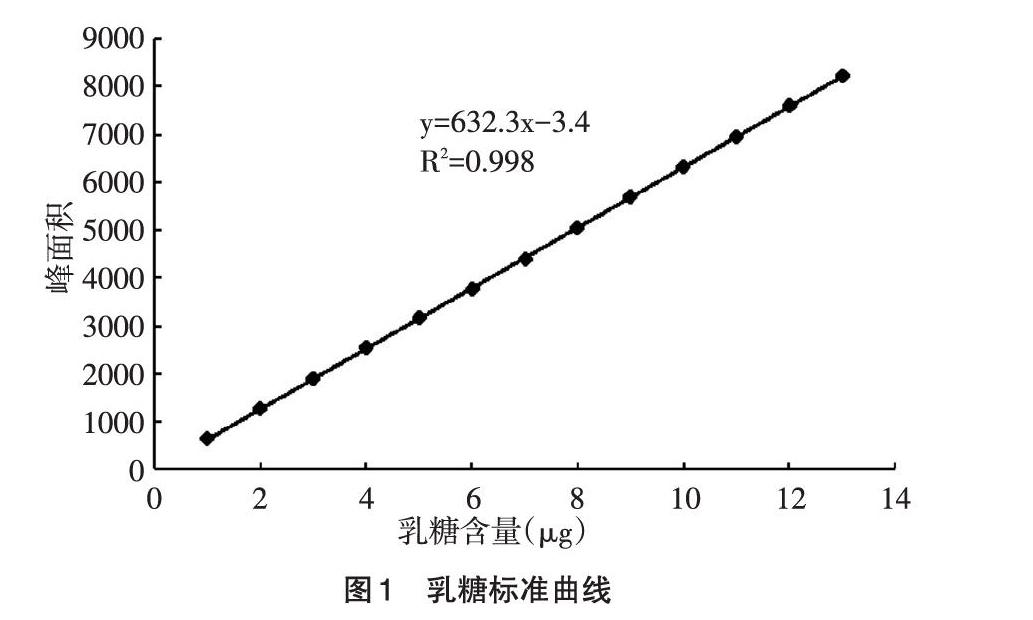
2.1 乳糖标准曲线的制作 精准吸取标准单糖溶液2μL、4μL、6μL…14μL,以峰面积(y)与其中乳糖含量(x)制作标准曲线、回归方程、相关系数。乳糖标准曲线如图1所示。
2.2 乳糖酶酶解条件的选择
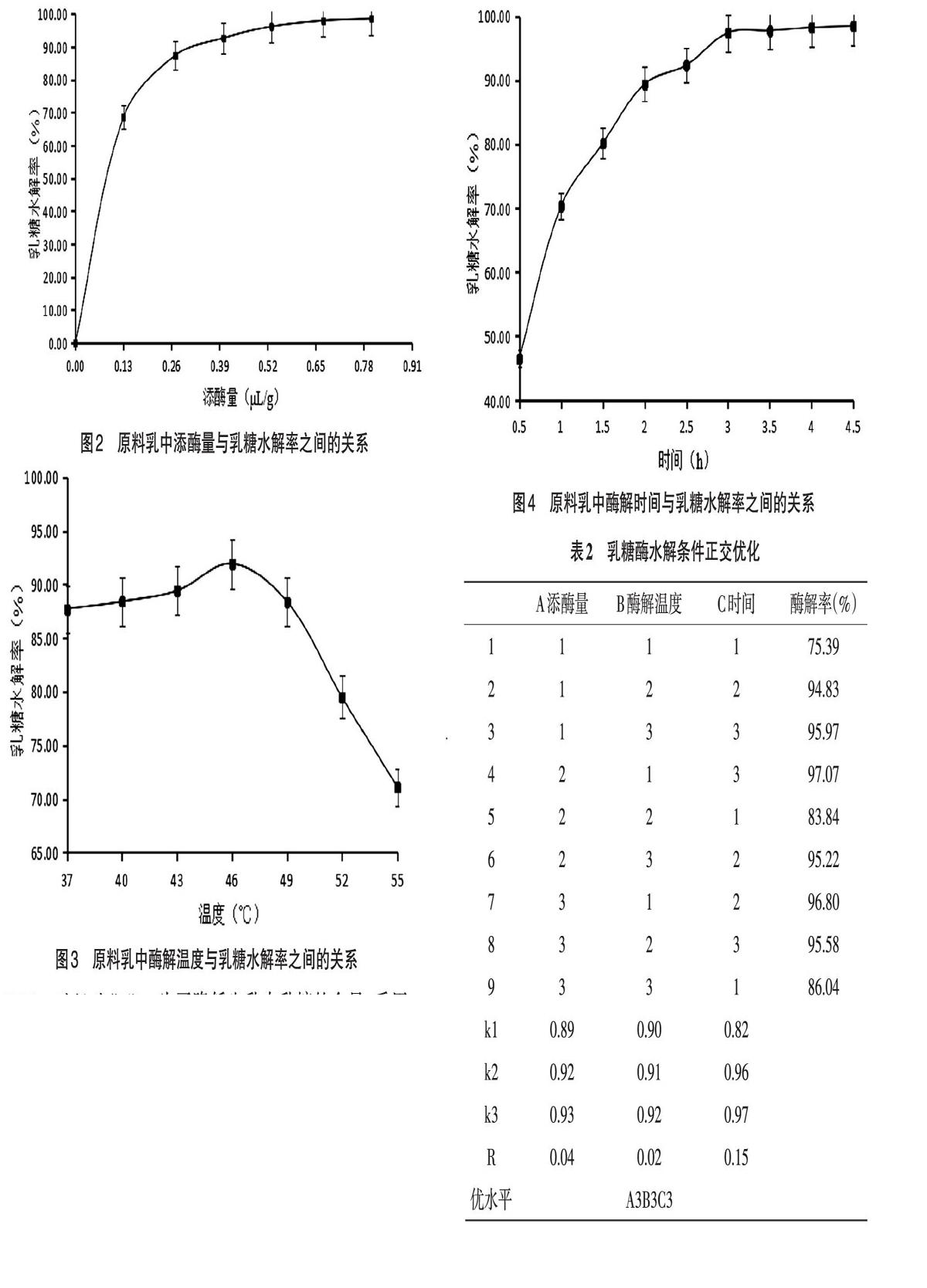
2.2.1 酶添加量的优化 为了降低牛乳中乳糖的含量,采用酶水解法[10],进行酶添加量优化的实验。由图2可知,在43℃,酶解2h的条件下,随着添酶量的增加,乳糖酶解率逐渐增加,当超过0.53μL/g趋于平缓。表明随着乳糖酶的添加量的逐渐增大,牛乳中的乳糖逐渐被水解,而当添酶量达到一定数值以后,剩余可被水解的乳糖变少,此时酶解率很难再升高。因此,在使用乳糖酶酶解乳糖时,乳糖酶的添加量在0.53μL/g以上即可。
2.2.2 温度的优化 为了选出合适的温度以水解牛乳中的乳糖,使用实验方法中所述的几个温度,进行酶解温度优化的实验[11]。其他条件保持不变,酶添加量150g到乳中,0.06mL即4×10-4mL/g,酶解2h的情况下,只改变酶解温度。由图3可知,随着温度的增加,乳糖酶解率先增高,而后逐渐降低,这是因为乳糖酶有1个最适反应温度。随着温度的升高,乳糖酶的水解效率逐渐增高,在达到最适温度后,温度的继续升高会使乳糖酶逐渐失活,从而使水解效率下降。因此,在使用乳糖酶酶解乳糖时,温度以46℃左右为宜。
2.2.3 时间的优化 为了降低牛乳中乳糖的含量,采用酶水解法,添加0.06mL的乳糖酶,在43℃分别水解0.5h、1h、1.5h、2h、2.5h、3h、3.5h、4h、4.5h,进行酶解时间优化的实验。其他条件保持不变,在添酶量0.06mL,酶解温度43℃的条件下只改变酶解时间。由图4可知,随着时间的增加,乳糖酶解率先逐渐增加,而后趋于平缓。为保证酶解率,在使用乳糖酶酶解乳糖时,酶解时间以3h以上为宜。
2.3 乳糖酶水解条件正交优化 为了得出水解率更高的低乳糖牛乳,根据优化后3个因素的数据进行正交优化实验,正交优化表如表2所示。根据正交实验结果可知,酶解时间产生的影响最大,酶解温度产生的影响最小,所以乳糖酶最优水解条件为A3B3C3,即乳糖酶的添加量0.8μL/g,酶解温度46℃,水解时间4.5h。由于得到的最优组合在正交设计中没有,故需要进行验证实验,验证实验的结果为98.59%,优于正交表中最高的第4组的值。将最优一组的低乳糖牛乳发酵,得出乳糖水解率为99.54%的低乳糖发酵乳。
2.4 低乳糖发酵乳的发酵特性
2.4.1 发酵过程中酸度的变化 为了解低乳糖发酵乳发酵过程中酸度的变化,将低乳糖发酵乳与普通发酵乳同时进行发酵,每隔1h测定1次酸度,酸度变化结果如图5所示[12]。从图5可以看出,在发酵的初期,发酵乳的酸度变化相对较小。在2~4h,发酵乳的酸度迅速增加,酸度随着发酵时间的延长而增加[13]。比较2种牛乳发酵的酸度,同一时间加酶的牛乳酸度比普通牛乳酸度大,这是因为乳糖酶将牛乳中的乳糖水解称为葡萄糖和半乳糖,发酵时乳酸菌可以直接利用这些糖进行发酵产酸,所以酸度变化较快[14]。
2.4.2 发酵过程中活菌总数的变化 为了研究低乳糖发酵乳发酵期间活菌总数的变化,将低乳糖乳与普通牛乳同时进行发酵,每2h取样1次以查看发酵过程中菌数的变化,结果如图6所示。由图6可知,普通牛乳经过发酵后菌数从0.07×109CFU/mL增长到0.93×109CFU/mL,菌数有了较大幅度的增长,加酶后牛乳发酵后菌数从0.07×109CFU/mL增长到1.54×109CFU/mL,可以看出,加酶后菌数约为普通牛乳的2倍,说明加酶有助于乳酸菌的生长。这是因为牛乳发酵时乳酸菌分解乳糖产生乳酸,牛乳的pH值下降,乳酸菌的生长受到了抑制,在有乳糖酶的参与后,由于酶的降解,乳糖被水解为葡萄糖和半乳糖,这种单糖可以直接被乳酸菌所利用。与此同时,乳糖酶使乳糖含量变小,反而没有产生乳酸,减弱了乳糖菌的抑制作用。
2.4.3 低乳糖发酵乳的流变特性 为了研究低乳糖发酵乳产品的感官指标,将其与普通发酵乳的表观黏度与触变性的进行了实验[15],结果如图7、8、9所示。从图7可以看出,4组样品的表观粘度都随着剪切时间的增加而减少,最后趋于平稳。这是由于剪切使得样品内部粒子所形成的结构遭到破坏,从而出现粘度随着剪切时间的延长而下降,即表现出切稀现象。样品的表观粘度在9.82~15.82Pa·s。與普通发酵乳相比较,低乳糖发酵乳表观黏度普遍升高,这可能是因为它发酵时乳清析出较少所致。
触变性流体的机理可以理解为随着剪切速率的增加,粒子间结合的结构受到破坏,粘度变小。从图8、图9看出,低乳糖发酵乳触变性的最大值为8.96Pa·s,而普通发酵乳触变性的最大值为7.66Pa·s。低乳糖发酵乳触变性相对较大,这可能是因为牛乳经过乳糖酶水解后,牛乳的黏度升高,导致低乳糖发酵乳更为粘稠。
3 结论
本实验使用商品级的乳糖酶,通过单因素实验确定乳糖酶的加酶量、酶解温度和时间,利用正交实验优化低乳糖发酵乳的酶解条件,并对优化后低乳糖发酵乳的发酵特性进行了研究,得出以下结论:
(1)采用单因素和正交实验对低乳糖发酵乳制备条件进行优化,以低乳糖牛乳中乳糖水解率作为评价指标,确定芒果发酵乳的制备条件为:添酶量0.8μL/g,酶解温度46℃,酶解时间4.5h,所得发酵乳中乳糖水解率为99.54%,优于普通发酵乳30%的水解率。
(2)对低乳糖发酵乳进行分析,发现本研究制备的低乳糖发酵乳口味适宜,口感醇厚。在发酵2~6h内,酸度由23.9°T增加到78.2°T,略高于普通发酵乳的75.1°T。活菌数在发酵期间呈现先上升后下降的趋势,活菌数在6h内最高达1.74×109CFU/mL,2h后降到1.54×109CFU/mL,均优于普通发酵乳的1.34×109CFU/mL和0.93×109CFU/mL。
参考文献
[1]Goh Lh ,Mohd Said R ,Goh K L .Lactase deficiency and lactose intolerance in a multiracial Asian population in Malaysia[J].JGH Open,2018.
[2]Vesa,Tuulah .Many factors affect symptoms of lactose intolerance[J].Food Reviews International,1999,15(2):235-247.
[3]聂玮,王红梅,张立平,等.乳糖吸收不良与肠易激综合征[J].医学综述,2014,20(12):2207-2209.
[4]侯安存.乳糖不耐受的诊治进展[J].临床和实验医学杂志,2017,16(02):204-207.
[5]赵晓慧,苏佳,史玉东,等.牛乳工业中乳糖酶的应用研究进展[J].食品科技,2016,41(04):228-231.
[6]食品安全国家标准.GB 19302-2010 发酵乳[S].
[7]王柳,吕嘉枥,王笋.柱前衍生-HPLC法分析酸奶中的还原糖[J].中国乳品工业,2014,42(01):55-58.
[8]国家卫生和计划生育委员会.GB 5009.239-2016 食品酸度的测定[S].2016.
[9]国家卫生和计划生育委员会.GB 4789.35-2016,食品微生物学检验 乳酸菌检验[S].2016.
[10]管声,梁琪,宋雪梅,等.牦牛乳乳糖酶解及其预热处理条件优化[J].食品与发酵工业,2017,43(01):118-123.
[11]王晓哲,钱方,曹迪,等.乳糖酶水解生产低乳糖牛乳工艺的优化[J].食品与机械,2013,29(02):183-185.
[12]李兴,牟德华,陈臣,等.低乳糖酸奶与普通酸奶的发酵特性研究[J].食品研究与开发,2013,34(10):57-59+0+5.
[13]王柳,吕嘉枥,王珊,等.分析不同菌群发酵酸乳糖和酸的变化[J].食品科技,2014,39(03):17-21+28.
[14]王柳.酸乳发酵过程中还原糖和有机酸含量的变化[D].西安:陕西科技大学,2014.
[15]C.Schmidt,S.Mende,D.Jaros,h.Rohm.Fermented milk products:effects of lactose hydrolysis and fermentation conditions on the rheological properties[J].Dairy Science &Technology,2016,96(2):199-211.
(责编:张宏民)
基金项目:国家自然科学基金——青年科学基金,31700079;枯草杆菌细胞密度依赖型自诱导表达系统转录调控的分子机制;江苏省自然科学基金——青年科学基金,BK20170496;基于细胞密度的枯草杆菌自诱导表达系统的表达调控机制及适用性研究。
作者简介:陶志强(1997—),男,江苏启东人,研究方向:发酵乳工艺。 *通讯作者 收稿日期:2019-03-20
