海藻酸钠小球制备及吸附性能测试综合实验设计
2019-06-18杨昌跃
何 超, 杨昌跃, 周 密
(1. 四川大学 高分子科学与工程学院, 四川 成都 610065; 2. 四川大学 轻纺与食品学院, 四川 成都 610065)
目前应用于污水处理的方法主要有离子交换、电化学反应、膜过滤以及吸附等。通过吸附剂进行吸附的方法,由于其成本低、无毒、简单易制备,以及容易操作等特性,被广泛应用于污水处理。天然高分子和合成高分子吸附材料(小球)由于具备大量的吸附位点而被用作吸附剂[1]。
海藻酸钠(sodium alginate,SA)作为一种天然高分子,由高分子多糖的聚合物组成,也称之为褐藻胶、褐藻酸钠以及海带胶。海藻酸钠主要取自天然褐藻,属于一种海藻的衍生物,具有药物制剂辅料所需的稳定性、溶解性、黏性、安全性以及生物相容性,且储量丰富、可再生,因此被广泛应用于医药、食品、纺织、环保等行业。由于海藻酸钠来源广泛、生物可降解、亲水性强、已实现商品化供应且价格较低,因而被广泛用作污水处理的吸附材料[2]。吸附小球是吸附材料的最常见形态。
将天然高分子小球用来清除环境毒素方面的实验教学素材鲜有报道。如何综合考虑、设计小球的制备及性能测试实验,既要激发学生的实验热情,又要保证实验安全和可操作性,都是需要考虑的因素。实验教学可以培养学生的实践能力、创新思维,而综合性实验教学是构建和完善多层次实验教学体系的有效途径[3]。
本实验设计旨在通过生动形象的方式,首先指导学生制备海藻酸钠小球,然后将所制备的小球用于吸附环境毒素,并通过解吸附过程实现吸附材料的回收和再利用。学生通过自己实际动手,参与到整个实验过程。本实验设计的项目实验现象直观、明显、有趣、安全。通过本实验的开设,可以提升学生对高分子材料的认识与兴趣;同时认识到环境污染的严重性,树立正确的环保意识,并行动起来参与到环境治理中来;使学生初步具备操作简单实验仪器的能力,进而培养其动手能力和学习热情。
1 实验原理
1.1 羟醛交联反应制备海藻酸钠小球
海藻酸钠是最为常用的海藻酸盐,无毒,无味,属于一种天然多糖,其分子由β-D-甘露糖醛酸(β-D-mannuronic,M)和α-L-古洛糖醛酸(α-L-guluronic,G)按(1→4)键连接而成[4-5]。海藻酸钠会与水相溶,但是在氯仿、乙醇等有机溶剂之中不会溶解。海藻酸钠溶于水后形成黏稠状液体,将其滴入丙酮中,通过液-液相分离法可制备海藻酸钠小球。由于海藻酸钠不溶于丙酮,通过液-液相分离法可获得球形海藻酸钠液滴。但是海藻酸钠作为线性高分子,若不对其进行进一步的交联等反应形成网状结构,所制备的海藻酸钠小球会在使用过程中溶解掉。
利用海藻酸钠分子中大量存在的羟基可以和戊二醛结合的特点,在酸的催化作用下,通过羟醛交联反应实现海藻酸钠小球的交联而不溶于水中[6-7],其化学反应示意图见图1。本反应条件温和,涉及试剂少,反应时间短,反应稳定且可重复性强。海藻酸钠小球的交联成形反应是一个理想的反应,学生上手容易且安全,适合对其开设并进行教学。

图1 海藻酸钠小球的交联原理示意图
1.2 吸附及解吸附机理
本实验中所制备的海藻酸钠小球中含有大量的羧基,其带负电荷;而被吸附的染料为亚甲基蓝,是一种常见阳离子染料。故两者可以通过静电相互作用(属于物理吸附)结合到一起[8]。所制备的海藻酸钠小球中含有大量吸附亚甲基蓝阳离子染料的吸附位点,可作为吸附剂材料使用。由于通过静电相互作用的吸附实验比较高效、快速,并且现象明显,具有趣味性,故适合针对本学科学生开放。
本实验中通过加入盐酸来解吸附海藻酸钠小球所吸附的物质。由于盐酸可以和海藻酸钠小球中的羧基产生质子化相互作用,形成羧酸。质子化的羧酸中不含电离的负电荷,从而失去静电相互作用,阳离子染料便会从海藻酸钠小球上解吸附出来[9]。此解吸附过程快速、直观。
本实验所涉及的整个实验流程操作简单、现象明显且有趣、原材料常见易得、实验所需时长合理、实验过程安全无风险,故拟开设实验具备可行性。
2 实验过程设计
2.1 实验材料与仪器
实验材料:采用上海阿拉丁生化科技股份有限公司的海藻酸钠作为原材料,黏度为600±20 mPa·s;超纯水(UP水)通过制水机制备后直接使用;丙酮(非良溶剂)、戊二醛(交联剂)、冰乙酸和盐酸(催化剂)均由成都科隆化工有限公司提供;阳离子染料亚甲基蓝购买于成都点纯科技有限公司。
仪器:根据海藻酸钠的成球原理,滴球设备的布局设计如图2中所示,其主要包含空压机、储气罐、仪器架、储料罐、喷头、磁力搅拌器、转子和烧杯。除此之外,还需要恒温水浴槽、摇床、镊子、漏勺等。海藻酸钠小球的表征采用红外光谱仪(FTIR,Nicolet 560,美国)和热重分析仪(TGA,TG209F1,德国)[10]。

图2 滴球设备的工作原理图
2.2 海藻酸钠小球的制备及表征
(1) 配制一定浓度的海藻酸钠溶液(质量分数为1%~4%,溶于水中)。称取一定质量的海藻酸钠粉末并加入已干燥好的洁净烧杯中,根据需要加入适量超纯水,放入磁力搅拌子后将烧杯放于磁力搅拌台上进行搅拌,直至得到溶解充分的海藻酸钠溶液。
(2) 将配制好的海藻酸钠溶液倒入滴球设备的缓冲罐中,接通电源和控制阀门,通过滴球设备将配制的溶液滴于凝固浴中。凝固浴包含丙酮(200 mL)、戊二醛(50 mL)和乙酸/盐酸(50 mL/10mL),其配比可调。丙酮是不良溶剂,戊二醛和乙酸/盐酸分别作为交联剂和催化剂使用。
(3) 调节控制滴球过程中滴速60~120滴/min,喷头离凝固浴液面为5~25 cm,压力为0.04~0.3 MPa,可制备不同尺寸规格的海藻酸钠小球。
(4) 将所制备的小球放置于温度在50 ℃下的恒温水浴槽中,反应24 h完成交联反应。
(5) 交联反应结束后,用超纯水多次洗涤所制备的海藻酸钠小球,充分除去残留的戊二醛、乙酸、盐酸和丙酮等试剂。
(6) 海藻酸钠小球的表征通过红外光谱和热重曲线进行。先将海藻酸钠小球放在60 ℃烘箱中烘干,之后用KBr研磨,并压片后做红外测试。将干燥样品放置于热重分析仪中,在氮气的保护下,以10 ℃/min的升温速率升温至800 ℃,得到热重曲线。
2.3 海藻酸钠小球的性能测试
(1) 吸附实验。选取上述所制备的海藻酸钠小球(3~5颗),并放置于小玻璃瓶中,加入一定体积(2 mL)和一定浓度(1 000 μmol/L)的亚甲基蓝水溶液,恒温振荡,在设定的时间内通过紫外分光光度计(UV-1750,Shimadzu)在631nm波长下测试其吸光度[11]。同时根据已知梯度浓度的亚甲基蓝水溶液作出浓度与吸光度的标准曲线;然后根据标准曲线算出海藻酸钠小球对亚甲基蓝水溶液吸附后的浓度变化,进而计算出海藻酸钠小球对亚甲基蓝的吸附性能。
(2) 解吸附实验。将一定量吸附阳离子染料亚甲基蓝的海藻酸钠小球浸泡于一定体积和浓度的盐酸溶液中,用摇床轻轻晃动小球[12]。一段时间后测量盐酸中亚甲基蓝的浓度,直至解吸附达到平衡,盐酸中亚甲基蓝的浓度不再升高。计算解吸附效率(Rd)如下 :
其中,na是海藻酸钠小球吸附的亚甲基蓝量,而nd是解吸附到盐酸中的亚甲基蓝量。
3 结果与讨论
3.1 海藻酸钠交联小球的红外光谱和热重曲线
将本实验得到的海藻酸钠小球浸泡于超纯水中,小球并未溶解消失,说明所制备的海藻酸钠小球具备交联结构,可以在水中溶胀而不能溶解。红外光谱FTIR(图3(a))显示:3 411 cm-1处的吸收峰是由于海藻酸钠中羟基的伸缩振动引起的;1 629/1 623 cm-1处的特征吸收峰归属于海藻酸钠中的羰基基团;1 035 cm-1处的特征吸收峰是海藻酸钠中的醚键引起的;海藻酸钠小球与海藻酸钠粉末相比,多出了1 722 cm-1处的特征峰,这归因于戊二醛交联后出现在海藻酸钠小球侧链上的醛基。
海藻酸钠小球的热重曲线如图3(b)和(c)中所示,FGA为热重曲线,DTG为微商热重曲线。从图中可以看出,海藻酸钠粉末在170 ℃以前出现了质量损失(约为13%),这主要是由于海藻酸钠中的物理吸附水和其他小分子引起的[13-14]。相比较而言,海藻酸钠小球在此阶段表现出较好的热稳定性,这主要是由于在交联反应过程中消耗掉了部分亲水性基团(OH),从而降低了吸附水的存在,即在170 ℃以下所制备的海藻酸钠小球是热稳定的,而其常规使用温度均低于此值,所以制备的海藻酸钠小球能满足使用过程中的热稳定性要求。在高温部分,海藻酸钠小球的热分解速率曲线中出现了2个降解峰,对应的降解温度分别是191 ℃和238 ℃,这2个降解温度分别归属于交联海藻酸钠小球中的戊二醛和海藻酸钠的降解温度。实验结果表明戊二醛被成功地引入了海藻酸钠小球中,证明了交联海藻酸钠小球制备成功。

图3 FTIR光谱(A)、TGA(B)和DTG(C)曲线
3.2 吸附性能
海藻酸钠(含阴离子)可通过离子间作用力吸附阳离子[15-16]。在本研究中,海藻酸钠小球是通过其羟基与戊二醛发生交联反应后制备的,故海藻酸钠小球中存在大量的阴离子基团(羧基)。将海藻酸钠小球置于阳离子染料(亚甲基蓝)溶液中,羧基与亚甲基蓝进行结合,不同的亚甲基蓝溶液浓度下,海藻酸钠小球对其吸附量如图4所示。
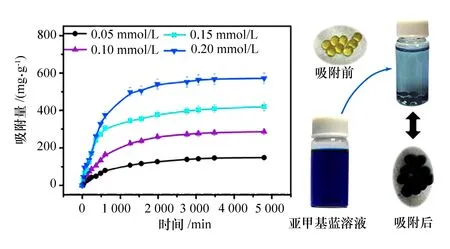
图4 海藻酸钠小球对不同浓度亚甲基蓝溶液的吸附曲线以及吸附前后现象对比
海藻酸钠小球对不同浓度的亚甲基蓝溶液均有较强的吸附,随着亚甲基蓝浓度的升高,吸附量增加。在吸附初期,吸附速度较快,30 h时吸附基本达到了动态平衡;在随后的吸附过程中,所吸附的亚甲基蓝较少且缓慢。这是由于溶液浓度越高,海藻酸钠小球表面上的羧基负电荷与溶液中的亚甲基蓝正电荷的电位差越大,在一定时间内吸附量就较高;在快速吸附一定时间后,由于达到电位平衡和吸附饱和,以及海藻酸钠上羧基的空间效应的共同作用,使得海藻酸钠小球对亚甲基蓝的吸附达到基本饱和状态;随着吸附时间变长,海藻酸钠小球对亚甲基蓝仍然存在较缓慢的吸附,这是由于电位差的原因,亚甲基蓝会向小球内部缓慢扩散,使得吸附进一步缓慢的进行。从吸附前后的现象变化也可以直观地看出,加入吸附剂海藻酸钠小球后,亚甲基蓝溶液颜色从深蓝色变成了浅蓝色,而吸附小球的颜色则从淡黄色变成了深蓝色(由于吸附了亚甲基蓝引起的)。实验现象也充分说明了海藻酸钠小球对亚甲基蓝具有明显的吸附效果。
3.3 解吸附性能
将吸附了亚甲基蓝的海藻酸钠小球浸没在盐酸溶液中,可以观察到蓝色染料从小球中解吸附出来,溶液颜色在几分钟内就逐渐变成了蓝色。一段时间后捞出小球,发现其颜色变淡,并趋向于恢复到吸附前的颜色(淡黄色)。海藻酸钠小球的解吸附曲线如图5中所示,从图中可以看出其解吸附效率随着时间的延长而逐渐增加。在不到1 h的时间内,其解吸附效率能达到95%以上,表明海藻酸钠小球在吸附环境毒素方面可以重新生成和再利用。
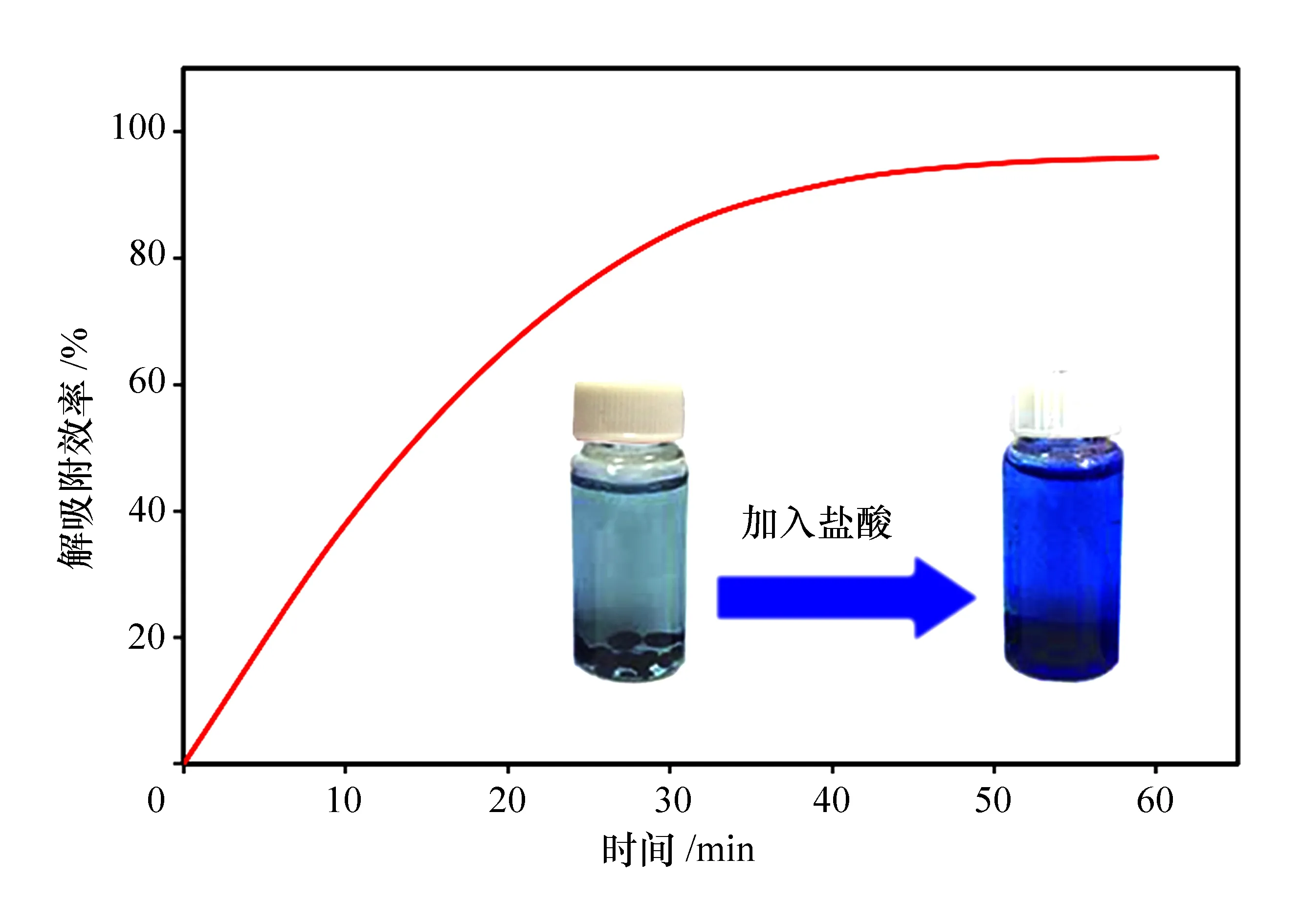
图5 吸附后小球的解吸附曲线及现象变化
4 实验教学效果
海藻酸钠小球制备及吸附性能测试是一个综合型的设计实验。本实验以直观、生动和形象的方式引导学生制备海藻酸钠小球,然后将制备的小球用于吸附环境毒素,并通过解吸附过程实现吸附材料的回收再利用。将材料的制备、表征和性能测试结合在一起,具有一定的前沿性、新颖性、综合性和易操作等特点。这不仅可充分锻炼学生的动手操作能力和分析思考能力,让学生树立正确的环保意识。这种实验教学模式,现象明显、有趣,能激发学生的兴趣以及动手热情,从而达到培养学生逻辑思考和动手的能力,提升了实验教学成效。
5 结语
本实验使学生直观感受到高分子材料从原材料成为可应用产品的变化过程,认知到高分子产品的一种加工过程。海藻酸钠小球的制备过程简单、高效,其对亚甲基蓝的吸附效果明显直观,而解吸附现象快速有趣。本实验稳定可控,具备较强的可重复性,且实验过程安全可靠,实验时长合理,适合对学生开放。将此方法引入实验教学中,激发学生的兴趣及实验热情,培养学生的动手能力以及综合分析能力。
