Nrf2/HO-1信号通路在6-羟基多巴胺帕金森病模型大鼠神经损伤中的作用
2019-06-18王昆罗小娜李时光冯丽君刘新生
王昆,罗小娜,李时光,冯丽君,刘新生
帕金森病(Parkinson's disease,PD)为老年人常见的神经退行性病变,调查显示其发病率高于阿尔茨海默病,且发病率逐年升高,85 岁以上的老年人中发病率达 5%,对患者认知、神经、行动等机能产生严重的影响,给家庭、社会带来巨大的精神负担[1]。目前 PD 病因尚不明确,因此探究其发病机制,寻找该病的治疗靶点对于提高患者预后具有积极的意义。氧化应激损伤导致多巴胺水平降低是 PD 发病的重要原因[2],核因子 E2 相关因子 2(nuclear factor E2-related factor2,Nrf2)/血红素加氧酶-1(heme oxygenase-1,HO-1)信号通路是重要的抗氧化信号通路,多数体外研究显示激活 Nrf2/HO-1 通路后能够缓解 PD 模型细胞氧化应急损伤,降低小胶质细胞活化程度,缓解神经损 伤[3-4],但与黑质区神经元损伤的关系目前尚不明确。本研究通过制备 PD 大鼠、PD 模型细胞,给予 Nrf2/HO-1 通路抑制剂及激活剂处理,探究 Nrf2/HO-1 通路在 PD 发生发展中的作用,以期为 PD 的治疗提供新的参考。
1 材料与方法
1.1 材料
1.1.1 实验动物及细胞 无特定病原体(specific pathogen free,SPF)级 SD 大鼠,体质量 200~240 g,8 周龄,由河南省动物实验中心提供,许可证号:SYXK(豫)2017-0002。大鼠均置于 23~25 ℃、湿度 50%~60%,昼夜交替 12 h(光照 12 h,黑夜 12 h)的环境中统一喂养,正常喂养 1 周后进行模型制备。
人神经母细胞瘤细胞 SH-SY5Y 购自中国科学院上海细胞研究所,置于 10% 胎牛血清(fetal bovine serum,FBS)的 DMEM 培养基,放置在 5% CO2培养箱内 37 ℃ 培养。
1.1.2 试剂与仪器 6- 羟基多巴胺(6-hydroxydopamine,6-OHDA)、阿普吗啡、FBS、DMEM 培养基购自美国 Sigma 公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxidedismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)检测试剂盒购自北京中杉金桥生物技术有限公司;BCA 蛋白测定试剂盒、HE 染色试剂盒购自碧云天生物技术研究所;RIPA 蛋白裂解液购自美国 Invitrogen 公司;兔抗鼠酪氨酸羟化酶(tyrosine hydroxylase,TH)、Nrf2、HO-1 购自美国 CST 公司;B 细胞淋巴瘤 2(Bcl2)、Bcl2 相关 X 蛋白(Bcl2 associated X protein,Bax)、HRP 标记羊抗鼠免疫球蛋白 G(IgG)单克隆抗体购自美国 R & D 公司;电泳仪、电泳槽、凝胶成像仪为美国 Bio-Rad 公司产品;光学显微镜、透射电镜为日本 Olmpus 公司产品。
1.2 方法
1.2.1 帕金森病大鼠模型制备 大鼠腹腔注射 400 mg/kg 10% 水合氯醛麻醉后,仰卧固定于大鼠脑立体定位仪,依据文献[5]中的大鼠脑立体定位图谱,确定脑部黑质坐标点,右侧黑质致密部:硬膜下方 7.5 mm,矢状线右 1.5 mm,前卤后方 5 mm;前脑内侧束:硬膜下方 7.7 mm,矢状线右 2.3 mm,前卤后方 1.4 mm。于各坐标点用注射器注射 4 g/L 的 6-OHDA(含 0.02% 抗坏血酸生理盐水),注射速率控制在 1 μl/min,注射体积 1.0 μl,结束后留针 5 min,缓慢退针缝合伤口。假手术组(control)大鼠,选取相同坐标点,注射等体积含 0.02% 抗坏血酸生理盐水,操作方法同模型制备。术后 2 周,腹腔注射阿普吗啡(0.5 mg/ml),10 min 后观察大鼠在 30 min 内旋转圈数即逆时针方向 旋转圈数与顺时针方向旋转圈数,旋转圈数超过 100 圈,则视为模型制备成功[6],排除死亡、感染大鼠,模型制备成功大鼠共 36 只,control 组大鼠 12 只。
1.2.2 帕金森病细胞模型制备 参考文献[7]制备帕金森病细胞模型,取对数期 SH-SY5Y 细胞,消化后密度调整为 5 × 106个/ml,接种 100 μl 于 96 孔细胞培养板,培养 24 h 后,添加 50 μmol/L 6-OHDA 干预细胞 24 h 制备 PD 细胞模型。
1.2.3 动物及细胞分组 将大鼠分为 control 组、PD 组、Nrf2 激活剂(Hesperin)组、Nrf2 抑制剂(Brusatol)组,每组 12 只。Hesperin 组:PD 模型制备后,于腹腔注射 10 mg/kg Hesperin,每天 1 次,连续一周;Brusatol 组:PD 模型制备后,于腹腔注射 2 mg/kg Brusatol,每天 1 次,连续 一周;control 组、PD 组均连续一周注射等量生理盐水。
将细胞分为 control 组、PD 组、Nrf2 激活剂(Hesperin)组、Nrf2 抑制剂(Brusatol)组。Control 组细胞不进行任何处理,Hesperin 组:6-OHDA 干预细胞 24 h 后添加 0.5 μg/ml Hesperin;Brusatol:6-OHDA 干预细胞 24 h 后添加 0.2 μg/ml Brusatol。
1.2.4 观察指标与检测方法
1.2.4.1 大鼠行为学评估 末次处理后,进行 APO 转诱导实验,统计 30 min 内大鼠旋转圈数,计算平均旋转圈数。将大鼠置于转棒上,启动转棒计时,逐渐加大转速,统计观察大鼠从转棒上掉落的时间。末次处理后,统计 30 min 内各组 PD 大鼠对侧旋转圈数,并评估异常不自主评分(AIM)[8]。1.2.4.2 标本采集 各组大鼠麻醉后断头取脑,分离脑黑质部位,将一部分组织置于 4% 聚甲醛溶液中固定以制备组织石蜡切片,一部分组织冻存于 -80 ℃。
1.2.4.3 免疫组化检测脑组织黑质中 TH 阳性表达情况 常规制备脑组织黑质部石蜡切片,添加 3% H2O2溶液解除内源性过氧化物酶活,清洗后 添加柠檬酸钠行抗原修复,封闭后添加 TH 一抗 4 ℃ 中孵育过夜,清洗后添加二抗,PBS 清洗后进行 DAB 显色,清洗后行苏木素复染,脱水、透明处理后滴加中性树脂封片,置于显微镜下观察脑组织黑质中 TH 阳性表达情况,计算阳性染色细胞率(%)= TH 阳性/细胞总数 × 100%。
1.2.4.4 SOD、MDA、GSH-Px、CAT 活性检 测 取出保存脑组织黑质部位添加生理盐水后置于电动匀浆机制备组织匀浆,离心后保留上清,参照试剂盒说明书进行操作,采用氮蓝四唑光还原法检测 SOD 水平,硫代巴比妥酸法检测 MDA 水平,比色法检测 GSH-Px 水平,采用双抗体夹心法检测 CAT 水平。
1.2.4.5 透射电子显微镜观察神经元超微结 构 取出保存脑组织黑质部位,添加 2.5% 戊二醛,置于 4 ℃ 固定 3 h,添加 1% 锇酸溶液中 4 ℃ 固定 2 h。经梯度乙醇脱水后,采用环氧树脂包埋,用超薄切片机切割为 50 nm 超薄切片,经醋酸铀、柠檬酸铅染色后,置于透射电子显微镜观察神经元超微结构变化。
1.2.4.6 Western blot 检测组织中 Nrf2、HO-1、Bcl2、caspase3、Bax 蛋白表达 取出保存组织,加入细胞裂解液,冰上匀浆后,12 000 ×g离心后收集上清,抽提蛋白,BCA 法测定蛋白浓度后,行 SDS-PAGE 电泳,转膜后添加 5% 脱脂牛奶封闭,添加 Nrf2、HO-1、Bcl2、caspase3、Bax 一抗,4 ℃ 孵育过夜后,添加二抗室温下孵育 1 h,ECL 发光显影后,置于蛋白凝胶仪中观察蛋白表达,以 β-actin 作为内参,ImageJ 软件定量各蛋白表达。
1.2.4.7 MTT 法检测 SH-SY5Y 细胞增殖情况 各组细胞处理后继续培养 24、48、36、72 h,添加 MTT 溶液,避光孵育 4 h,添加 DMSO 溶液,振荡培养 15 min,在酶标仪上 490 nm 波长下测定各组吸光值(OD)。细胞增殖抑制率(%)=(OD实验组-ODcontrol组)/ODcontrol组× 100%。
1.2.4.8 流式细胞术检测 SH-SY5Y 细胞凋亡情况 收集各组细胞,添加 PBS 洗涤细胞消化液后制备单细胞悬液,添加 5 μl Annexin V-FITC 染液避光孵育 20 min,加入 5 μl PI 混匀后冰上避光孵 育 10 min,置于流式细胞仪中检测细胞凋亡情况。1.2.4.9 SH-SY5Y 细胞中 Nrf2、HO-1、Bcl2、caspase3、Bax 蛋白表达 细胞各组处理后,继续培养 24 h,收集细胞后,添加裂解液后抽提细胞总蛋白,后续操作同方法 1.2.4.6。
1.3 统计学处理
采用统计学软件 SPSS 22.0 进行数据分析。计量资料以±s描述,两组间比较行t检验,多组间比较行单因素方差分析,进一步两两比较采用 snk-q 检验,当P< 0.05 时,则差异具有统计学意义。
2 结果
2.1 各组大鼠神经行为学评估结果比较
与 control 组相比,PD 组 APO 诱导圈数、AIM 评分均升高,转棒滞留时间缩短,差异具有显著性(P< 0.05);与 PD 组相比,Hesperin 组 APO 诱导圈数、AIM 评分均降低,转棒滞留时间增长,Brusatol 组 APO 诱导圈数升高,转棒滞留时间缩短,差异均具有显著性(P< 0.05)(表1)。
2.2 各组脑组织黑质区神经元数量比较
与 control 组相比,PD 组脑组织黑质区 TH 神经元比例降低,差异具有显著性(P< 0.05);与 PD 组相比,Hesperin 组脑组织黑质区 TH 神经元比例升高,Brusatol 组脑组织黑质区 TH 神经元比例降低,差异均具有显著性(P< 0.05)(图1和 表2)。
表1 各组大鼠 APO 诱导圈数、转棒滞留时间比较(±s) Table 1 Comparison of APO induction circles and rotation time of rod in each group (± s)

表1 各组大鼠 APO 诱导圈数、转棒滞留时间比较(±s) Table 1 Comparison of APO induction circles and rotation time of rod in each group (± s)
注:与 control 组相比,*P < 0.05;与 PD 组相比,#P < 0.05。Notes:*P < 0.05 compared with control group; #P < 0.05 compared with PD group.
组别 Groups APO 诱导圈数(圈/30 min) Number of APO induction cycles (cycles/30 min) 转棒滞留时间(s) Retention time of rotating rod (s) AIM 评分 AIM Score Control 组 Control group 1.24 ± 0.15 67.38 ± 8.29 19.12 ± 4.46 PD 组 PD group 80.73 ± 6.59* 41.52 ± 7.18* 30.24 ± 5.21* Hesperin 组 Hesperin group 47.44 ± 4.59*# 54.16 ± 6.75*# 26.47 ± 1.20*# Brusatol 组 Brusatol group 96.17 ± 7.04*# 33.24 ± 3.16*# 46.52 ± 3.06*#

图1 免疫组化检测各组神经元数量变化情况(40 ×) Figure 1 Changes in the number of neurons in each group detected by immunohistochemistry (40 ×)
表2 各组大鼠脑组织黑质区神经元数量比较(± s) Table 2 Comparison of the number of neurons in the substantia nigra of brain tissue of each group (± s)

表2 各组大鼠脑组织黑质区神经元数量比较(± s) Table 2 Comparison of the number of neurons in the substantia nigra of brain tissue of each group (± s)
注:与 control 组相比,*P < 0.05;与 PD 组相比,#P < 0.05。Notes:*P < 0.05 compared with control group; #P < 0.05 compared with PD group.
组别 Groups TH 标记神经元比例(%) TH labeled neurons (%) Control 组 Control group 44.64 ± 0.29 PD 组 PD group 22.34 ± 2.35* Hesperin 组 Hesperin group 36.73 ± 2.32*# Brusatol 组 Brusatol group 15.35 ± 1.48*#
2.3 各组脑组织黑质区神经元超微结构变化情况
Control 组神经元细胞结构清晰,细胞核形态结构正常;PD 组细胞核皱缩,核内异染色质变多呈小块状分布;Hesperin 组细胞核皱缩以及染色质聚集情况有所改善;Brusatol 组细胞核严重皱缩、呈凋亡样(图2)。
2.4 脑组织黑质区 SOD、MDA、GSH-Px、CAT 水平 比较
与 control 组相比,PD 组 SOD、GSH-Px、CAT 水平降低,MDA 水平升高,差异具有显著性(P< 0.05);与 PD 组相比,Hesperin 组 SOD、GSH-Px、CAT 水平升高,MDA 水平降低,Brusatol 组 SOD、GSH-Px、CAT 水平降低,MDA 水平升高,差异均具有显著性(P< 0.05)(表3)。
2.5 各组黑质区组织中 Nrf2、HO-1、Bcl2、caspase3、Bax 蛋白表达情况
与 control 组相比,PD 组 Nrf2、HO-1、Bcl2 蛋白表达降低,caspase3、Bax 蛋白表达升高,差异具有显著性(P< 0.05);与 PD 组相比,Hesperin 组 Nrf2、HO-1、Bcl2 蛋白表达升高,caspase3、Bax 蛋白表达降低,Brusatol 组 Nrf2、HO-1、Bcl2 蛋白表达降低,caspase3、Bax 蛋白表达升高,差异均具有显著性(P< 0.05)(表4)。

图2 扫描电镜观察黑质区细胞核超微结构(10 000 ×) Figure 2 The ultrastructure of cell nuclei in the substantia nigra by scanning electron microscope (10 000 ×)
表3 各组大鼠 SOD、MDA、GSH-Px、CAT 水平比较(± s) Table 3 Comparison of SOD,MDA,GSH-Px and CAT levels in the rats of each group (± s)
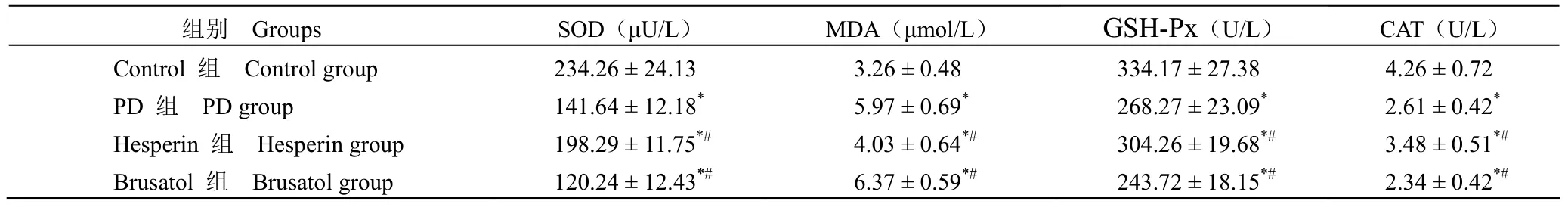
表3 各组大鼠 SOD、MDA、GSH-Px、CAT 水平比较(± s) Table 3 Comparison of SOD,MDA,GSH-Px and CAT levels in the rats of each group (± s)
注:与 control 组相比,*P < 0.05;与 PD 组相比,#P < 0.05。Notes:*P < 0.05 compared with control group; #P < 0.05 compared with PD group.
组别 Groups SOD(μU/L) MDA(μmol/L) GSH-Px(U/L) CAT(U/L) Control 组 Control group 234.26 ± 24.13 3.26 ± 0.48 334.17 ± 27.38 4.26 ± 0.72 PD 组 PD group 141.64 ± 12.18* 5.97 ± 0.69* 268.27 ± 23.09* 2.61 ± 0.42* Hesperin 组 Hesperin group 198.29 ± 11.75*# 4.03 ± 0.64*# 304.26 ± 19.68*# 3.48 ± 0.51*# Brusatol 组 Brusatol group 120.24 ± 12.43*# 6.37 ± 0.59*# 243.72 ± 18.15*# 2.34 ± 0.42*#
表4 各组黑质区组织中 Nrf2、HO-1、Bcl2、caspase3、Bax 蛋白表达比较(± s) Table 4 Comparison of Nrf2,HO-1,Bcl2,caspase3 and Bax protein expression in the substantia nigra (± s)

表4 各组黑质区组织中 Nrf2、HO-1、Bcl2、caspase3、Bax 蛋白表达比较(± s) Table 4 Comparison of Nrf2,HO-1,Bcl2,caspase3 and Bax protein expression in the substantia nigra (± s)
注:与 control 组相比,*P < 0.05;与 PD 组相比,#P < 0.05。Notes:*P < 0.05 compared with control group; #P < 0.05 compared with PD group.
组别 Groups Nrf2 HO-1 Bcl2 caspase3 Bax Control 组 Control group 1.25 ± 0.29 1.05 ± 0.23 0.89 ± 0.05 0.18 ± 0.02 0.19 ± 0.03 PD 组 PD group 0.45 ± 0.03* 0.51 ± 0.08* 0.62 ± 0.06* 0.74 ± 0.06* 0.83 ± 0.08* Hesperin 组 Hesperin group 0.81 ± 0.04*# 0.96 ± 0.04*# 0.79 ± 0.05*# 0.42 ± 0.08*# 0.46 ± 0.05*# Brusatol 组 Brusatol group 0.17 ± 0.04*# 0.30 ± 0.06*# 0.40 ± 0.08*# 0.97 ± 0.09*# 0.92 ± 0.07*#
表5 各组细胞增殖抑制率比较(%,± s) Table 5 Comparison of cell proliferation inhibition rates of each group(%,± s)

表5 各组细胞增殖抑制率比较(%,± s) Table 5 Comparison of cell proliferation inhibition rates of each group(%,± s)
注:与 control 组相比,*P < 0.05;与 PD 组相比,#P < 0.05。Notes:*P < 0.05 compared with control group; #P < 0.05 compared with PD group.
组别 Groups 24 h 36 h 48 h 72 h Control 组 Control group 0.04 ± 0.01 0.05 ± 0.01 0.05 ± 0.01 0.07 ± 0.02 PD 组 PD group 10.34 ± 1.27* 16.28 ± 1.13* 22.58 ± 3.17* 27.16 ± 4.27* Hesperin 组 Hesperin group 6.07 ± 0.38*# 10.08 ± 1.46*# 12.16 ± 1.34*# 18.57 ± 2.18*# Brusatol 组 Brusatol group 14.68 ± 1.53*# 22.47 ± 2.18*# 27.17 ± 2.36*# 32.45 ± 3.66*#
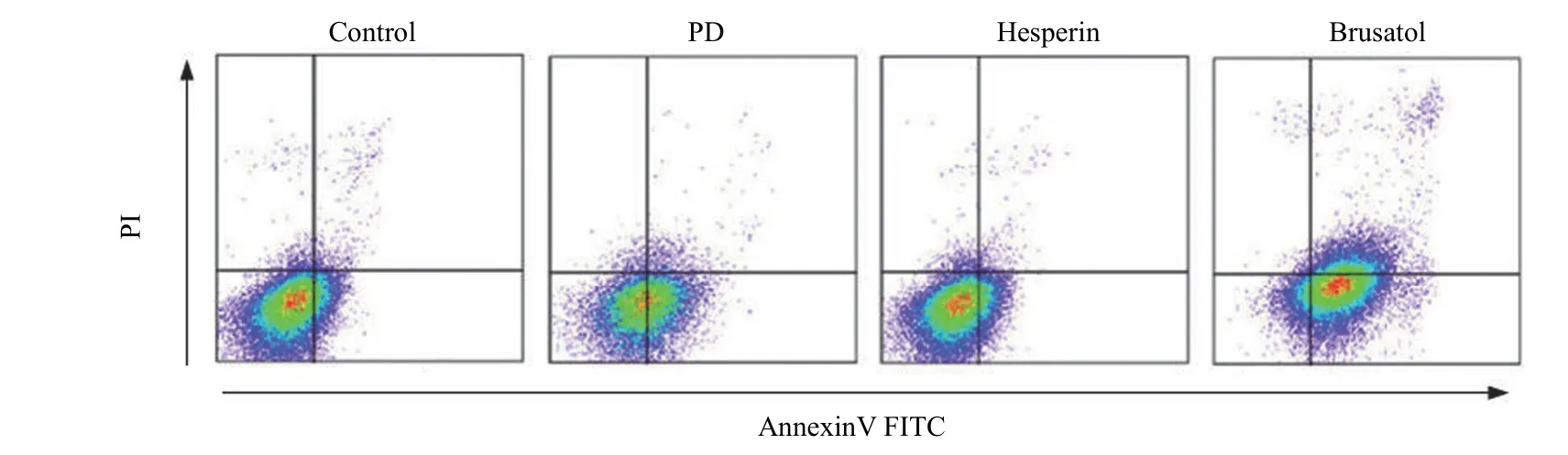
图3 流式细胞术检测细胞凋亡情况 Figure 3 Cell apoptosis analysis by flow cytometry
2.6 各组细胞增殖抑制率比较
与 control 组相比,PD 组细胞增殖抑制率升高,差异具有显著性(P< 0.05);与PD 组相比,Hesperin 组细胞增殖抑制率降低,Brusatol 组细胞增殖抑制率升高,差异均具有显著性(P< 0.05) (表5)。
2.7 各组细胞凋亡情况比较
与 control 组相比,PD 组细胞凋亡率升高,差异具有显著性(P< 0.05);与 PD 组相比,Hesperin 组细胞凋亡率降低,Brusatol 组细胞凋亡率升高,差异均具有显著性(P< 0.05)(图3和 表6)。
2.8 各组细胞中 Nrf2、HO-1、Bcl2、caspase3、Bax 蛋白表达情况
与 control 组相比,PD 组细胞 Nrf2、HO-1、Bcl2 蛋白表达降低,caspase3、Bax 蛋白表达升高,差异具有显著性(P< 0.05);与 PD 组相比,Hesperin 组细胞中 Nrf2、HO-1、Bcl2 蛋白表达升高,caspase3、Bax 蛋白表达降低,Brusatol 组细胞中 Nrf2、HO-1、Bcl2 蛋白表达降低,caspase3、Bax 蛋白表达升高,差异均具有显著性(P< 0.05)(表7)。
表6 各组细胞凋亡率比较(± s) Table 6 Comparison of apoptosis rates of each group (± s)

表6 各组细胞凋亡率比较(± s) Table 6 Comparison of apoptosis rates of each group (± s)
注:与 control 组相比,*P < 0.05;与 PD 组相比,#P < 0.05。Notes:*P < 0.05 compared with control group; #P < 0.05 compared with PD group.
组别 Groups 凋亡率(%) Apoptosis rates (%)Control 组 Control group 11.18 ± 1.46 PD 组 PD group 35.26 ± 3.37* Hesperin 组 Hesperin group 19.44 ± 2.69*# Brusatol 组 Brusatol group 44.29 ± 1.46*#
表7 各组细胞中 Nrf2、HO-1、Bcl2、caspase3、Bax 蛋白表达比较(± s) Table 7 Comparison of intracellular Nrf2,HO-1,Bcl2,caspase3 and Bax protein expression in each group (± s)

表7 各组细胞中 Nrf2、HO-1、Bcl2、caspase3、Bax 蛋白表达比较(± s) Table 7 Comparison of intracellular Nrf2,HO-1,Bcl2,caspase3 and Bax protein expression in each group (± s)
注:与 control 组相比,*P < 0.05;与 PD 组相比,#P < 0.05。Notes:*P < 0.05 compared with control group; #P < 0.05 compared with PD group.
组别 Groups Nrf2 HO-1 Bcl2 caspase3 Bax Control 组 Control group 1.08 ± 0.27 1.12 ± 0.16 0.97 ± 0.14 0.18 ± 5.29 0.23 ± 0.04 PD 组 PD group 0.52 ± 0.08* 0.76 ± 0.09* 0.43 ± 0.09* 0.84 ± 0.13* 0.89 ± 0.14* Hesperin 组 Hesperin group 0.76 ± 0.07*# 0.93 ± 0.17*# 0.58 ± 0.07*# 0.56 ± 0.08*# 0.43 ± 0.08*# Brusatol 组 Brusatol group 0.34 ± 0.06*# 0.52 ± 0.07*# 0.22 ± 0.04*# 1.07 ± 0.34*# 1.05 ± 0.25*#
3 讨论
PD 病理特征主要为脑黑质部多巴胺神经元变性、坏死、丢失,导致脑部纹状体多巴胺减少,进而导致神经损伤[9]。6-OHDA 为 PD 动物模型与细胞模型常用诱导剂,6-OHDA 注射脑部纹状体能够损伤脑黑质部神经元,可模拟 PD 早期临床表现。本研究通过制备 PD 大鼠及细胞模型,发现 PD 模型大鼠 APO 诱导圈数、AIM 评分均升高,转棒滞留时间缩短,脑组织黑质区 TH 神经元比例降低,电镜检测发现细胞核皱缩,细胞呈凋亡状,同样 PD 模型细胞增殖活性明显降低,与过往 PD 大鼠(细胞)模型研究结果相似[10],提示 6-OHDA 诱导 PD 大鼠(细胞)模型成功。
氧化应激反应为 PD 发病中重要的病理机制,研究显示在神经元丢失的早期氧化应激水平升 高[11]。Arenas[12]研究发现,PD 大鼠中降低氧化应激水平可以降低胶质细胞活化程度,缓解神经损伤。研究证实 PD 大鼠脑组织处于氧化应激状态,其中 SOD、GSH-Px、CAT 等抗氧化因子功能异常,造成氧化应激反应升高,氧自由基水平升高,MDA 水平升高,且氧化应激损伤会导致多巴胺能神经元损伤,进而损伤大鼠神经功能[13]。本研究发现,与 control 组相比,SOD、GSH-Px、CAT 水平降低,MDA 水平升高,表明 PD 大鼠脑黑质中氧化水平升高,抗氧化能力降低,提示 PD 大鼠脑黑质存在氧化应激损伤,推测氧化应激损伤可能会导致神经元受损,影响大鼠神经行为学。过往研究显示氧化应激与细胞凋亡密切有关,过氧化氢可诱导大鼠脑皮质区神经元发生氧化应激凋亡,进而损伤神经功能[14]。本研究经流式细胞仪检测结果分析 PD 细胞发生明显凋亡,提示 PD 大鼠脑黑质区神经元凋亡,这可能是由于氧化应激损伤导致。
Nrf2 为细胞核转录因子,一般与 Keap1 结合存在细胞质内,当受到氧化应激刺激后,Nrf2 与 Keap1 解离,移位到细胞核中与 ARE 蛋白结合调控下游 HO-1 等抗氧化酶,发挥抗氧化作用。Nrf2/HO-1 与神经元抗氧化损伤有关,过往研究显示过表达 Nrf2 后可避免神经细胞受 6-OHDA 导致的氧化应激损伤[15]。在 Nrf2 缺陷小鼠中发现小鼠脑黑质区神经元凋亡明显增加,小胶质细胞活化程度升高,HO-1 水平显著降低[16]。在 PD 体内、体外研究中均发现,上调 HO-1 表达,则能够修复 神经系统氧化应激以及炎症损伤[17]。在 MPTP 诱导 PD 小鼠中发现上调 Nrf2,可使黑质区 HO-1 蛋白表达明显升高,神经元死亡数量降低,具有神经保护作用[18]。本研究体内体外实验均显示 PD 模型中 Nrf2、HO-1 蛋白表达降低,经 Nrf2 激活剂 Hesperin 干预后 Nrf2、HO-1 蛋白表达升高,经抑制剂 Brusatol 干预后 Nrf2、HO-1 蛋白表达则进一步降低,提示 Nrf2/HO-1 通路可能与 PD 的发生相关,激活 Nrf2/HO-1 通路能够发挥抗神经元氧化应激损伤,缓解大鼠神经细胞损伤。
细胞凋亡时涉及到凋亡因子以及抗凋亡因子,是多种蛋白共同参与的结果,其中抑凋亡成员 Bcl2 以及凋亡成员 Bax 在细胞凋亡过程中发挥重要作用。一般 Bcl2 与 Bax 在线粒体以二聚体形式存在以阻碍细胞凋亡;当遭受外界损伤后,Bax 水平升高,导致线粒体膜聚集大量 Bcl2/Bax 二聚体,造成线粒体膜通透性升高,使凋亡有关因子进入细胞中,激活 caspase 通路发生级联反应加速细胞凋亡。赵静宇等[19]研究显示激活 Nrf2 通路后,可减轻神经细胞的凋亡。此外激活 Nrf2 通路,可上调下游 HO-1 等抗氧化酶酶活,缓解大鼠海马神经损伤[20]。本研究显示 PD 模型大鼠 Bcl2 蛋白表达降低,caspase3、Bax 蛋白表达升高,经 Nrf2 激活剂 Hesperin 干预后 Bcl2 表达升高,caspase3、Bax 蛋白表达降低;经抑制剂 Brusatol 干预后 Bcl2 蛋白表达进一步降低,caspase3、Bax 蛋白进一步表达升高,提示 Nrf2/HO-1 通路抑制后会加重神经元凋亡,而激活后则可减轻神经细胞凋亡,推测 Nrf2/HO-1 通路可通过调控 caspase3 凋亡通路进而减轻神经细胞损伤。
综上所述,Nrf2/HO-1 通路可能参与 PD 的发生、发展,激活该通路后能够减轻脑组织氧化应激水平,降低神经元细胞凋亡,进而发挥对 PD 大鼠的神经保护作用。然而本研究仅对 Nrf2/HO-1 通路与 PD 的关系进行初步探究,并未对该通路下游调控基因进行研究,有待后续深入探究。
