原发性肝癌患者同种异体NK细胞治疗后疗效评价及外周淋巴细胞亚群变化特点
2019-06-18谢云波张纪元杜美玲孟繁平福军亮刘利敏王松山陈杨柳高莹莹徐若男王福生
谢云波,张纪元,杜美玲,孟繁平,福军亮,刘利敏,王松山,曲 芮,廉 方,乔 菲,陈杨柳,高莹莹,徐若男,施 明,王福生
(解放军总医院第五医学中心感染性疾病诊疗与研究中心, 北京 100039)
肝细胞癌(hepatocellular carcinoma, HCC)目前是全球恶性肿瘤相关死亡的第三大原因,NK细胞是天然免疫的重要组成部分,在清除病毒感染的细胞和肿瘤细胞中起关键作用。在慢性肝炎发展为肝癌的过程中,NK细胞功能缺陷与疾病进展密切相关,同时也是造成肿瘤细胞免疫逃逸的重要原因[1]。与正常肝组织相比,肝细胞癌患者瘤内NK细胞数量降低、细胞亚群分布改变,识别和杀伤肝癌细胞的功能降低[2-3]。近期研究表明,自体NK细胞治疗在多种实体瘤的治疗中可以提高外周循环中NK细胞的活性和数量,但由于很难迁移到肿瘤部位发挥功能,临床疗效有限[4-5]。同种异体NK细胞治疗近年来被广泛应用于各种临床试验。杀伤细胞免疫球蛋白样受体(killer cell immunoglobulin-like receptor, KIR)不匹配可以抑制自体组织相容性复合体(major histocompatibility conplex, MHC)分子的负向调控信号,保证足够的NK细胞活化。在急性髓系白血病(acute myelocytic leukemia, AML)患者中,来自KIR不匹配供体的NK细胞过继回输可显著降低造血干细胞移植后的复发率[6]。本研究以患者的健康直系血亲为供者,分离外周血单个核细胞并进行NK细胞的体外培养,在培养后的第14、15天,分2次回输给患者,通过对患者进行随访,同时评估同种异体NK细胞治疗的安全性和有效性。
1 资料与方法
1.1 研究对象
选择2016年4月至2017年10月在解放军总医院第五医学中心收治的HCC患者。
患者纳入标准:(1)年龄16~65岁的男性或女性患者;(2)按照《原发性肝癌诊疗标准(2015年版)》, 患者经病理学和影像学确诊为原发性肝细胞癌;肝功能Child-Pugh A/B级 (5~9分),美国东部肿瘤协作组评分标准(eastern cooperative oncology group score standard, ECOG)评分≤ 2分;(3)血小板计数>60×109/L;血红蛋白>80 g/L;凝血:国际标准化比率(international normalized ratio, INR)<2.3,或者凝血时间延长<6 s;血清白蛋白>28 g/L,总胆红素<51 mmol/L,谷丙/谷草转氨酶<5倍正常值上限;(4)合并乙肝患者进行抗病毒治疗,合并丙肝患者服用直接抗病毒(direct-acting antiviral agents, DAA)药物治疗。供者入组标准:(1)年龄18~40 岁的男性或女性且为患者直系血亲;(2)理解并签署知情同意书,且遵循自愿、无偿的原则;(3)排除糖尿病、高血压、心脏病等慢性疾病,全身无其他重大器质性疾病和传染性疾病;(4)没有精神障碍,具有完全的行为能力。
患者排除标准:(1)妊娠或哺乳期妇女;(2)器官移植后患者;(3)2 周内进行过介入微创治疗术或者1 个月内进行过切除手术的患者;(4)合并甲型肝炎、戊型肝炎、艾滋病等感染者,或有其他传染性疾病;(5)合并其他严重的全身性疾病和精神病患者;(6)筛选前30 d内发生过急性感染、消化道出血等严重并发症;(7)半年内进行过其他生物治疗,包括细胞因子诱导的杀伤细胞(cytokine-induced killer cells, CIK)、树突状细胞(dendritic cells,DCs)、嵌合抗原受体T细胞(chimeric antigen receptor T-cells, CAR-T)、程序性死亡受体1(programmed cell death protein 1, PD-1)和其他免疫治疗的患者。
共入组HCC患者21例,其中男性18例,女性3例,基线资料见表1。本项临床研究通过中国人民解放军第三零二医院医学伦理委员会审查批准,所有入组患者和供者均理解并签署知情同意书。

表1 患者的人口学和基线特征Table 1 Demographic and baseline characteristics of the patients
ECOG, eastern cooperative oncology group score standard; BCLC, Barcelona clinic liver cancer.
1.2 细胞制备及质控
包被:取NK细胞激活剂2 mL至175 cm2培养瓶中,加入20 mL生理盐水充分混匀并置于4 ℃冰箱过夜。
外周血单核细胞(peripheral blood mononuclear cell, PBMC)分离:采集供者外周血50~80 mL,通过Ficoll-Hypaque密度梯度离心,800 ×g,25 min;收集上层血浆并于56 ℃灭活30 min;收集单核细胞层细胞,加入生理盐水重悬,300 ×g,10 min洗涤2次。
细胞培养:用10 mL生理盐水冲洗包被的培养瓶,将PBMC重悬于NK细胞活化培养基中,使其密度为1×106/mL,分别按照终浓度为50 μg/L、1 000 IU/mL和2.5%分别加入重组人IL-15、重组人IL-2和灭活血浆,混匀后接种于包被培养瓶中;置于37 ℃,5% CO2饱和湿度培养箱中培养72 h;观察细胞生长状况并加入扩增培养基,调节细胞密度至5×105~8×105/mL,按照初始培养浓度加入细胞因子和灭活血浆,每2~3天传代1次。
细胞收获:培养14 d和15 d后,用生理盐水重量细胞300 ×g,8 min洗涤细胞2次,用含1%(体积分数)注射用人白蛋白的生理盐水悬浮细胞,经70 μm细胞筛过滤后转移至输液袋。
细胞质控:分别于培养第0、7、14天取细胞培养悬液进行质量检测,质检内容包括微生物学安全性(细菌、真菌、支原体、内毒素检测)和生物学活性(细胞活率、NK细胞纯度、NK细胞分泌细胞因子水平、NK细胞杀伤功能检测)。
1.3 随访检查
首次NK细胞治疗开始后4周、8周、12周、24周、36周、48周定期随访。随访观察指标包括安全性指标(发热及其他不适、血常规、肝肾功能、心电图)和有效性指标(临床症状及体征、肿瘤标志物水平、生物化学指标、影像学指标、免疫学指标及生活质量评价)。
1.4 统计学分析
2 结果
2.1 同种异体NK细胞治疗安全性评价
21例患者中,10例患者治疗1疗程,5例患者治疗2疗程,5例患者治疗3疗程。所有患者未见恶心、呕吐、感染、过敏、昏迷、急性和慢性移植物抗宿主反应(graft-versus-host disease, GVHD)。10例患者在细胞输注后24 h内出现短暂发热反应,其中9例患者体温为37.3~38.5 ℃,1例患者体温为38.5~39.5 ℃。1例患者接受NK细胞治疗12 h后出现轻微肝痛,1例患者出现轻微头痛。以上所有患者的症状均在8 h内自然缓解,无需治疗。结果表明,该剂量的NK细胞治疗不超过患者的耐受限度。
在1年的随访中,同种异体NK细胞治疗后3个月内患者淋巴细胞数量逐渐减少,但差异无统计学意义。治疗3个月后淋巴细胞计数恢复至治疗前水平,6个月后淋巴细胞计数高于基线,然后缓慢恢复到原水平。中性粒细胞和血小板水平无明显变化。治疗后患者谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBil)、白蛋白(albumin, ALB)均在正常范围内波动,与基线比较差异无统计学意义,甲胎蛋白(alpha fetoprotein, AFP)水平较NK细胞治疗前显著降低。
2.2 同种异体NK细胞治疗疗效评价
按照实体瘤疗效评价(response evaluation criteria in solid tumors, RECIST)1.1标准[7], 21例同种异体NK细胞治疗的HCC患者1年随访中,1例(4%)完全缓解,3例(12%)部分缓解,12例(52%)病情稳定。所有患者的总疾病控制率为76.2%(表2),其中BCLC(Barcelona clinic liver cancer) A期患者中疾病控制率为100%, SD 10例;BCLC B期患者中疾病控制率为60%,部分缓解(partial response, PR) 1例,SD 2例;BCLC C期患者中疾病控制率为50%,完全缓解(complete response, CR) 1例,PR 2例。截至2019年5月,接受同种异体NK细胞治疗的21例患者中有5例死亡。死亡患者中BCLC C期患者3例,存活时间分别为3个月、4个月和4个月;BCLC B期患者2例,存活时间分别为4个月后、10个月。

表2 NK细胞治疗疗效评价Table 2 Summary of efficacy measures
2.3 同种异体NK细胞治疗后外周免疫变化
同种异体NK细胞过继回输后24 h,患者CD4+ T细胞的频率和CD4/CD8比值较基线显著升高(图1),而NK细胞和CD8+ T细胞的频率较基线显著下降,B细胞频率较治疗前差异无统计学意义。考虑到所培养的NK细胞和患者PBMC存在互相杀伤的可能,分别以患者PBMC和供者培养后的NK细胞为靶细胞进行单向混合淋巴细胞培养,发现无论是否加入IL-2,供者培养后的NK细胞对患者PBMC均无杀伤作用,但具有正常杀伤肿瘤细胞系的能力。
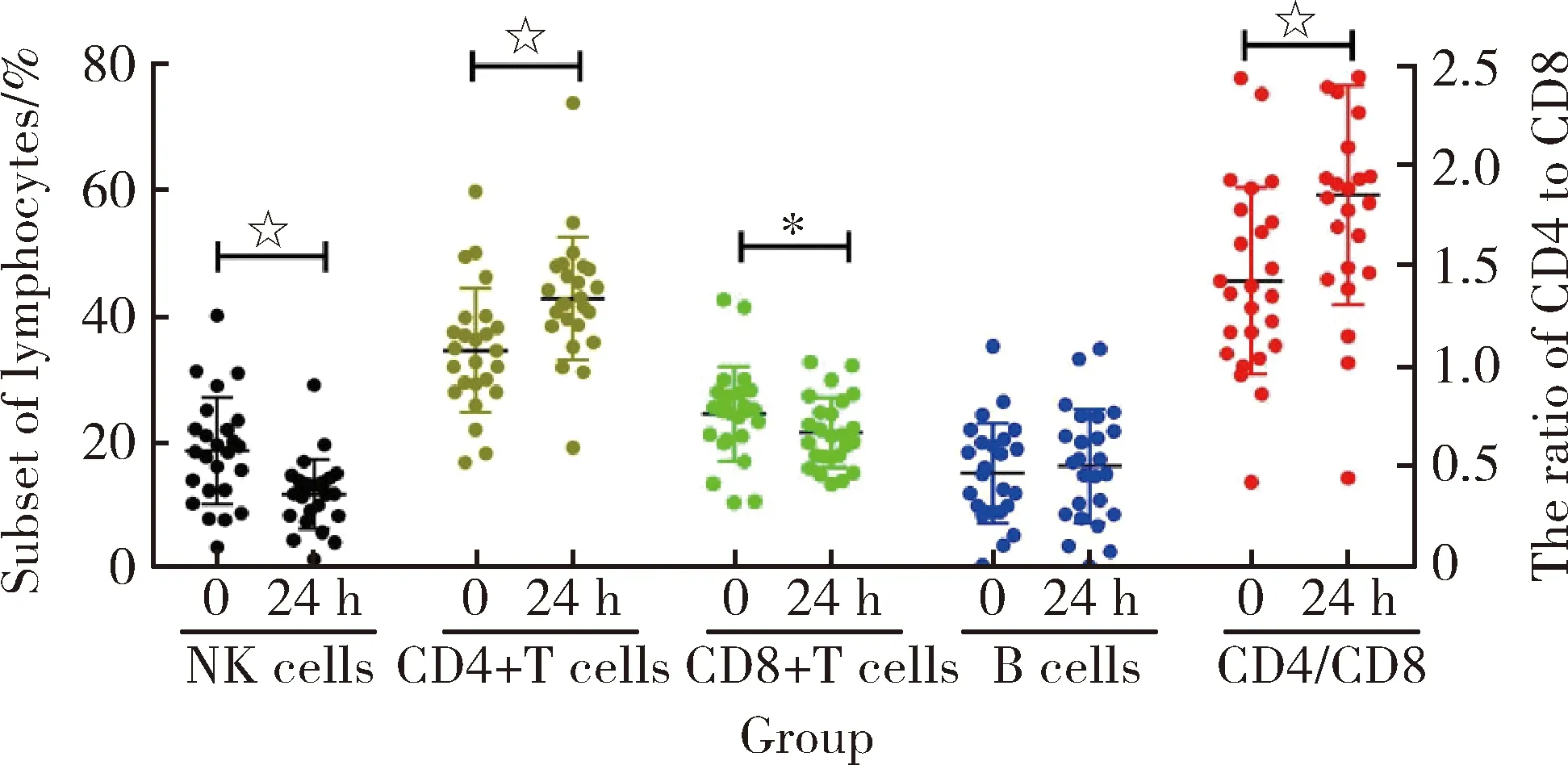
*P<0.05, ☆P<0.001.图1 NK细胞治疗24 h后患者外周血淋巴细胞亚群变化Figure 1 Changes in the proportion of lymphocyte subsets 24 h after treatment
3 讨论
早期的基础研究显示,在造血干细胞移植和骨髓移植过程中CD56(bright) NK细胞的百分比与GVHD的发生密切相关,当移植物中CD56(bright) NK细胞超过3%时,GVHD发生的概率接近于零[8-10]。本实验培养NK细胞的中位频率为80%,远远超过造血干细胞移植和骨髓移植中CD56(bright) NK细胞的频率,但在本试验研究的1年随访过程中,研究没有观察到急性和慢性GVHD的发生,提示同种异体NK细胞在原发肝癌的临床应用中有很好的安全性。本研究结果显示,疾病控制率与同种异体NK细胞治疗的疗程有关,治疗的疗程数越多,疾病控制率越高,提示异体NK细胞在患者体内存在半衰期,多次治疗可能会提高治疗疗效,但由于本临床试验样本量较小,难以控制和调整混杂因素,这一结果还需要通过大样本临床试验进一步验证。
本研究检测了同种异体NK细胞过继输注后HCC患者外周血淋巴亚群的变化,发现虽然短期内输入了了大量的外源性NK细胞,但患者外周血中NK细胞的数量和频率仍然低于治疗前水平。同种异体NK细胞输注后患者外周血CD8 T细胞和NK细胞数量在24 h内降至最低,B细胞在48 h内降至最低,1周后逐渐恢复至正常水平,这一结果与Qin等[11]的报道相反。本研究将培养的NK细胞与未处理的HCC患者PBMC体外共培养24 h,未观察到培养的NK细胞对患者PBMC的杀伤作用,也未观察到患者PBMC对培养NK细胞的杀伤作用,这一结果可能与Miller等[12]报道的单倍体NK细胞过继回输后异体NK细胞在患者体内嵌合现象有关。本研究推测,大剂量同种异体CD56(bright) NK细胞过继输注后,可能通过分泌细胞因子激活患者的自然免疫和特异性免疫,诱导患者特异性CD8+T细胞和NK细胞向肿瘤部位迁移,改变肿瘤局部微环境并杀伤肿瘤细胞。
本研究6例晚期肝癌患者1例治疗后完全缓解,回顾分析发现该患者在接收同种异体NK细胞治疗同时也接受索拉非尼治疗,提示同种异体NK细胞联合索拉非尼可能会延长患者的生存时间。索拉非尼是晚期HCC的靶向治疗药物,据Llovet等[13]在NEnglJMed报道,索拉非尼可使晚期HCC患者的中位生存期延长近3个月,但在299例单用索拉非尼治疗的患者中,没有一例患者达到CR。回顾2012—2018年在解放军总医院第五医学中心感染性疾病诊疗与研究中心接受索拉非尼治疗的患者,也没有发现CR病例。此外,索拉非尼的副作用和耐药性仍然存在,这极大地限制了索拉非尼的临床应用。既往研究表明[14-15],索拉非尼可触发肿瘤相关巨噬细胞(tumor-associated macrophage, TAM)的促炎活性,继而诱导抗肿瘤NK细胞反应,提示NK细胞治疗联合索拉非尼可使患者获得更好的临床疗效。在研究3例同种异体NK细胞联合索拉非尼患者的总生存时间分别为16个月、19个月、32个月,均存活到2019年5月,远远超过报道的10.3个月,提示同种异体NK细胞联合索拉菲尼在晚期肝癌的治疗中可能具有巨大的潜力。
综上所述,同种异体NK细胞治疗HCC有很好的安全性和有效性,对延长患者生存时间、提高生活质量可能具有良好的治疗前景。但仍需要进一步通过大样本、多中心、随机对照研究评估同种异体NK细胞联合索拉菲尼治疗晚期肝癌的疗效。
