过表达SIRT1对脊神经结扎大鼠病理性疼痛的影响及机制
2019-06-17华雷周外平李梦杰
华雷,周外平,李梦杰
(武汉市第四医院,武汉 430033)
神经病理性疼痛属于慢性疼痛,一般表现为自发性疼痛、痛觉异常以及痛觉过敏[1]。细胞沉默信息调节因子1(SIRT1)具有较强的去乙酰化作用,主要参与糖脂代谢、细胞周期调控、细胞凋亡等生理过程。研究表明,SIRT1抑制剂能加速足部甲醛炎症疼痛,而激活SIRT1表达后可降低足部炎症疼痛[2,3]。体外SIRT1过表达可减轻内毒素所致神经元轴突变性,缓解脊髓疼痛[4]。然而关于SIRT1抑制神经性疼痛机制目前研究不多。本研究通过制备脊神经结扎(SNL)模型,经鞘内注射过表达SIRT1载体,探究其对大鼠病理性疼痛及神经元凋亡的影响。
1 材料与方法
1.1 材料 SPF级雄性SD大鼠54只,8周龄,体质量220~260 g,购于河南省动物实验中心,许可证号:SYXK(豫)2016-0002。所有大鼠在统一环境内饲养,室内温度25 ℃,相对湿度45%~60%,昼夜交替12 h,自由摄食、饮水,严格遵循国家动物饲养规则,动物疼痛实验经本院动物伦理委员会批准同意。兔抗鼠SIRT1、乙酰化组蛋白H3(Ac-H3)、胶质纤维酸性蛋白(GFAP)、cleaved-Caspase-3、Bcl-2、Bax、β-actin、山羊抗兔二抗(博奥森生物科技有限公司)、pAd/PL腺病毒载体(Invitrogen公司,美国),免疫荧光显微镜、垂直电泳仪(Bio-Rad公司,美国),鼠TNF-α、IL-1β、IL-6 ELISA检测试剂盒(Simga公司,美国);蛋白提取试剂盒、BCA检测试剂盒(索莱宝科技有限公司,中国);机械痛阈测量仪及热辐射痛阈检测仪(UGO BASILE公司,意大利),透射电镜(Tecnai公司,荷兰)。
1.2 模型制备及分组 大鼠均经腹腔注射2%戊巴比妥50 mg/kg麻醉,经L4、L5脊椎间隙将PE-10导管(20 cm)插入2 cm,经皮下隧道至颈部导出后于皮肤后方固定,采用热熔风封口。鞘内置管成功后,参照文献[5]方法进行SNL模型制备,大鼠麻醉后分离脊柱组织,暴露左侧L4、L5横突,将部分L5横突去除,暴露L4~L5脊神经,采用非吸收外科线结扎L5脊神经并在远端切断。将大鼠随机分为假手术组、Cont-shRNA组、SIRT1-shRNA组,每组18只。将阴性对照序列Cont-shRNA与SIRT1-shRNA序列克隆至腺病毒载体中,分别获得含Cont-shRNA、SIRT1-shRNA的腺病毒载体。假手术组仅暴露脊神经不进行结扎处理,经鞘内注射25 μL生理盐水,每天注射1次,连续7 d;Cont-shRNA、SIRT1-shRNA组模型制备成功后鞘内分别注射25 μL的Cont-shRNA、SIRT1-shRNA,均每天注射1次,连续7 d。
1.3 大鼠行为学测定 于第1、3、7 天时,各组分别取大鼠6只,置于玻璃箱用Von-Frey 纤维丝刺激足中底部至大鼠出现缩足或舔足反应,连续测量3次,记录大鼠机械刺激缩足反应阈值(PWT),取平均值。将大鼠置于热辐射痛阈检测仪,加大电源辐射刺激大鼠足底部,当出现缩足或舔足反应,连续测量3次,间隔时间5 min,记录开启电源至出现热刺激缩足反应潜伏期所用时间(PTWL)。大鼠行为学测定后,麻醉放血处死,收集血液及脊髓腰膨大组织,置于-80 ℃中保存。
1.4 脊髓组织中SIRT1蛋白、Ac-H3蛋白表达检测 采用免疫印迹法。取出冷冻脊髓组织研磨后用裂解液裂解、提取总蛋白,检测蛋白浓度后,SDS-PAGE电泳分离等量蛋白,转膜反应、封闭后,添加一抗(1∶500)4 ℃过夜,添加二抗(1∶5 000)室温放置1 h,ECL显色后凝胶成像仪中观察并计算蛋白表达。
1.5 脊髓组织中TNF-α、IL-1β、IL-6表达检测 采用ELISA法。用酶联免疫吸附法检测脊髓组织中TNF-α、IL-1β、IL-6表达,严格参照试剂盒说明操作。称取0.1 g脊髓组织,加生理盐水0.9 mL,置于匀浆器中制备组织匀浆,3 000 r/min离心10 min,保存上清。设置空白孔(仅添加显色溶液、终止液)、样品孔,样品孔中添加100 μL组织匀浆上清,室温下封板孵育2 h,洗涤、拍干后添加100 μL生物素化抗体,洗涤、拍干后添加100 μL HPR反应液,室温下封板后避光孵育20 min,洗涤、拍干后,添加显色剂避光孵育15~20 min,添加50 μL终止液结束反应,450 nm波长处测定吸光度值,绘制标准曲线计算样品浓度。
1.6 脊髓背角星形胶质细胞活化情况观察 采用免疫荧光染色法。制备脊髓组织冷冻切片,加入TritonX-100放置30 min,山羊血清封闭37 ℃孵育1 h,添加GFAP一抗4 ℃中孵育过夜,加入FITC标记二抗37 ℃孵育1 h,置于荧光显微镜下观察蛋白荧光强度,同时统计星形胶质数目。
1.7 脊髓神经元超微结构观察 脊髓组织切片于3%戊二醛中固定,再次置于1%锇酸内固定、乙醇中水合,包埋后行醋酸铀-枸橼酸铅双染色后置于透射电子显微镜下观察神经元超微结构变化。
1.8 脊髓组织中凋亡蛋白Bax、Bcl-2、cleaved-Caspase-3 表达检测 采用免疫印迹法检测Bax、Bcl-2、cleaved-Caspase-3 蛋白表达。将脊髓组织研磨后添加裂解液裂解,提取脊髓组织总蛋白,BCA法测定蛋白含量后,SDS-PAGE电泳分离目的蛋白,将蛋白转移至PVDF膜,添加山羊血清封闭,添加一抗(1∶500)4 ℃过夜,添加二抗(1∶5 000)37 ℃孵育1 h,ECL发光显影后凝胶成像仪中观察并计算蛋白表达。

2 结果
2.1 三组不同时点脊髓组织中SIRT1蛋白、Ac-H3蛋白表达比较 见表1、2。

表1 三组不同时点脊髓组织中SIRT1蛋白表达比较
注:与假手术组相比,*P<0.05;与Cont-shRNA组相比,#P<0.05。

表2 三组不同时点脊髓组织中Ac-H3蛋白表达比较
注:与假手术组相比,*P<0.05;与Cont-shRNA组相比,#P<0.05。
2.2 三组不同时点PWT、PTWL比较 见表3、4。
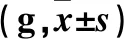
表3 三组不同时点PWT比较
注:与假手术组相比,*P<0.05;与Cont-shRNA组相比,#P<0.05。
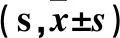
表4 三组不同时点PTWL比较
注:与假手术组相比,*P<0.05。
2.3 三组脊髓背角星形胶质细胞活化情况 假手术组脊髓背角GFAP蛋白正常表达,荧光较弱,胞体不明显;干预第1 天,Cont-shRNA组GFAP蛋白荧光亮度增强,第3、7 天星形胶质细胞体积增大;与Cont-shRNA组相比, SIRT1-shRNA组GFAP蛋白荧光亮度减弱,星形胶质细胞体积变小。三组不同时点脊髓背角GFAP阳性细胞数比较见表5。
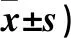
表5 三组不同时点脊髓背角GFAP阳性细胞数比较(个,
注:与假手术组相比,*P<0.05;与Cont-shRNA组相比,#P<0.05。
2.4 三组脊髓背角GFAP蛋白表达比较 见表6。

表6 三组脊髓背角GFAP蛋白表达比较
注:与假手术组相比,*P<0.05;与Cont-shRNA组相比,#P<0.05。
2.5 三组不同时点脊髓组织中TNF-α、IL-1β、IL-6表达比较 见表7~9。

表7 三组不同时点脊髓组织中TNF-α表达比较
注:与假手术组相比,*P<0.05;与Cont-shRNA组相比,#P<0.05。

表8 三组不同时点脊髓组织中IL-1β表达比较
注:与假手术组相比,*P<0.05;与Cont-shRNA组相比,#P<0.05。
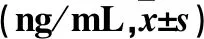
表9 三组不同时点脊髓组织中IL-6表达比较
注:与假手术组相比,*P<0.05;与Cont-shRNA组相比,#P<0.05。
2.6 电镜下脊髓背角神经元结构变化 假手术组第1、3、7 天神经元细胞核表面光滑呈现圆形,细胞核中染色质明显,细胞质内核糖体、线粒体等形态正常,均匀分布。Cont-shRNA组第1 天神经元肿胀,线粒体、内质网等肿胀裂解,第3、7 天时神经元出现皱缩、变形,细胞核固缩,染色质浓缩贴于核膜边,呈现凋亡状。SIRT1-shRNA组第3 天,神经元异形程度明显减轻,染色质缩短程度以及核膜边集程度减轻。见图1。
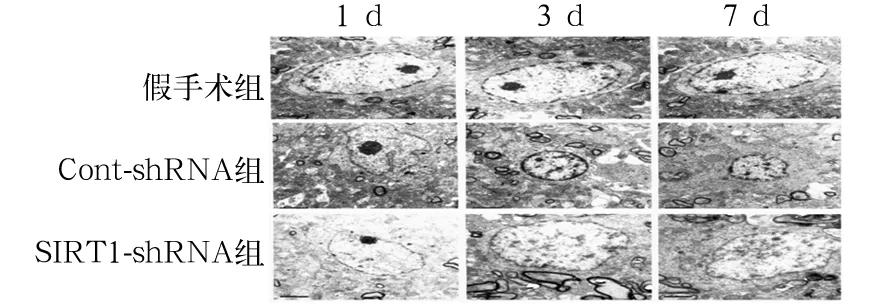
图1 电镜观察脊髓背角神经元超微结构(10 000×)
2.7 三组不同时点脊髓背角组织中凋亡相关蛋白表达比较 见表10。

表10 三组不同时点脊髓背角组织中凋亡相关蛋白表达比较
注:与假手术组相比,*P<0.05;与Cont-shRNA组相比,#P<0.05。
3 讨论
组蛋白乙酰化属于表观遗传学研究重要内容,组蛋白发生乙酰化时,可抑制或促进基因转录,进而在肿瘤、应激、创伤等病理过程中发挥调控作用。SIRT1属于组蛋白去乙酰化酶,通过对底物进行去乙酰化调控,参与细胞增殖、凋亡、周期调控等生理过程。在人胚肾细胞中发现,SIRT1通过抑制启动子Bclaf1激活进而抑制T细胞活化,此作用通过介导组蛋白56位赖氨酸去乙酰化作用实现[6]。在急性肾缺血再灌注模型中研究发现,髓质外层中SIRT1表达明显增加,此与组蛋白去乙酰化水平下降密切相关[7]。近期研究发现,乙酰化平衡状态的破坏与神经病理性疼痛密切相关,采用去乙酰化抑制剂治疗肿瘤患者,疼痛增强,而停止治疗则可减轻疼痛,表明去乙酰化抑制剂的使用与患者疼痛增强密切相关[8]。Shao等[9]研究发现,激活脊髓SIRT1后可缓解减轻小鼠神经病理性疼痛。王依慰等[10]发现,白藜芦醇可通过激活SIRT1,促进p65去乙酰化缓解神经病理性疼痛。然而SIRT1去乙酰化是否影响SNL大鼠病理性疼痛,目前尚不明确。
本研究结果发现,与假手术组相比,干预第 1、3、7天, Cont-shRNA组SIRT1蛋白表达降低,差异有统计学意义,而与Cont-shRNA组相比,SIRT1-shRNA组SIRT1蛋白表达升高,差异有统计学意义,表明SIRT1序列成功在小鼠脊髓组织中高表达。进一步研究分析Cont-shRNA组大鼠行为学指标PWT、PTWL降低,SIRT1-shRNA组PWT、PTWL升高,表明上调SIRT1表达后能缓解大鼠病理性疼痛。进一步对组蛋白检测发现上调SIRT1表达可明显降低Ac-H3表达,提示SIRT1可能通过调控组蛋白乙酰化水平参与神经病理性疼痛的发生发展。
研究表明,星形胶质细胞在神经信号传递中发挥重要作用,且星形胶质细胞的持续激活与神经病理性疼痛密切有关,阻断细胞激活可一定程度上减轻病理性疼痛[11,12]。GFAP为星形胶质细胞激活标志物[13]。本研究免疫荧光结果显示,与假手术组相比,Cont-shRNA组脊髓背角星形胶质细胞体积增大,荧光亮度增强,且GFAP阳性细胞数随处理时间的延长逐渐增多,而SIRT1-shRNA组星形胶质细胞体积增加不明显,荧光强度减弱,且GFAP阳性细胞数减少,表明过表达SIRT1可抑制星形胶质细胞活化,降低其标志物的表达,过表达SIRT1可能通过抑制星形胶质细胞的活化进而缓解神经病理性疼痛。
胡传银等[14]研究显示,L5SNL神经疼痛模型中脊髓胶质细胞内MAPK信号通路激活后可刺激下游炎症因子活化如TNF-α、IL-1β、IL-6,作用于脊髓后角神经元,继续加重神经病理性疼痛。研究显示,大鼠神经病理性疼痛模型中胶质细胞中TNF-α、IL-1β、IL-6 蛋白表达升高,采用TNF-α抑制剂预处理后则大鼠疼痛行为得到明显缓解[18]。本研究结果显示,Cont-shRNA组脊髓组织中TNF-α、IL-1β、IL-6表达明显升高,而SIRT1-shRNA组脊髓组织中TNF-α、IL-1β、IL-6表达明显降低,提示过表达SIRT1可减轻大鼠神经病理性疼痛,此可能与抑制TNF-α、IL-1β、IL-6表达有关。
赵伟等[16]研究发现,SNL动物模型中存在神经元凋亡,导致γ -氨基丁酸减少,加速神经兴奋,参与神经病理性疼痛的发生发展,采用Caspase抑制剂处理后可显著抑制神经元凋亡,减轻病理性疼痛。此外,有研究还发现坐骨神经结扎大鼠给予Caspase抑制剂后可明显缓解病理性疼痛,此可能与降低脊髓背角神经元凋亡、抑制神经生长因子有关[17]。本研究电镜结果显示,Cont-shRNA组神经元肿胀,线粒体、内质网等肿胀裂解,3、7 d时神经元出现皱缩、变形,细胞核固缩,染色质浓缩贴于核膜边,呈现凋亡状,SIRT1-shRNA组神经元异形程度明显减轻,染色质缩短程度及核膜边集程度减轻,提示过表达SIRT1可能抑制神经元凋亡。研究显示,沉默SIRT1后可下调Bcl-2蛋白、上调Bax及cleaved-Caspase-3 蛋白表达,抑制BDNF对神经元的凋亡[18]。本研究结果显示,与假手术组相比,干预后1、3、7 d Cont-shRNA组 Bcl-2蛋白表达降低,Bax、cleaved-Caspase-3 蛋白表达升高,SIRT1-shRNA组Bcl-2蛋白表达升高,Bax、cleaved-Caspase-3 蛋白表达降低,提示过表达SIRT1后可影响凋亡蛋白的表达进而影响神经元凋亡。
综上所述,SNL大鼠过表达SIRT1后,通过抑制星形胶质细胞活化,降低神经元凋亡缓解SNL大鼠病理性疼痛,然而SNL神经病理性疼痛发生机制较复杂,SIRT1是否还可能通过影响其他途径发挥作用,有待进一步深入探究。
