过量表达盐芥TsIPK2基因增强转基因水稻耐盐性
2019-06-17潘晓雪胡明瑜蒋晓英白文钦雷开荣
潘晓雪,胡明瑜,蒋晓英,白文钦,官 玲,吴 红,雷开荣
(重庆市农业科学院生物技术研究中心/逆境农业研究重庆市重点实验室,重庆 401329)
磷脂酰肌醇(phosphatidylinositol, PI)信号通路是植物细胞信号转导中的一种重要的胞内信使系统,在植物生长发育和对环境因子的响应中发挥着重要作用[1]。磷脂酰肌醇信号调控是通过一系列肌醇激酶和肌醇磷酸酶来实现的,其中多磷酸激酶是磷脂酰肌醇信号通路中的一个关键酶。多磷酸激酶是一类磷酸肌醇6-/3-双激酶,它能够在6位和3位磷酸化Ins (1,4, 5) P3生成Ins (1, 4, 5) P4并进一步生成Ins (1, 4, 5)P5。多磷酸激酶最早在酵母中被发现并称为IPK2(inositol polyphosphate kinase),但其在哺乳动物中通常又叫做IPMK (inositol polyphosphate multkinase)[2-4]。最早通过同源性比对从拟南芥中鉴定出来两个多磷酸肌醇激酶,分别命名为AtIPK2α和AtIPK2β,生化分析实验证明AtIPK2α和AtIPK2β都具有多磷酸肌醇激酶家族代表性的6-/3-双激酶催化活性,同时还发现AtIPK2β很可能也参与植物转录调控[5-6],此后多磷酸肌醇激酶基因陆续从水稻、马铃薯和盐芥中克隆出来[7-9]。AtIPK2β不仅可以互补酵母scipk2突变体在正常条件下生长缓慢的缺陷,而且还能提高其在盐、渗透以及高温条件下的生长耐受力,暗示AtIPK2β很可能还参与逆境应答过程[6,10]。与野生型相比,异源表达AtIPK2β的转基因烟草对盐、干旱以及氧化胁迫表现出明显的耐受性,转AtIPK2β基因烟草能够通过减少钠离子积累,增加脯氨酸含量和过氧化氢酶活性,并表达应激相关基因以提高烟草的耐胁迫能力[10]。OsIPK2在水稻多种组织中都有表达,而且同样能够互补酵母scipk2突变体的生长缺陷[7]。盐芥是一种新型耐盐模式植物, 序列比对发现盐芥TsIPK2与AtIPK2β具有较高的同源性,也能够互补胁迫处理下酵母scipk2突变体的生长缺陷表型。过量表达TsIPK2可以增加转基因油菜对盐、干旱和氧化胁迫的耐受性[9]。过量表达盐芥TsIPK2的大豆株系比受体品种具有更高的耐盐胁迫能力[11]。以上这些研究表明参与逆境应答很可能是植物IPK2基因一个较为普遍的功能。
水稻是我国主要的粮食作物,随着人口增加和盐渍化土地面积的不断扩大,培育耐逆水稻品种已成为当务之急,在此基础上,本研究将盐芥TsIPK2基因通过农杆菌浸染愈伤法在水稻中进行过量表达,利用NaCl模拟盐胁迫环境,研究TsIPK2基因在植物耐盐胁迫中的作用,以期揭示TsIPK2基因的耐逆机制,丰富TsIPK2基因的生物学功能。
1 材料与方法
1.1 供试材料
供试材料粳稻‘秀水03’ (WT)由本中心保存;上海植生所张洪霞研究员提供过量表达TsIPK2(Gen-Bank登录号为EF110977)基因载体(pCAMBIA1301-TsIPK2)[9]。
1.2 方法
1.2.1 转TsIPK2基因水稻株系的获得及分子检测
采用农杆菌介导愈伤转化法获得转基因水稻植株,幼苗生长旺盛后,取叶片提取基因组DNA,并使用TsIPK2基因开放阅读框(open reading frame,ORF)的特异性引物(正向引物: 5′- ATGCTCAAG GTCCCTGAACAC-3′; 反向引物: 5′-CTAGTGCC CGTTTTCAAGCTG-3′)进行PCR扩增,1%琼脂糖电泳检测目的条带, 筛选出基因组中有TsIPK2基因整合的水稻植株,获得T1代种子。利用Trizol试剂(Invitrogen)参照说明书提取T1代转基因幼苗RNA,按照说明书取2~3 μg RNA用M-MLV逆转录酶(Promega)进行cDNA的第一链合成, 反转录后用TsIPK2基因ORF区特异性引物(正向引物: 5′-CGGATGTGTCGGAAGAATACT-3′,反向引物: 5′-GCGAAATCCACCAGCTTTAC-3′)进行 RT-PCR 扩增, 选用水稻ubiquitin 1(OsRub1)基因(正向引物: 5′-GACAATGTGAAAGCCAAGATC-3′,反向引物: 5′-GACTCAACCTCAAGGGTAATG-3′)作为内参基因,1%琼脂糖电泳检测结果,验证TsIPK2基因是否能在水稻中正常表达。鉴定的阳性植株幼苗移栽到试验田中继续生长以收获T2代种子,自交纯化后得到T3代植株用于后续试验。
1.2.2 水稻种子萌发的测定 挑选T3代籽粒饱满、大小一致的转基因株系(Line 2和Line 3)和秀水03 (WT)种子,种子在50℃烘箱中干燥2天,打破休眠。然后将种子用0.1%(w/v)的HgCl消毒10 min,然后用蒸馏水冲洗干净。将种子放入培养皿(皿底垫两层滤纸) 中,每个培养皿中放50粒种子,采用NaCl单盐溶液进行处理,设置0、50、100、150、200 mmol/L 5个体积浓度梯度,处理组分别加入10 mL NaCl水溶液,对照组加入等量的蒸馏水,将培养皿放置在30℃的黑暗条件下萌发,至第10天记录种子发芽率(以芽长达到种子长度一半,根长达到种子长度作为种子发芽的标准),三次重复,每一重复随机取30粒测量芽长、主根长,计算平均值。
1.2.3 转基因水稻植株的耐盐性分析 将种子按上述方法进行消毒并用蒸馏水冲洗干净,然后在37℃培养箱中浸种催芽2天,将露白种子直接播于96孔PCR板上,将PCR板置于塑料盒中,在26℃光照培养箱内生长,光照强度2500 lx、光照14 h。待苗长至3叶期时剔除弱苗,选取均匀一致的幼苗用0、50、100、150、200 mmol/L的NaCl处理,每3天换1次营养液,处理2周后选取叶片测定各项生理生化指标,每个处理重复3次。在南京建成生物工程公司购买脯氨酸、丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)检测试剂盒,各生理指标的测定均设置3次重复。
1.2.4 胁迫处理下TsIPK2基因的表达分析 取胁迫处理前后的样品,方法同上。基因特异性引物(表1)设计由Primer 5.0完成,PCR在定量PCR仪(Applied Biosystems 7500,Foster City,USA)上进行,用 SYBR Green I dye (Takara Bio Inc.,Otsu,Japan)进行分析。qRT-PCR反应条件为:初始变形95℃,30 min;然后95℃,5 min,58℃,34 min,重复上述两步40次;融解阶段为95℃,15 min,60℃,60 min,95℃,15 min。水稻ubiquitin 1(OsRub1)(GenBank登录号:AF184729)基因作为内参。qRTPCR的样品包括3次生物重复和3次技术重复。
1.2.5 数据分析 数据、表及文字处理采用Office 2007软件,其中部分数据用SPSS20.0进行统计分析,用OriginPro8绘图。
2 结果与分析
2.1 转基因植株的分子检测
在本研究中,再生植株DNA使用TsIPK2基因的特异性引物扩增。转TsIPK2基因水稻的3个株系中均扩增出一条约882 bp的特异性带,在野生型植株中未检测到相同的条带(图1A),表明TsIPK2基因已成功整合到水稻基因组中。然后提取植株RNA,进行RT-PCR检测(图1B),结果显示TsIPK2基因能够在水稻中正常表达。
2.2 TsIPK2在盐胁迫下的表达分析
分别提取水稻三叶期幼苗在200 mmol/L的NaCl处理0、1、3、6、12和24 h的叶片总RNA,以水稻ubiquitin 1(OsRub1)基因作为内参,分析在盐胁迫下TsIPK2的表达特征。在200 mmol/L的NaCl处理下,TsIPK2的转录水平在处理1 h后增加,3 h后达到峰值,6 h后下降,随着处理时间的延长,依然高于未处理时的表达水平(图2)。这表明在盐胁迫下TsIPK2基因在胁迫下能迅速响应。
2.3 盐胁迫对水稻种子发芽率的影响
随着NaCl浓度的增加,转基因株系和野生型发芽率都受到抑制,但野生型发芽率显著低于转基因株系(图3)。在150 mmol/L NaCl的处理下,转基因株系的发芽率均在60%以上,而野生型的发芽率在30%左右。这表明野生型水稻种子的发芽率在高浓度NaCl处理下受到更显著的抑制(图3)。
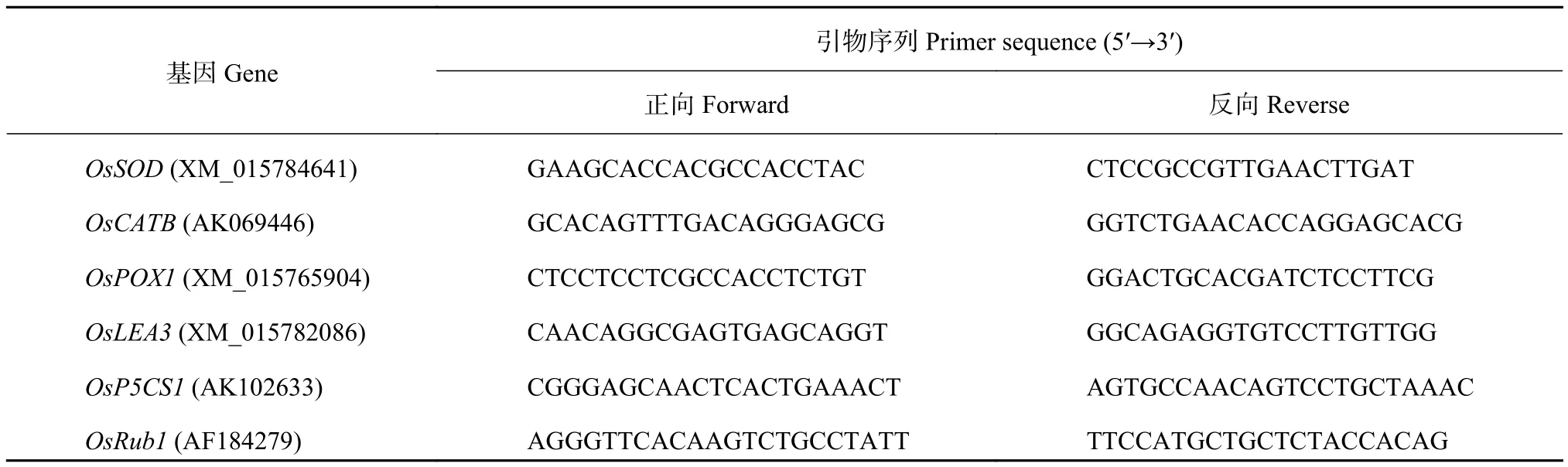
表 1 用于实时定量PCR分析的引物信息Table 1 Genes specific primers used for quantitative RT-PCR analysis

图 1 转基因水稻的PCR和RT-PCR检测Fig. 1 PCR and RT-PCR detection in different transgenic rice lines
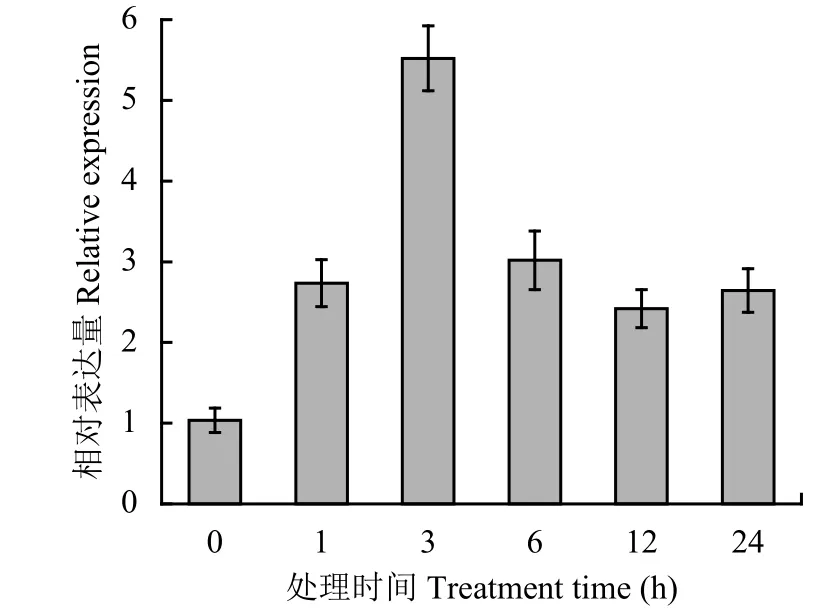
图 2 TsIPK2在高盐胁迫下的表达特征Fig. 2 Expression of TsIPK2 under salt stress
2.4 盐胁迫对水稻种子幼根及芽生长的影响
与野生型相比,不同浓度盐胁迫下转基因水稻的根长和芽长均高于对照,在200 mmol/L NaCl处理下,转基因水稻L2和L3株系的平均芽长比野生型分别高出8.2%和11.6%,平均根长比野生型分别高出17.1%和19.1%,说明转基因水稻具有较好的生长优势 (图 4)。
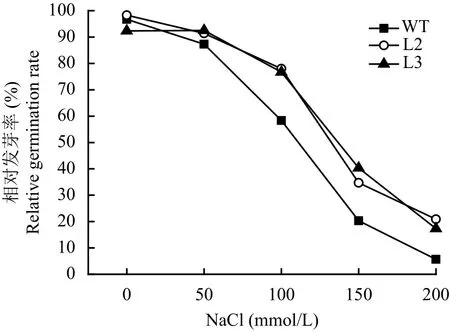
图 3 盐胁迫下转基因水稻幼苗的发芽率Fig. 3 Germination rate of two transgenic rice lines under salt stress
2.5 盐胁迫对水稻生理指标的影响
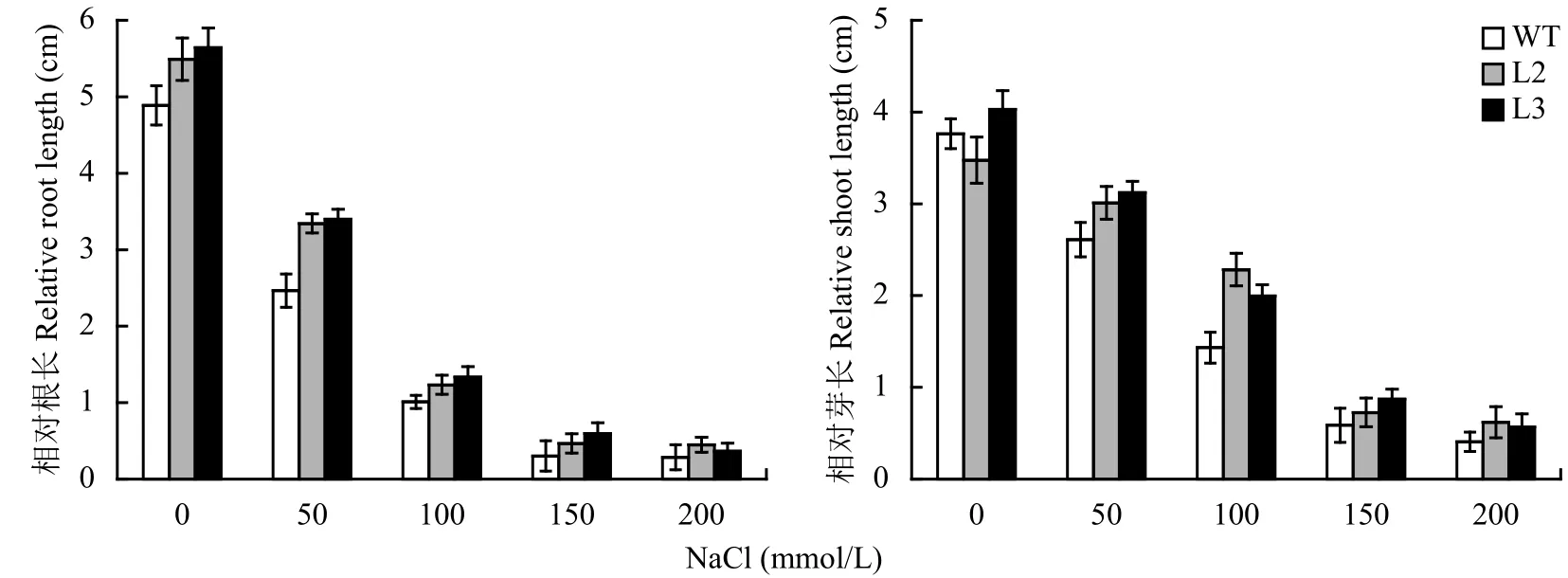
图 4 不同盐浓度胁迫下转基因水稻的根长和芽长Fig. 4 Root and shoot length of transgenic rice under different salt stress concentrations
2.5.1 盐胁迫下水稻的脯氨酸和丙二醛(MDA)含量正常生长条件下,转基因水稻叶片的脯氨酸含量略高于野生型。盐胁迫处理14 d后,野生型和转基因水稻叶片中的脯氨酸含量都急剧增加,但转基因水稻积累更多游离脯氨酸。在150 mmol/L NaCl浓度下,转基因株系L2和L3的脯氨酸含量的增幅分别是野生型的1.29倍和1.34倍;在200 mmol/L NaCl浓度下,脯氨酸在转基因株系L2和L3中的含量分别是野生型植株的1.71和1.55倍,更有利于转基因植株对盐胁迫的适应(图5)。
野生型和转基因水稻的MDA含量在盐胁迫处理前无显著差异。随着NaCl处理浓度的增加,所有植株MDA含量都有所增加,但转基因水稻体内MDA含量都低于野生型植株。在200 mmol/L NaCl浓度下,野生型水稻的MDA含量增加了2.12倍,而转基因水稻L2和L3的MDA含量分别增加了1.33和1.05倍,野生型水稻的MDA含量明显高于转基因水稻 (图 5)。
2.5.2 盐胁迫对水稻SOD、POD和CAT活性的影响
盐胁迫处理前野生型和转基因水稻SOD酶活性无显著差异。随着NaCl浓度的增加,野生型和转基因水稻SOD酶活性在盐胁迫下显着增加。在200 mmol/L NaCl胁迫下,转基因水稻株系L2和L3的SOD酶活性分别是野生型水稻的1.95和1.75倍,说明盐胁迫可以提高转基因水稻SOD酶活性,加强了对活性氧的清除,降低对植物体的伤害(图6)。盐胁迫处理前野生型和转基因水稻POD酶活性无显著差异。随着NaCl浓度的增加,野生型和转基因水稻的POD活性迅速增加,并在100 mmol/L NaCl胁迫下达到最大值,然后降低。然而,转基因水稻和野生型水稻之间的POD活性没有显着差异(图6)。
盐胁迫处理前野生型和转基因水稻的CAT酶活性没有显著差异。不同浓度NaCl处理后,转基因水稻CAT活性迅速增加,并在100 mmol/L NaCl胁迫下达到最大值。转基因水稻株系L2的CAT酶活性从35.55上升至71.95 U/mg, FW,上升了1.02倍,L3的由40.91上升至68.18 U/mg, FW,上升了66.7%。然而,野生型水稻的CAT酶活性在不同的盐胁迫下没有显著变化(图6)。
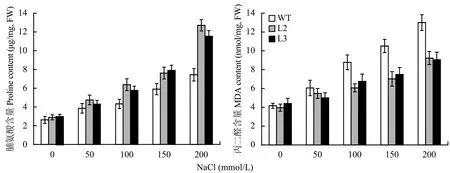
图 5 盐胁迫对转基因水稻脯氨酸和丙二醛含量的影响Fig. 5 Effects of salt stress on proline and MDA content in the transgenic rice
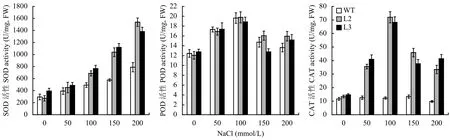
图 6 不同浓度盐胁迫转基因水稻中SOD、POD和CAT的活性Fig. 6 Activities of SOD, POD and CAT in the transgenic rice under different salt stress concentrations
2.6 盐胁迫对水稻胁迫相关基因表达的影响
为了揭示转基因型水稻的耐盐分子机制,采用实时荧光定量PCR分析在200 mmol/L的盐胁迫下5个胁迫相关基因的表达模式。这5个胁迫相关基因分别是脯氨酸合成关键酶基因(OsP5CS1)、活性氧解毒酶基因(OsSOD、OsPOX1和OsCATB)以及逆境响应蛋白(OsLEA3)。结果表明,与野生型水稻相比,OsP5CS1、OsCATB、OsSOD和OsLEA3在转基因水稻中的表达倍数显著增加,而OsPOX1的表达倍数没有明显变化(图7)。

图 7 野生型(WT)和转基因水稻株系(L2,L3)叶片胁迫应答基因在正常和盐胁迫(200 mmol/L NaCl)下表达的实时定量PCR分析Fig. 7 Quantitative real-time PCR analysis of stress responsive genes expression in the leaves of WT and transgenic plants (L2, L3) grown under H2O and stress of 200 mmol/L NaCl
3 讨论与结论
土壤盐渍化是影响植物生长发育和农作物产量的最重要的环境因子之一,通过基因工程改善作物的耐盐性已受到广泛关注[12]。过量表达TsIPK2可以增加转基因油菜和大豆的耐盐胁迫能力[9,11]。因此笔者认为盐芥肌醇多磷酸激酶的表达可能赋予农作物的耐胁迫能力。
在本研究中,将TsIPK2基因转入水稻,TsIPK2在胁迫下的表达模式类似于在盐芥中的表达,TsIPK2mRNA在盐处理1 h后累积,在胁迫3 h后表达量达到最大值,6 h后降低,表明在水稻中TsIPK2的表达受高盐诱导(图2)。正常生长环境条件下,TsIPK2过表达对转基因水稻植株无显著影响,在150 mmol/L NaCl的处理下,转基因株系的发芽率均在60%以上,而野生型的发芽率在30%左右;在200 mmol/L NaCl处理下,转基因水稻L2和L3株系的平均芽长比野生型分别高出8.2%和11.6%(图3),说明转基因水稻具有较好的耐胁迫能力。
非生物胁迫引起植物叶片或根部细胞膜脂不饱和脂肪酸的过氧化作用,导致细胞膜透性的增加和抗氧化酶活性降低[13],膜脂过氧化产物MDA含量的变化可以反映细胞膜系统的损伤程度[14]。在本研究中,随着NaCl处理浓度的增加,野生型和转基因水稻植株叶片MDA含量都有所增加,在200 mmol/L NaCl浓度下,野生型水稻的MDA含量增加了2.12倍,而转基因水稻L2和L3的MDA含量分别增加了1.33和1.05倍,转基因水稻体内MDA含量在盐胁迫下的积累量明显低于野生型植株(图5),说明转TsIPK2基因水稻的膜脂过氧化程度较弱,细胞膜损伤较小。非生物胁迫如干旱、高温、冷害和盐碱等可诱发植物组织细胞内产生过量的活性氧(reactive oxygen species, ROS),但过多ROS的产生会导致植物细胞的死亡,因此植物建立抗氧化保护系统应对胁迫下ROS的过多积累[15]。超氧化物歧化酶(SOD)通过Harber-weiss循环催化歧化成O2和H2O2,产生的H2O2主要由过氧化氢酶(CAT)与过氧化物酶(POD)清除[16]。本研究中,野生型和转基因水稻的POD酶活性在盐胁迫下迅速增加,并在100 mmol/L NaCl胁迫下达到最大值,但转基因水稻和野生型水稻中POD酶活性无显著差异;在200 mmol/L NaCl胁迫下,转基因水稻L2和L3的SOD酶活性分别是野生型的1.95和1.75倍;在100 mmol/L NaCl胁迫下转基因水稻L2和L3的CAT酶活性达到最大值,转基因水稻L2和L3分别上升了1.02倍和66.7%,但野生型水稻的CAT活性没有明显变化(图6)。胁迫产生的自由基在SOD和CAT两者协调作用下维持在较低水平,从而减少膜的损伤,提高转基因植株的耐逆性。
植物在受到非生物胁迫后通过调节逆境响应基因的表达,形成植物抗逆的分子机制,从而抵御非生物胁迫的影响[17]。本研究发现,在200 mmol/L的NaCl胁迫下转基因水稻的活性氧解毒酶基因(OsCATB和OsSOD)的表达倍数显著增加,与体内检测到的抗氧化酶活性的结果一致(图6、图7)。在干旱、盐渍等胁迫条件下,大量的游离脯氨酸作为细胞质渗透调节物质在植物中积累。OsP5CS1是脯氨酸合成的关键限速酶,OsP5CS1的表达受高盐、干旱、冷胁迫和ABA处理的诱导,而不受热处理诱导,在高盐条件下,耐盐品种中OsP5CS1的表达量比盐敏感品种中的表达量高,从而积累更多的脯氨酸提高耐盐性[18-20]。本研究表明,随着盐浓度的增加,野生型和转基因水稻植株叶片脯氨酸含量增加,在200 mmol/L NaCl浓度下,转基因株系L2和L3中脯氨酸的含量分别是野生型植株的1.71和1.55倍(图5),同时转基因水稻株系中OsP5CS1的表达量显著高于野生型水稻(图7),暗示转入的TsIPK2基因在维持细胞内外的渗透平衡中发挥了一定作用。OsLEA3属于LEA蛋白基因家族, 在逆境条件下能够保护生物大分子及膜结构, 干旱、盐和脱落酸等胁迫可诱导OsLEA3的表达[21],转TsIPK2基因水稻OsLEA3基因的表达量显著增加有助于减轻因盐胁迫脱水引起的离子强度增大对生物膜和功能蛋白的毒害,提高转基因水稻的耐盐性(图7)。本研究结果证明TsIPK2基因可以影响转基因水稻的胁迫耐受能力,有望通过转基因技术提高该基因表达水平进而增强植物耐盐能力。
