1株雏鸡致病性肺炎克雷伯菌分离鉴定与系统进化发育分析
2019-06-17
(河北科技师范学院动物科技学院 河北省预防兽医学重点实验室,河北秦皇岛 066604)
肺炎克雷伯菌是肠杆菌科克雷伯菌属的一种革兰阴性杆菌,该菌无鞭毛,无动力,有较厚的荚膜,个别菌株具有菌毛结构,主要存在人和多种动物肠道、呼吸道、泌尿生殖道内,为临床中典型的人兽共患条件性致病菌[1-2]。肺炎克雷伯菌属包括肺炎克雷伯肺炎亚种、臭鼻亚种及鼻硬结亚种3 个亚种,其中肺炎克雷伯肺炎亚种分布最为广泛,是引发鸡、鸭、山羊、梅花鹿、牛等多种动物及人肺炎、腹泻、泌尿道、胆道感染、败血症和化脓性脑膜炎等严重疾病的病原菌之一[3-4]。当鸡感染肺炎克雷伯菌后,可以引起鸡的伤口感染、肺炎、肝脓肿、眼內炎甚至全身败血症等,对不同日龄的鸡均易感,尤其是雏鸡的发病率与死亡率都较高[5-6]。肺炎克雷伯菌可能对养业鸡具有潜在威胁,应引起重视。国内关于鸡源肺炎克雷伯菌报道较少。本试验从发病致死的雏鸡体内分离1 株肺炎克雷伯菌,并对该菌的16S rRNA 基因序列进行同源性,致病性检测及耐药性分析,为临床中该菌的防控提供参考依据。
1 材料与方法
1.1 病料来源 秦皇岛地区某鸡场9 日龄病死的雏鸡,无菌采集发病致死雏鸡的肝脏、心血等病料组织。
1.2 主要试剂与仪器MIAC 培养基、营养肉汤,购自北京陆桥生物技术股份有限公司;革兰染色液试剂盒,购自青岛高科园海博生物技术有限公司;药敏纸片,购自北京天坛药物生物技术开发公司;ID32E 肠杆科菌鉴定试纸条,购自Bio-Merieuxsa 公司;DL-2 000 Marker,购自北京中生瑞泰科技有限公司;2 ×TaqMarker Mix,购自北京康为世纪生物科技有限公司;7%脱纤绵羊血培养基由本实验自制;梯度PCR 由仪德国Eppendorf 公司生产;隔水式恒温培养箱,购自上海一恒科学仪器有限公司;ATB 自动化微生物生化鉴定系统由法国生物梅里埃股份有限公司生产。
1.3 试验动物 健康9 日龄海兰褐雏鸡10 只,购自秦皇岛市金牧种鸡场。
1.4 细菌分离培养与鉴定 无菌采集病死雏鸡肝脏、心血等病料组织划线接种于7%绵羊脱纤血培养基,37 ℃恒温培养12 -18 h,挑取优势单个菌落接种于MIAC 鉴别培养基上37 ℃恒温培养12 -18 h。挑取单个菌落落接种于营养肉汤中进行纯化培养,革兰染色后在显微镜下观察分离菌株形态。
1.5 生化试验鉴定 取纯化培养的分离菌调整菌液浓度为0.5 个麦氏浊度,按照说明书,将分离菌株接种于ID32E 肠杆科菌鉴定试纸条中,37 ℃恒温过夜培养12 -24 h,用ATB 自动化微生物生化鉴定系统进行生化特性鉴定。
1.6 细菌的16S rRNA PCR 鉴定及测序分析 用水煮法提取分离菌株的基因组DNA,用细菌通用引物16S rRNA 基因序列进行检测。细菌通用16S rRNA 基因序列引物5′-CCGTCTTCAGTTCCAGTGTG-3′/5′-GTGGCGGACGGGTGAGTAA-3′由生工生物工程(上海)股份有限公司合成。PCR 扩增反应体系为50 μL:2 ×TaqMix 25 μL,上、下游引物各2 μL,DNA 模板3 μL,ddH2O 18 μL。反应条件:94 ℃预变性5 min,94 ℃变性50 s,58 ℃退火45 s,72 ℃延伸1 min,30 个循环,72 ℃延伸10 min。用1%琼脂糖凝胶进行检测分离菌株的目的条带,将PCR 产物送生工生物工程(上海)股份有限公司进行序列测定,测序结果与Gen-Bank 数据库中登录基因序列进行对比分析,构建系统进化树,分析其同源性。
1.7 致病性试验 将10 只9 日龄健康雏鸡分为2组,每组5 只,试验组每只雏鸡腹腔注射0.25 mL(108CFU/mL),对照组每只雏鸡给予等量的生理盐水,攻毒12 h 后,观察7 d,记录每组的发病情况和死亡情况。
1.8 药敏试验 参照美国临床实验室标准化协会(CLSI)推荐的标准K-B 纸片法进行试验操作和结果判断。
2 结果
2.1 细菌分离培养 分离菌株在7%脱纤绵羊血培养基上长出扁平、圆形、灰白色的半透明菌落(见中插彩版图1);在鉴别MIAC 培养基上为圆形、光滑、大小一致的桃红色菌落(见中插彩版图2);革兰染色镜检为两端钝圆粗短杆菌状的阴性菌(见中插彩版图3)。

图1 7%脱纤绵羊血培养基上的菌落

图2 MIAC 培养基上的菌落
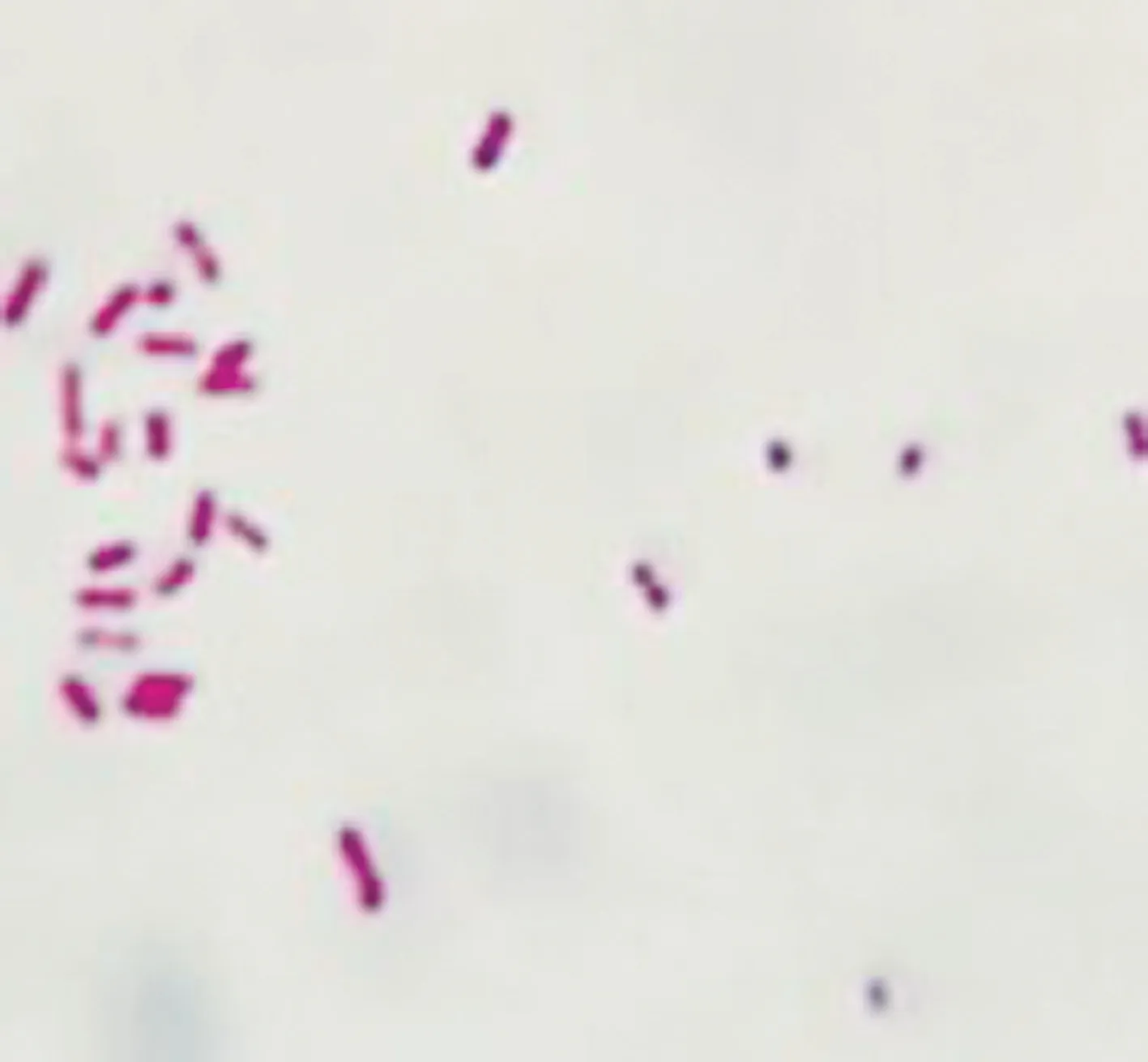
图3 革兰染色结果 (1 000 ×)
2.2 生化鉴定结果 分离菌株甲基红试验、V-P 试验均呈阳性;不产生H2S;L-阿拉伯醇、精氨酸双水解酶、鸟氨酸脱羧酶、接触酶、尿素酶为阴性;不发酵D-麦芽糖、D-葡萄糖、D-纤维二糖、D-海藻糖、L-阿拉伯糖、D-甘露醇、D-山梨醇、L-鼠李糖等;用ATB自动化微生物生化鉴定系统鉴定为肺炎克雷伯菌,评定结果合格率为99.9%。
2.3 细菌的16S rRNA 测序结果与系统进化树分析 分离菌株用细菌的16S rRNA 的通用引物,扩增出1 492 bp 的目的条带(图4);其测序结果与GenBank 登录的肺炎克雷伯菌参考株基因序列同源性在98%~99%之间,从而证实了分离菌株为肺炎克雷伯菌;系统进化树结果表明:分离菌株HB-3 与肺炎克雷伯杆菌参考株KP262416.1 聚于一支,与KJ803938.1 聚于一大支,本试验分离的肺炎克雷伯菌HB-3 株与肺炎克雷伯菌参考株KP262416.1 和KJ803938.1 存在密切的遗传进化关系(图5)。
2.4 致病性试验结果 试验组雏鸡攻毒12 -48 h 后,雏鸡死亡2 只,至96 h 雏鸡全部死亡。剖检死亡雏鸡,无菌采集发病致死雏鸡的肝脏、心血等病料组织,从中分离到了肺炎克雷伯菌,对照组的雏鸡无明显症状。表明了从病死雏鸡的体内分离到的肺炎克雷伯菌具有很强的致病性。
2.5 药敏试验 结果见表1,分离菌株对头孢曲松、头孢克肟、头孢拉啶、恩诺沙星4 种药物敏感;对环丙沙星、新霉素、丁胺卡那霉素、氟苯尼考、大观霉素、林可霉素6 种药物中敏;对氨苄西林、阿莫西林、青霉素、庆大霉素、多西环素、多粘菌素6 种药物耐药。
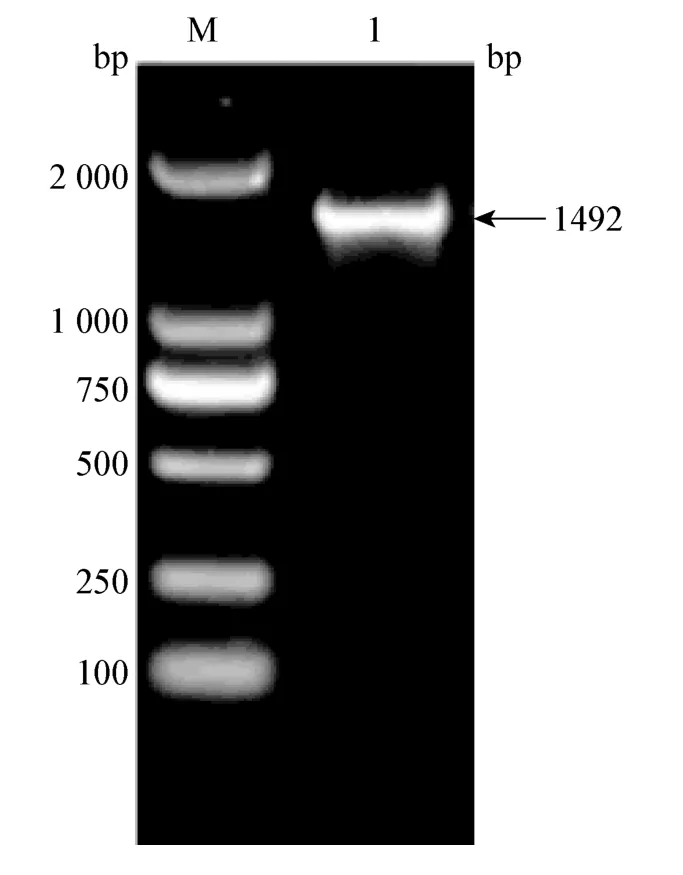
图4 分离菌株16S rRNA PCR 扩增结果

图5 分离菌株16S rRNA 基因序列进化树发育树

表1 药敏试验结果
3 讨论
肺炎克雷伯菌是一种重要的人兽共患病原菌,该菌在临床中的感染率仅次于大肠杆菌和绿脓杆菌,广泛存在于人和动物的肠道、呼吸道和泌尿生殖道及水、土壤等环境中的一种常见条件性致病菌,呈世界性分布,该菌可以导致动物体内的菌群失调,引起不同种类的动物感染发病,严重者造成死亡[7-8]。本试验从发病致死的雏鸡体内分离到了1 株致病性性肺炎克雷伯菌,该菌的16S rRNA 基因序列与GenBank 登录的12 株肺炎克雷伯菌参考株同源性在98%~99%之间,与肺炎克雷伯杆菌参考株KP262416.1 聚于一支,与KJ803938.1 聚于一大支,且2 株参考株存在密切的遗传进化关系。该菌的遗传进化是否与其他宿主源及人的肺炎克雷伯菌存在遗传进化有待进一步研究。贾艳等[9]报道了从病死鸡体内分离5 株鸡源肺炎克雷伯菌,该菌对小鼠具有很强的致病性。金天明[10]报道了从死亡的肉雏鸡体内分离到肺炎克雷伯菌是致病性肺炎克雷伯菌。当外界条件改变时,如饲养密度过大、气候骤变、卫生条件差等应激因素存在时,常常引发该病的暴发与流行[6]。因此,在雏鸡养殖的过程中应引起重视,加强饲养管理,减少环境中的应激。
目前,对细菌性疾病主要依靠抗菌药物进行控制,由于不合理的使用,导致了病原菌对药物耐药性的产生与扩散,多重耐药菌株出现的越来越多,降低了治疗效果,其中肺炎克雷伯菌对抗菌药物产生很强的耐药性[11]。本试验药敏试验表明,分离菌株对头孢曲松、头孢克肟、头孢拉啶、恩诺沙星4 种药物敏感;对环丙沙星、新霉素、丁胺卡那霉素、氟苯尼考、大观霉素、林可霉素6 种药物中敏;对氨苄西林、阿莫西林、青霉素、庆大霉素、多西环素、多粘菌素6 种药物耐药。因此,在养殖过程中,当鸡发生肺炎克雷伯菌病时,应进行药敏试验分析其耐药性,合理使用药物,减少耐药性产生,提高治疗疗效。
