酒精性肝病与肠道微生态的研究进展
2019-06-14杨雅,艾国,王鸣
杨 雅, 艾 国, 王 鸣
杨雅, 王鸣, 华中科技大学同济医学院附属同济医院感染科 湖北省武汉市 430030
艾国, 华中科技大学同济医学院附属同济医院儿科 湖北省武汉市430030
核心提要: 慢性酒精摄入可通过多种方式引起肠道微生态失衡, 进而激活机体免疫应答, 诱导肝脏产生炎性反应而造成肝损伤.目前, 临床上可通过补充益生菌或益生元、合理应用抗生素及粪菌移植等方式调节肠道菌群失调, 从而达到治疗酒精性肝病的目的.
0 引言
酒精性肝病(alcoholic liver disease, ALD)是我国最主要的慢性肝病之一, 在我国有日见增多的趋势, 在肝病住院患者中, 其所占比例不断上升, 严重危害人民健康[1].肠-肝轴将肠道与肝脏紧密联系在一起, 两者起源于同一胚层, 通过门静脉相互关联, 肝脏吸收的大部分物质来自肠道, 肠道通过门静脉为肝脏提供大量肠源性物质包括细菌及其代谢产物等. 研究发现, 肠道微生态失衡在ALD的发生机制中发挥了重要作用. 本文就国内外关于ALD与肠道微生态失调相互作用的机制及通过调节肠道菌群失调治疗ALD的进展进行综述, 为ALD的临床治疗提供理论参考.
1 慢性酒精摄入导致肠道微生态失衡的表现及机制
1.1 慢性酒精摄入导致肠道微生态失衡表现 肠道微生态平衡是指肠道内各类微生物在数量和种属上保持动态平衡[2], 其对维系人体正常代谢及消化功能发挥着重要作用. 人类很多疾病如肥胖、胰岛素抵抗、代谢综合征、非酒精性脂肪肝、肿瘤、慢性感染性疾病等都和肠道微生态失衡息息相关. 动物实验已经证实, 酒精能选择性的促进肠道细菌的生长, 而致病菌的过度生长又能产生乙醇从而影响肠黏膜渗透性, 导致肠道微生态失衡[3]. 酒精导致肠道微生态失衡主要表现为: (1)肠道细菌增多长期饮酒导致肠道内细菌数量增多、肠道微生态失衡[4-7]. 肠道细菌过度生长主要通过PCR技术或粪便培养等方法证实其数量增多. 一般认为每毫升粪便经培养包括至少105数量级的细菌为细菌过度生长[8-10]. Yan等[7]在2011年对两组小鼠展开实验, 分别给予这两组小鼠喂食同等热量食物(其中一组饮食中包括酒精), 发现喂食酒精组小鼠小肠内需氧菌和厌氧菌数量较另一组小鼠明显增多, 随后一周左右大肠细菌明显增多[6], 其他齿类动物肝病终末期也能观察到这种现象[11,12]. 与此类似的是, 长期饮酒的肝硬化患者也表现为小肠细菌明显增多[13,14], 而此种现象与酒精性肝硬化患者的病情密切相关[13]. (2)肠道菌群菌种变化Bajaj等[15]在2014年提出CDR(肝硬化-微生态失调比值)的概念, 用以反映肝硬化患者肠道内“好”细菌与“坏”细菌的丰度变化情况, 该比值为肠道内“好”细菌如螺菌属细菌、疣微菌属细菌、梭杆菌属细菌的数量之和与肠道内“坏”细菌如肠杆菌属细菌、类杆菌属细菌的数量之和的比值. CDR值越低, 肝硬化患者病情越重. 研究发现, 酒精性肝硬化患者肠道内螺菌属细菌[15-17]、疣微菌属细菌[15,16,18]、梭杆菌属细菌[15,16]数量减低, 而肠杆菌属细菌[15-18]数量增多, 类杆菌属细菌在肝硬化患者中表现为增多的趋势[15,18]. 但另有研究表明, 在肝硬化患者特别是酒精性肝硬化患者中, 肠道内肠杆菌属细菌数量减少[17,19,20]. 不同病因所致的肝硬化患者的CDR值不同, 其中, 酒精引起的肝硬化患者的CDR值最低, 这些ALD患者体内内毒素水平较其他原因所致者更高, 大肠杆菌数量也更多[15]. 予以肝硬化患者口服乳杆菌GG治疗四周, 结果发现患者肠道内螺菌属细菌、梭杆菌属细菌数量增多, 肠杆菌属细菌数量减少, 体内内毒素水平及肿瘤坏死因子水平降低[21]. 肝硬化患者粪便及结肠活检标本中梭状芽孢杆菌[22,23]、肠杆菌属细菌[15]及其所属的大肠杆菌[17,22,23]数量明显增多. 分析酗酒者及肝硬化患者粪便发现, 梭杆菌属细菌[16,17]、葡萄球菌属细菌[15]及其产生的金黄色葡萄球菌[24]数量较对照组增多, 肠道内“好”细菌如乳酸杆菌[25]、粪便中双歧杆菌[23,25]数量减少. 综上, 长期大量饮酒的患者体内“好”细菌数量减少、“坏”细菌数量增多往往引起肠道微生态失衡.
1.2 慢性酒精摄入导致肠道微生态失衡机制 研究表明,多种因素均可导致ALD的发生和发展. 酒精及其代谢产物乙醛通过门静脉进入肝脏可直接造成肝细胞的损害,同时肠源性有害物质如脂多糖水平升高, 通过与Toll样受体4(toll-like receptor 4, TLR4)结合激活Kupffer细胞[26],产生活性氧, 继而产生大量黏附分子、炎性细胞因子和趋化因子, 在肝脏产生炎性反应造成肝损害[27-34]. 酒精导致肠道微生态失衡机制包括(图1): (1)肠道黏膜屏障功能受损 肠道黏膜的完整性取决于肠上皮细胞表面覆盖的保护层、肠上皮细胞之间的紧密连接蛋白及肠道免疫细胞的功能状态[35]. 酒精既能通过自身对肠上皮细胞的损伤作用破坏肠黏膜屏障, 又能通过其分布在血液中的代谢产物破坏肠黏膜屏障[36]. 体循环中酒精浓度升高通过引起紧密连接蛋白调控相关蛋白的mRNA表达下调, 导致紧密连接蛋白表达下调, 另外长期摄入酒精还能增加肠上皮细胞对致病菌的易感性[37]. (2)基因, 大部分脂肪肝患者会因长期大量饮酒使得病情进一步加重, 酗酒者中高达40%-60%的人群伴有肝纤维化甚至肝硬化[38]. 有研究表明遗传因素与ALD病情进展相关. 女性比男性更容易罹患酒精引起的肝脏相关疾病[39]. 细胞色素P4502E1(CYP2E1)和酒精脱氢酶-3(ADH-3)基因多态性为酗酒者发展为ALD的危险因素[40]. Patatin样磷脂酶3(PNPLA3)基因多态性同样也是发展为酒精性肝硬化的危险因素[41]. 至于基因多态性是否通过影响肠道微生物的组成成分从而导致ALD的发生目前还不明确, 但宿主基因一般能通过影响代谢对肠道微生物的组成产生一定影响[42]. 目前还需要更多的研究来阐明基因对微生物及ALD的作用及影响. (3)肠道动力因素 酒精减低肠道蠕动功能, 导致肠腔细菌增多. 饮酒者结肠转运时间比不饮酒者更长[43]. 肝硬化患者结肠转运时间比正常有所延长, 造成肠道细菌的过度生长[44]. 胃肠动力药西沙比利通过改善胃肠蠕动功能可改善肝硬化患者肠道细菌的过度生长[45]. (4)胃酸分泌减少ALD患者表现为胃酸减少或者呈现胃酸分泌不足的状态, 这可能与患者多伴有浅表性胃炎或萎缩性胃炎有关[46,47]. Shindo等[48]研究发现, 在肝硬化患者中, 胃酸分泌减少与小肠细菌过度生长相关. (5)胆汁酸分泌减少ALD患者粪便中总胆汁酸水平较高, 然而, 一旦这些患者病情进展至肝硬化阶段, 其粪便中总胆汁酸水平明显下降[19], 这可能是肝硬化患者的胆汁通过肠肝循环途径被吸收致肠道减少所致[49]. Inagaki在小鼠模型研究中发现法尼醇X受体(FXR)(肠道上皮细胞主要的胆汁酸受体之一)减少, 导致多种抗生素疗效欠佳, 这与小肠细菌过度生长不无关系[50], 而予以肝硬化小鼠补充胆汁酸能消除小肠细菌过度生长的情况[51]. 因此, 肝硬化伴胆汁酸分泌减少可导致肠道微生物数量发生改变. (6)免疫应答异常, 长期饮酒对人体免疫系统造成深远的影响. 宿主抗菌分子是人体肠道固有免疫系统的主要效应分子, 对肠道微生物的组成成分起着决定性的作用. 肠道潘氏细胞和肠上皮细胞能分泌多种抗菌分子抑制细菌进入肠道上皮, 胰再生凝集素Reg-3b和Reg-3g是其中两种. Yan等[7]研究发现,在喂食酒精的小鼠及ALD人群中, 这两种抗菌分子的表达均受到抑制. 而作为肠道保护层的肠道黏膜, 其在ALD患者体内是增厚的[6]. 酒精是通过何种机制对宿主免疫系统产生影响还需要进一步的研究.
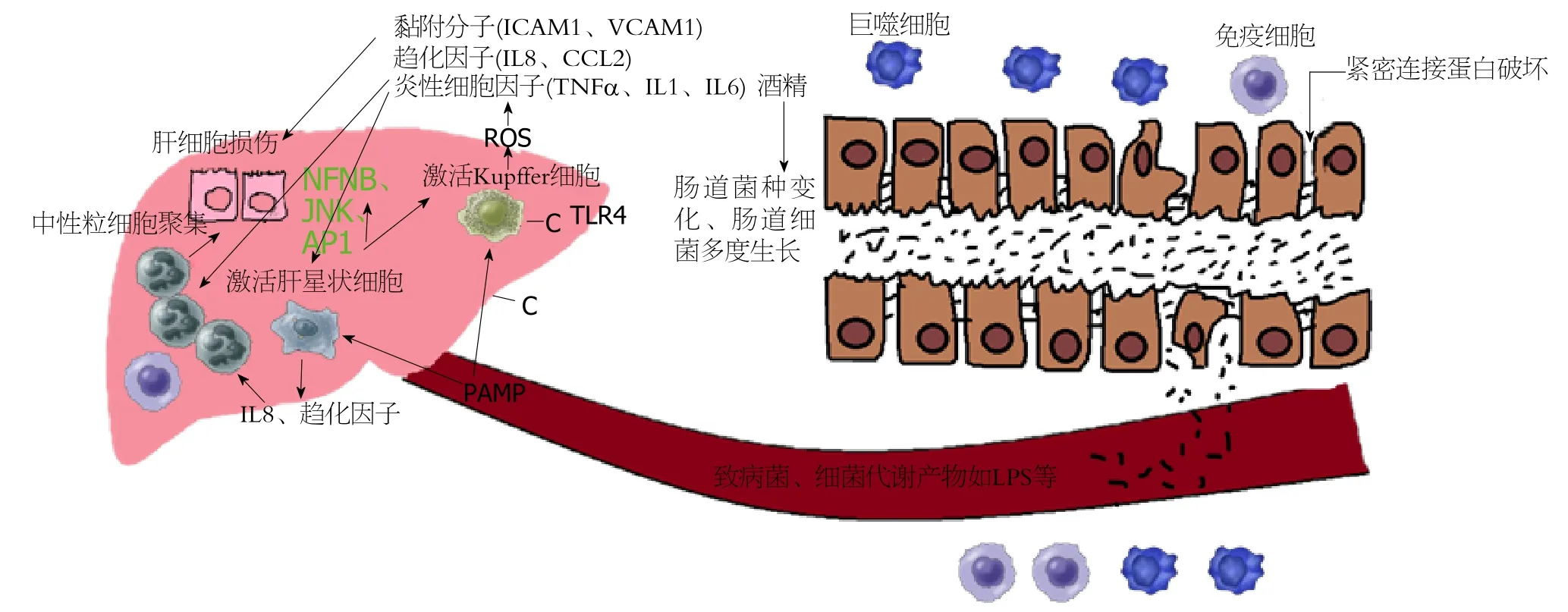
图1 酒精性肝病与肠道微生态失衡相互作用的机制.
2 肠道微生态失调促进ALD发生发展
2.1 肠道微生态失衡造成体内免疫、代谢的改变 人体肠道内微生物数以亿计, 包括细菌、病毒、真菌等. 细菌虽然数量众多, 但其在分类上主要包括拟杆菌、厚壁菌和放线菌[52]. 影响人体内微生物组成结构的因素很多, 包括饮食、年龄及是否伴发疾病等. 肠道微生物对人体先天性和获得性免疫的调节发挥非常重要的作用, 肝脏作为消化器官之一, 各种营养物质的有序合成和分解如葡萄糖的代谢、胆汁酸的代谢、短链脂肪酸的分泌、维生素的合成等均与肠道菌群功能正常有着密切联系, 其中短链脂肪酸为肠黏膜上皮细胞重要能量来源, 其正常代谢有助于保持肠道完整性, 加强肠黏膜屏障功能. 肝脏亦为重要的免疫器官, 来源于肠道的致病菌、病原体相关分子模式(包括模式识别受体如TLRs、Nod样受体、解旋酶受体等)等进入体循环后,肝脏为首要受累的器官, 因而肠道微生物组成结构的改变势必会对肝脏造成影响[52].
2.2 肠道有害物进入肝脏造成肝损害 肠道微生态失调致使肠道细菌及其有害代谢产物随门脉循环进入肝脏, 导致ALD患者体内内毒素水平升高[53,54]. 细菌脂多糖(LPS)作为内毒素的一种, 与脂多糖结合蛋白形成复合物, 该复合物与CD14嵌合后通过与TLR4结合激活丝裂原蛋白激酶如胞外信号调节激酶(ERK-1/ERK-2)、JNK、p38、NFKB和活化蛋白1(AP-1), 继而激活Kupffer细胞[55]. Kupffer细胞被激活后释放活性氧(ROS),使黏附分子如细胞间黏附分子1(ICAM1)、血管黏附蛋白1(VCAM1)、趋化因子(IL-8、CCL2)、炎性细胞因子(TNF-α、IL-1、IL-6)在肝脏聚集[56], 促炎细胞因子如IL-17诱使中性粒细胞进入肝脏, 刺激肝星状细胞产生IL-8和趋化因子CXCL1, 从而诱导其他趋化因子召集更多中性粒细胞聚集[57], 这一系列改变均可导致肝细胞炎性改变并造成肝损伤(图1).
3 ALD基于肠道微生态失衡的治疗方法
3.1 戒酒 众所周知, 乙醇可引起肠黏膜功能障碍, 导致肠道渗透性升高引起营养物质流失、肠道有害代谢物进入体循环, 因此凡能阻止肠道渗透性升高的干预措施都不失为ALD的有效治疗方法. 例如, 乙醇可通过引起机体缺锌从而损伤肠黏膜屏障功能[58], 给予体内缺锌的小鼠补充锌剂能恢复其肠道功能[59]. 尽管饮酒所致的部分肠道微生态损害无法逆转, 如饮酒造成普氏粪杆菌的减少(重要的肠道菌群共生菌), 但戒酒对恢复肠道微生态平衡却是极为重要的.
3.2 益生菌 最近一项研究评估了VSL3治疗长期喂食酒精导致肠道微生态失衡的小鼠的疗效, 发现在喂食VSL3一段时间后, 小鼠的肠道渗透性有所改善, 同时肠道内细菌过多的现象也有所好转[60,61]. 在另一项研究中,对长期喂食酒精的小鼠予以乳酸杆菌治疗后, 小鼠粪便pH值和血清内毒素水平均降低, 肝损害也有所改善, 这些都得益于乳酸杆菌能通过紧密连接蛋白改善肠黏膜渗透性[62]. 乳酸杆菌还能改善肠道屏障功能, 使高脂饮食的小鼠免受非酒精性脂肪肝的损害[63]. Cicenia等[64]和Hartmann等[65]的研究均发现, 有活性的益生菌能促进体内其他有益菌的生长. 予以酗酒者口服乳酸杆菌和双歧杆菌一段时间后, 其肠道内乳酸杆菌和双歧杆菌数量升高, 金黄色葡萄球菌及梭状芽胞杆菌数量减少, 同时转氨酶也有所下降[24,25].
3.3 抗生素 合理使用抗生素作为预防和干预措施, 能改善肠道菌群失调, 减轻其对肝脏的损害[66,67]. 研究证实,广谱抗生素利福昔明能减少酒精性肝硬化患者肠腔内韦荣球菌属细菌, 改善肠道固有菌群的代谢, 减少肠道有害微生物产生的有毒代谢产物及降低体循环中的炎性因子, 改善胆汁酸肠肝循环, 使肠道内初级胆汁酸和次级胆汁酸增多[68,69], 还能减低CDR比值, 提高“好”细菌的数量[69].
3.4 粪菌移植 粪便菌群(fecal microbiota transplantation,FMT)移植是一种将健康志愿者的粪便菌群移植给患者, 以重建正常肠道菌群的治疗方法[70]. FMT最早可追溯到东晋时期, 葛洪在《肘后备急方》记载了用粪液治疗食物中毒及腹泻患者的方法[71]. 1950年, Eiseman将粪便菌群移植疗法成功用于伪膜性肠炎的治疗[72]. 目前,通过FMT已经成功治愈了多种与肠道菌群紊乱相关的疾病[73], 尤其是对于艰难梭菌感染的治疗成功率可达90%[74]. 最近发表的一份研究共识阐述了FMT对于复发性梭状芽胞杆菌感染、炎症性肠病、肠易激综合征和代谢综合征的治疗, 尽管该共识对于FMT在肝病方面的领域尚未提及, 但FMT仍能在肠道菌群失调、有感染风险的肝病患者中应用[75].
3.5 合理膳食 长期饮酒的患者往往伴随着营养元素的缺乏, 因此合理膳食对ALD患者十分必要. 已有研究证实长期饮酒会造成体内锌的缺乏, 且锌的缺乏会进一步加重肝损伤, 并使肠黏膜渗透性升高[76]. 饮食中缺锌会造成酒精导致的血清内毒素水平升高, 引起肝损害及肝脏炎性改变[59]. 一项小鼠ALD的动物模型的研究发现,牛奶的一种组成成分-牛奶骨桥蛋白能减轻ALD所致的肝损伤, 降低血清内毒素水平[77]. 另有研究发现, 高脂、高糖饮食不利于健康, 高脂饮食组的小鼠与对照组小鼠相比, 体循环中脂多糖水平较高, 同时甘油三酯水平也高于对照组. 饮食中摄入糖分过多抑制β脂肪酸的氧化,导致肝细胞脂肪变, 通过TLR通道释放炎性因子激活炎性反应, 且高糖饮食降低胰岛素敏感性[69,78].
3.6 靶向治疗 未来治疗的靶点可致力于研究抗脂多糖抗体或TLR4抑制剂, 从而阻断肠源性炎性因子对肝脏的损害. 另一个新的领域可能为miR155抑制剂, 有研究发现酒精致肠道渗透性升高、体内内毒素及炎性因子水平升高的情况在miR155缺失的小鼠中有所缓解[79].
4 结论
长期摄入酒精导致肠道菌群失调, 引起肠黏膜屏障功能受损, 导致肠黏膜渗透性升高, 继而导致肠道微生物及其代谢产物随着门脉系统进入体循环, 诱导肝脏炎性反应, 引起肝损伤. 近年来, 肠道微生态的研究逐渐形成热点, 越来越多的研究证实肠道微生态失衡与ALD的发生发展有着密切的联系, 益生菌或益生元的使用、粪菌移植、合理应用抗生素等均能在一定程度上改善ALD, 但目前以肠道微生态失调为治疗靶点的研究较少, 还需要更多研究工作进一步探索.
