AEEA-MDEA-MOR复合醇胺吸收烟气CO2反应热研究
2019-06-13李建强
李建强
((东营职业学院,山东 东营 257091))
醇胺溶液是工业上应用最广泛的脱除酸性气体(CO2、H2S)的吸收剂,Astarita等[1]着手对此吸收过程进行热力学等方面的研究。有文献表明[2],醇胺吸收CO2反应热与溶剂的吸收能力直接相关,反应热越高,吸收能力越强;反应热越小,吸收能力越弱。因此,一个工业上能够使用的捕集溶剂,需要进行吸收反应热的详细测定和研究。
同时,反应热数据对于脱除CO2的操作单元的设计至关重要,因为它直接决定了溶剂再生过程中所需的蒸汽热量以及反应中CO2的平衡[3]。同时,再生过程蒸汽消耗的热量在装置总能耗所占的比例超过50%,因此,需要对CO2反应热进行精确的测定。但是,国内在这方面的研究较少,还需要对不同的复配试剂的反应热进行更全面的测试和分析,建立反应热数据库。
本文以AEEA-MDEA-MOR三元复合溶液为对象,进行了复合醇胺溶液反应热研究,以指导其在以后在工业上的应用。
1 吸收剂与反应原理
1.1 吸收剂物理性质
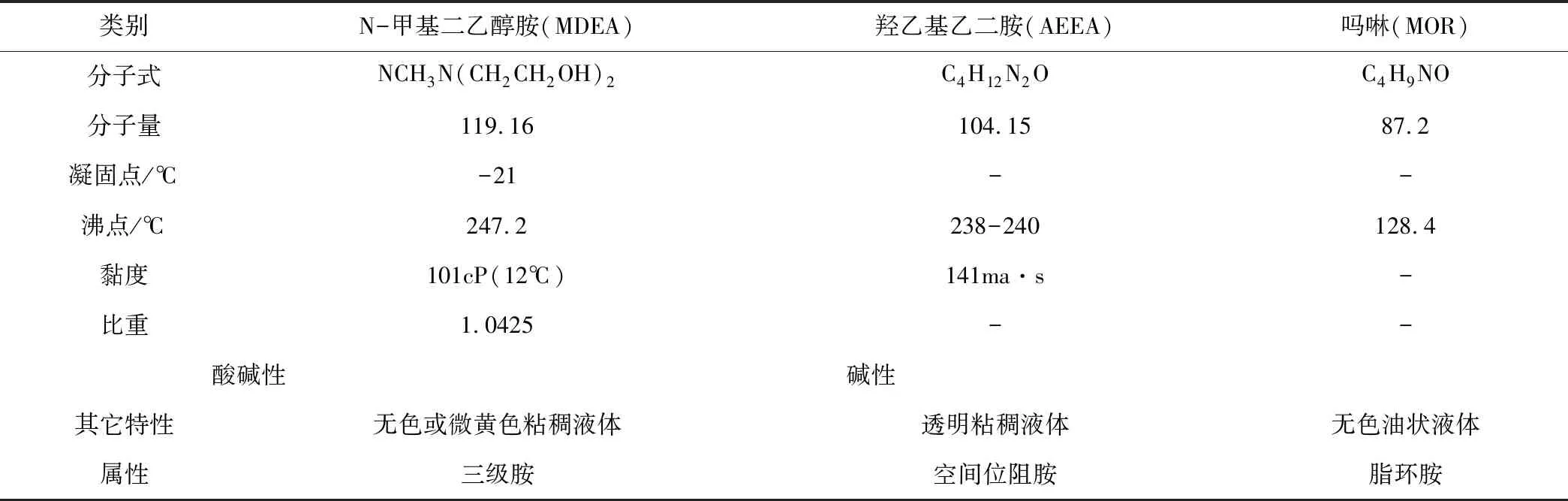
表1 醇胺物理性质
1.2 反应原理
Caplow[4]和Danckwerts[5]等分别描述了伯胺和仲胺溶液吸收CO2的化学反应过程。一级或二级胺RR′NH(其中R′是氢原子或烷基)与CO2直接反应形成中间两性离子:
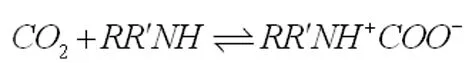
随后,两性离子的中间氢原子附在胺上发生反应形成氨基甲酸酯:
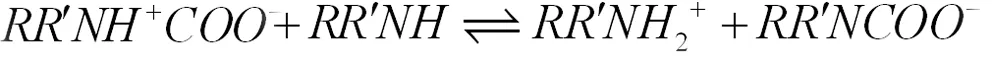
从前两个方程可以明显看出,CO2与伯胺、仲胺反应时,每摩尔胺最多吸收0.5mol CO2,但是,一般胺吸收的CO2量都超出了这个极限,一般可能是因为物理吸收或者两性离子的水解:
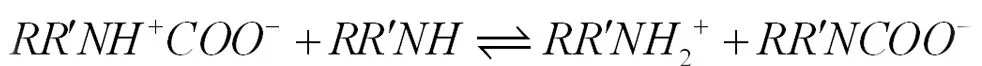
1.3 CO2吸收反应热力学模型
很多研究者对CO2吸收体系进行过大量的模型化工作,也选用了各种模型进行了计算研究,计算过程中对相关体系的热力学数据进行了模拟,包括纯药剂的饱和蒸汽压、热容数据,与水混合二元体系的汽液平衡、热熔、混合热数据及CO2在该体系的溶解热数据等,气液溶解反应过程较复杂。
化学吸收法捕集CO2的过程包含气液两相,当反应达到平衡时气液两相中各组分逸度相等,对于参考态为纯物质的组分,符合下列等式[6]:

(1)
如果参考态为无限稀释状态的组分CO2,则满足下式:
其中, yi表示组分i的气象摩尔组成、 φi为气相逸度系数为液相摩尔组成。
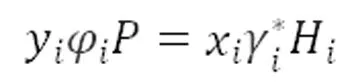
(2)
对于气相组分逸度系数的可以采用各种立方型方程得到,使用较为普遍的为Peng-Robinson或Redlich-Kwong状态方程。Kent[7]等最先提出反应热计算模型,该模型为半经验型,其关键在于将上式1和2的平衡常数与温度、CO2浓度、胺浓度相关联,形成一个新的函数,模型计算过程忽略了所有组分的活度系数,这一计算模型计算简单、快速,但为半经验式的没有外推扩展性,比较适用于有实验数据的计算。
溶剂吸收CO2过程中体系为含电解质的混合溶液,故计算过程模型的选择严格来讲应为电解质热力学模型,其中Clegg-Pitzer电解质模型[8]、非随机双流体电解质模型(eNRTL)[9]和通用似化学电解质模型(eUNIQUAC)[10]等是使用较多的电解质混合溶剂热力学模型,对比三个计算模型Clegg-Pitzer电解质模型具有简单、参数少、扩展预测精度高等优点,非随机双流体电解质模型最复杂、参数较多,关联预测精度高但扩展预测精度低通用似化学电解质模型处于两个之间。
Clegg-Pitzer电解质模型在模拟软件AMSIM中称为Li-Mather模型[11-13],该软件主要用于计算酸性气体吸收,Li-Mather模型在计算MEA、DEA、TEA、MDEA及二元复配溶液吸收CO2等酸性气体时,计算结果较准确[14]非随机双流体电解质模型经常用在进行Aspen软件模拟过程中计算CO2等酸性气体的基础热力学。有些研究者也通用似化学电解质模型对CO2吸收过程热力学进行计算[15]。
综上所述,CO2吸收过程热力学数据与计算模型的建立至关重要,是评价吸收剂吸收能力、CO2捕集过程工艺优化的重要条件。虽然已经有很多关于CO2吸收过程热力学计算模型,但对于常压系统吸收CO2来说,新型吸收剂的热力学模型的建立仍为长期研究重点。
2 AEEA+MDEA+MOR吸收热试验
较计算反应热而言,直接测量的方式能够确实的反应CO2与胺溶液物理溶解和化学反应的双重影响,由前面实验结果可知复配药剂以AEEA+MDEA+吗啉能耗最低,且吸收量与脱除率均较为可观。本论文的计算模型针对的是在该直接量热实验系统下吸收过程反应热的计算模型。
一般CO2捕集过程是在常压下进行的,因此实验选择压力为1bar,对20%AEEA +2%MDEA+2%吗啉三元复配药剂在不同温度下的吸收热进行测量,并对实验结果进行拟合,从而得出24%该复配药剂在1bar下的反应热随温度的变化曲线,以供后续反应热计算的参考。
同一物质的化学反应热与温度、压力有关,对于多元复配溶液各组分的配比也是影响反应热的关键因素,本部分实验只是针对前面实验结果的进一步讨论,所以建立的计算模型是特别单一的、适用范围很窄的计算公式,即模型是初步的,还需要很多的工作量,才能得到有使用价值的预测公式。
2.1 不同温度吸收热
实验测量了AEEA+MDEA+MOR混合溶剂分别在40℃、50℃、60℃、70℃、80℃下的吸收热,对反应过程数据作图结果见图1。

图1 AEEA+MDEA+MOR不同温度吸收热
试验测得AEEA+MDEA+MOR混合溶剂在不同温度下的吸收热变化情况,如图1所示,吸收热在50℃最大为59.8kJ/mol CO2,40℃、80℃吸收热相差不大,70℃、80℃时反应热有一段上升处,说明该温度超过了AEEA+MDEA+吗啉混合溶剂的最佳吸收温度。吸收热随温度的上升符合先增大后减小的变化趋势。

图2 AEEA+MDEA+MOR不同温度吸收量
由图2可知AEEA+MDEA+MOR混合溶剂吸收量在60℃时最高,为19.04L,40℃与80℃吸收量差不多,处于最低值,基本符合吸收量越小,吸收热越低的规律。
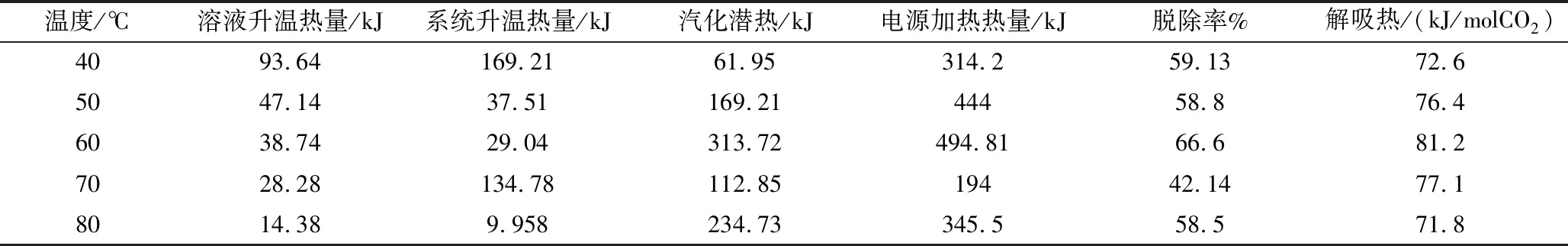
表2 AEEA+MDEA+MOR解吸数据
由表2可知AEEA+MDEA+MOR混合溶剂在吸收温度为60℃时的脱除率最高达到66.6%,50℃、80℃、40℃时溶剂脱除率相差不大。解吸热大小规律与吸收热相符。综上所述,AEEA+MDEA+吗啉混合溶剂吸收热在40~80℃之间有一个最大值,随温度的上升,吸收热先增加后减小,这是由于CO2吸收为放热可逆反应,低温范围内温度越高有利于反应的进行,随着温度的上升,越来越有利于逆向反应,吸收CO2的能力也会降低。
2.2 吸收热拟合
由上述实验结果绘制吸收热与温度的散点图,并用origin8.0对散点图进行二次函拟合,得到AEEA+MDEA+MOR混合溶剂吸收CO2的吸收热计算方程:ΔH=47.6342-3.63851T+0.02974T2
拟合曲线如图3所示,由散点图和前面实验数据可知,溶剂吸收CO2过程吸收热随温度变化先增大后减小,理论上应该符合二次函数,故对数据进行二次曲线拟合,拟合曲线的相关系数R=0.91,B1、B2值的标准误差分别为0.637和0.05,拟合结果基本准确。
为检验该函数解析式的准确性,分别测量了AEEA+MDEA+MOR混合溶剂在55℃和75℃下的吸收热,与计算方程求得数据进行对比。对比结果如表3,由表3相对误差可知,计算值与实验值相对误差较小,保持在3%以内,故该解析式具有一定应用性,可用于计算在40~90℃范围内AEEA+MDEA+吗啉混合溶剂的吸收热。
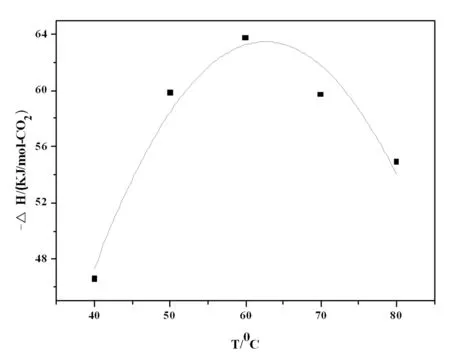
图3 AEEA+MDEA+吗啉不同温度吸收热拟合曲线

表3 吸收热实验值与计算值对比
对该吸收剂建立不同吸收温度下的吸收热计算模型ΔH=47.6342-3.63851T+0.02974T2,计算相对误差在3%以内,在40~80℃反应温度范围内适用。
3 结论
(1)AEEA+MDEA+MOR混合溶剂吸收热随温度的上升呈现先增大后减小的变化趋势。在50℃最大为59.8kJ/molCO2,40℃、80℃吸收热相差不大。
(2)AEEA+MDEA+MOR混合溶剂吸收量在60℃时最高,为19.04L,40℃与80℃吸收量差不多,处于最低值,符合吸收量越小,吸收热越低的规律。
(3)AEEA+MDEA+MOR混合溶剂在吸收温度为60℃时的脱除率最高达到66.6%,50℃、80℃、40℃时溶剂脱除率相差不大。
(4)吸收剂建立不同吸收温度下的吸收热计算模型ΔH=47.6342-3.63851T+0.02974T2计算相对误差在3%以内,在40~80℃反应温度范围内适用。
