内镜下黏膜切除术治疗胃肠道息肉的效果及安全性研究
2019-06-12陈治熙郑丽梅蔡方宙
陈治熙 郑丽梅 蔡方宙
[摘要]目的 探究胃肠道息肉患者行内镜下黏膜切除术治疗的效果及安全性。方法选取2017年1~12月收集胃肠道息肉患者共118例作为实验对象,以随机数字表法进行分组,对照组59例及观察组59例。对照组患者实施高频电刀切除术治疗,观察组患者实施内镜下黏膜切除术治疗。对两组患者术后临床疗效及并发症情况进行记录。结果 观察组患者临床治疗总有效率96.61%显著高于对照组84.75%;观察组患者术后并发症发生率5.08%,显著低于对照组的16.95%,差异有统计学意义(P<0.05)。结论 胃肠道息肉患者实施内镜下黏膜切除术治疗效果显著,安全性高,因此该种治疗方案值得在临床中推广。
[关键词]内镜;黏膜切除术;胃肠道息肉;并发症
[中图分类号]R735
[文献标识码]A
[文章编号]2095-0616(2019)03-210-04
胃肠道息肉是常见的消化道疾病,其中腺瘤性息肉具有一定几率发生恶变,故需进行治疗。该疾病初期无典型症状,病情进展患者可能出现消化道出血及胃肠道癌变风险,严重威胁到了患者的健康及生命安全[1-3]。因此及早切除息肉对患者的康复具有积極影响。高频电凝切除术与内镜下黏膜切除术均为胃肠息肉常用治疗方法。内镜下黏膜切除术(EMR)是基于息肉电切术、黏膜下注射等内镜技术上所发展而来。本研究选取59例患者开展内镜下黏膜切除术治疗胃肠息肉效果研究,旨在为该疾病患者寻更有效、更安全的治疗方法。现报道如下。
1 资料与方法
1.1 一般资料
本研究于2017年1~12月收集胃肠道息肉患者共118例作为实验对象,所有患者均经消化道内镜确诊,息肉直径均超过6mm。以随机数字表法分为两组,对照组59例及观察组59例,对照组中男35例,女24例,年龄20~65岁,平均(43.2±3.3)岁,胃息肉及结肠息肉患者分别有38例及21例;观察组中男33例,女26例,年龄21~67岁,平均(44.1±3.2)岁,胃息肉及结肠息肉患者分别有36例及23例,两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:确诊为胃肠息肉患者;对研究知情且自愿签署同意书患者;无感染性疾病患者;无免疫功能缺陷患者。排除标准:排除家族性腺瘤性息肉病、Peutz-Jeghers综合征;存在手术禁忌证患者;合并凝血功能障碍、出血倾向患者;存在重大心肺肝肾疾病患者。
1.2 方法
对照组行高频电刀切除术,为患者行常规麻醉,结肠镜从远端逐渐后退,对患者息肉数量、大小以及位置进行确定并切除。观察组行内镜下黏膜切除术,手术仪器设备包括日本Olympus公司生产的电子胃镜及电子肠镜,切割功率设置为30W,凝固功率设置为50W,工作模式设置为电切混合模式。配套产品包括同公司生产的圈套器及活检钳。
患者行丙泊酚注射液(广东嘉博制药有限公司;H20051842;规格:0.2g/20mL)静脉注射给药,剂量为0.2g,同时对患者血氧饱和度、脉搏情况进行严密监测。以常规操作将胃肠镜置入后寻找息肉位置,并标注注射点。于患者病变口侧或肛侧进针,直至其黏膜下层,在息肉底部黏膜下层处注射肾上腺素氯化钠液(1:10000)以充分隆起病变部位,具体注射量以息肉大小和位置确定,一般情况注射量范围在5~10mL,若息肉过大可反复注射。病灶隆起后将注射针拔除,置入圈套器将息肉套住后收紧并提起圈套器,在收紧圈套器的同时通电,应用混合电流将被套住的息肉切除。针对体积过大的息肉可采取分片切除法。切除息肉后对创面进行观察,是否有出血或穿孔等不良情况发生。正常情况下行内镜下粘膜切除术创面颜色发白,无出血迹象。若创面处渗血量较少,可在创面处喷洒去甲肾上腺素氯化钠液,若存在显著出血情况可应用钛夹夹闭。术后1~2d患者应卧床休息,术后2~3d进食以半流质食物为主。胃息肉患者术后行2~3周质子泵抑制剂进行治疗以避免胃出血,并加速手术创面愈合。患者术后发生穿孔时,需即刻开始禁食、胃肠减压、抗感染治疗,穿孔合并腹膜炎时需转外科治疗。
1.3 观察指标
临床疗效评定标准[4-5]:治疗后胃镜结果显示息肉彻底清除为治愈;治疗后胃镜结果显示息肉体积缩小70%以上为显效;治疗后胃镜结果显示息肉体积缩小范围30%~69%为有效;治疗后胃镜结果显示息肉体积无缩小为无效。临床治疗总有效率=(治愈+显效+有效)/总例数×100%。记录本组患者术后并发症发生率。
1.4 统计学方法
本研究行统计学软件SPSS17.0计算,计数资料以百分数表示,采用χ2检验,计量资料以(x±s)表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
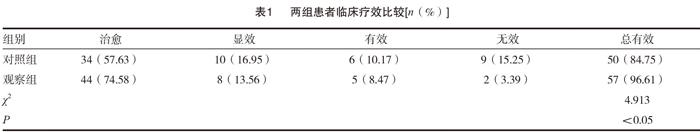
2.1 两组患者临床疗效比较
观察组患者临床治疗总有效率96.61%显著高于对照组84.75%,差异有统计学意义(P<0.05)。见表1。
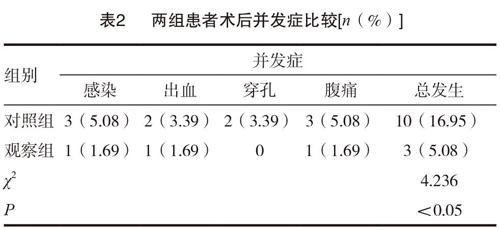
2.2 两组患者术后并发症比较
观察组患者术后并发症发生率5.08%显著低于对照组的16.95%,差异有统计学意义(P<0.05)。见表2。
3 讨论
胃肠道息肉在临床中具有较高的发病率,由于初期无显著性临床症状导致大部分患者未能及时发现疾病,多因胃肠不适症状或体检时行胃肠检查发现。腺瘤性息肉及伴随低级别以上瘤变的息肉为胃肠癌前病变。因此及早治疗对患者的健康具有重要意义。当前该疾病的治疗以手术为主,常见手术方式包括内镜下高频电切术、内镜下黏膜切除术等[6-8]。内镜下高频电切术的工作原理是通过高频电流的流通产生热效应,对病变组织进行凝固处理后使其坏死,进而将息肉切除以达到治疗的目的。该种治疗方式在胃肠道息肉治疗中的应用较为广泛,但是该术式治疗过程中若电切过浅,则可导致患者息肉病灶难以完全切除,而电切过深则可造成患者消化道穿孔,由此可见该种手术方式术后并发症风险更高,会对患者临床疗效及预后产生一定的负面影响[9-11]。同时还有研究结果显示,带蒂型胃肠息肉与隆起性胃肠息肉患者病灶有明显的深度差异,因此这两种类型患者通过电凝切除术可有良好的临床疗效,但是针对扁平型胃肠息肉病灶,常规内镜检查无法明确区别病灶深度界限,因此通过电凝电切手术治疗时,医生无法准确把握病灶的切除深度,导致电切术在扁平型胃肠息肉疾病治疗中存在一定的局限性。
随着医疗技术的不断发展,在息肉电切术以及黏膜下注射治疗方案的基础上,内镜下黏膜切除术逐渐发展起来,成为消化内镜领域中的新技术之一,因具有操作简单、并发症少及临床疗效理想等特点,在临床平坦凹陷性肿瘤疾病以及消化道无蒂隆起性疾病治疗中的应用愈加广泛[12]。在患者病灶黏膜下行注射处理以保证病灶处充分隆起,进而形成液体垫是该术式的关键技术,该种做法能够保证肌层与病变处的分离,进而使得手术切除息肉过程中不会对患者外膜或肌层造成损伤,大大提升了手术的安全性[13]。本研究结果显示,观察组患者临床疗效显著高于对照组,术后并发症风险显著低于对照组,说明内镜下黏膜切除术对胃肠道息肉具有显著疗效,且该术式安全性更高。
胃肠道息肉患者行内镜下黏膜切除术治疗时因息肉病变部位的不同,其治疗操作也有一定的差异[14]。一般情况下,胃部息肉患者的注射应始于肛侧,而肠道息肉患者的注射则应始于口侧,以保证病灶能够充分隆起的同时面向内镜镜头,便于后续切除操作的顺利进行。若此步骤出现偏差可导致患者病灶隆起后而背向内镜镜头,导致后续息肉套取难度加大,临床手术医生也难以判断套取息肉时是否将邻近黏膜一同套住,容易对患者基层和黏膜造成损伤,严重者可引发患者穿孔[15]。
内镜下黏膜切除术需要配合黏膜下注射进行,由此可见黏膜下注射材料对手术疗效也具有一定的影响[16]。内镜下黏膜切除术中理想的注射材料应具备以下特征:可提供较厚的黏膜下水垫;可持续较长时间隆起;不会对组织标本完整性产生影响以保证其可明确病灶的病理分型或分期;价格合理且获取难度低。一般临床中可用的注射材料包括生理或高渗盐水、甘油果糖、透明质酸钠、葡萄糖等,材料的选择应以患者、医院的情况为参考依据,才能保证手术顺利及手术安全性。
消化道出血及穿孔是内镜下黏膜切除术治疗胃肠道息肉常见并发症,可对患者手术效果造成不良影响,在本次研究中本组患者发生消化道出血2例,占比3.39%,穿孔1例,占比1.69%,因此为提升手术疗效及安全性,需要为患者提供以下几项预防措施:当患者息肉直径≥2cm时,应实施分块方法逐渐切除息肉;实施息肉切除前应在患者息肉底部黏膜下注射适量生理盐水,保证息肉底层和黏膜层充分分离;若患者胃肠息肉数量较多,应实施息肉病灶分次切除方式,同时注意两次病灶切除时间的间隔期应超过30d;主治医生术前应排除患者具有凝血功能异常疾病,明确患者的用药史,若患者长期服用阿司匹林,术前应告知其提前一周停药,若患者正在服用抗血小板类药物,术前一周应停用以避免对其凝血功能造成不良影响。
综上所述,胃肠道息肉患者实施内镜下黏膜切除术治疗可有效清除息肉病灶,且操作简单,术后并发症少,安全可靠,疗效确切,值得推广。
[参考文献]
[1]潘良,张小平,赵凯.内镜下黏膜切除术治疗消化道难治性息肉的疗效分析[J].中国医师进修杂志,2016,39(5):463-465.
[2]李倩,李楠杉,劳月琼,等.内镜下黏膜切除术治疗结直肠息肉437例分析[J].中国内镜杂志,2017,23(6):34-39.
[3]陈慕维,植中敬.内镜下黏膜切除术治疗老年胃肠道息肉的临床疗效观察[J].海南医学院学报,2016,22(14):1538-1540.
[4]周海华,袁帅,石胜利,等.内镜黏膜下剥离术治疗消化道巨大息肉临床观察[J].海南医学,2016,27(10):1662-1663.
[5]李兴红,冯裕容.内镜下黏膜切除术治疗结肠广基息肉的临床可行性分析[J].安徽医药,2017,21(5):907-909.
[6]陈文婷,王锐,高会斌.内镜黏膜切除术对肠道广基大息肉样病变的治疗价值[J].河北医科大学学报,2016,37(7):828-831.
[7]陈彩林,赵冰.胃肠道平坦型息肉经内镜下黏膜切除术后出血的原因及处理措施[J].国际消化病杂志,2016,36(2):125-126.
[8]孙金锋,耿江桥,张智高,等.窄带光谱成像技术应用于内镜下分片黏膜切除术治疗大肠息肉的临床效果观察[J].现代消化及介入诊疗,2015,20(5):513-515.
[9]檀心广,胡志方,李福祥,等.内镜下黏膜切除术与高频电切术治疗消化道息肉的疗效对比分析[J].中国中西医结合消化杂志,2016,24(9):690-692.
[10]田晓锋,刘林霞,马洁云,等.内镜下黏膜切除联合氩离子凝固术治疗大肠扁平息肉的效果分析[J].实用临床医药杂志,2016,20(23):91-92.
[11]黄长玉,吴攀,晋琼玉.内镜下黏膜切除术与高频电切术治疗直径>20mm结肠息肉的临床对比研究[J].中国病案,2018,19(4):98-101.
[12]陈丽芬,黄理,姚朝光.内镜下黏膜切除大肠宽基息肉的治疗价值[J].海南医学,2016,27(12):2016-2018.
[13]王双平,王桂周.内镜下黏膜分片切除术治疗结肠巨大恻向发育型腺瘤性息肉26例临床分析[J].安徽医药,2017,21(8):1456-1459.
[14]李江虹,黄国进,成翠娥,等.内镜黏膜切除術与高频电凝圈套切除术治疗结直肠无蒂息肉的疗效对比[J].中国临床医学,2017,24(1):115-118.
[15]朱友.内镜下黏膜剥切术联合氩离子血浆凝固术治疗消化道息肉的临床价值研究[J].检验医学与临床,2016,13(22):3168-3170.
[16]牛永杰,吴凯.经内镜治疗胃肠道息肉的临床护理路径及对疗效的影响[J].现代消化及介入诊疗,2017,22(6):898-901.
