3D细胞培养在药物研发中的研究进展
2019-06-12余坤周永春
余坤 周永春
昆明医科大学第三附属医院分子诊断中心/肺癌研究重点实验室云南省肿瘤医院分子诊断中心/肺癌研究重点实验室云南省癌症中心分子诊断中心/肺癌研究重点实验室,云南昆明650118
[摘要]3D培养模型的引入是细胞培养技术的一个里程碑,随着新型支架、基质的发明与应用及细胞成像和分析系统的日新月异,三维细胞培养可模拟体内微环境而获得传统2D细胞培养所没有的优势,已在基础研究、干细胞及组织工程等领域崭露头角。本文通过回顾3D细胞培养在药敏实验、药物筛选、药物研发、临床应用中的贡献,从药物效应、药物代谢及药物敏感性着手,枚举3D细胞培养通过改变基因/蛋白质差异表达来进行药物研发,并对其应用趋势、潜在优势和不足作一综述,为基础研究和临床应用提供理论依据。
[关键词]3D细胞培养(TDCC);药物研发;药物效应;药物代谢;药物敏感性
[中图分类号]R917
[文献标识码]A
[文章编号]2095-0616(2019)03-36-04
新靶标的发现及发挥作用的分子与化合物的合成是药物研发的基础与重中之重,药代动力学和毒性效应是它们的作用机制[1-2]。技术的进步和学科之间的交叉渗透,使药物发现过程变得不那么繁琐反而更加简易。生物信息学的发展使得药物在体内的代谢、作用及预后等方面可进行体外模拟,进而确定潜在的药物靶点成为可能。应用生物信息学(结构建模)结合药物化学和细胞培养进行的体外药物检测已成为初期药物研发的主要方式,这种方法不仅有助于节省时间和成本,还有助于发现针对患者治疗的正误和有效与否。近年,对三维细胞培养(three-dimensional cell culture,TDCC)技术最新进展的报道层出不穷,主要描述了该模型中癌细胞生长的不同物理特性和信号调控,癌细胞对药物的敏感性和如何使药物渗透至细胞,还报道了细胞对抗癌药物的敏感性受到基质性質和使用的细胞类型的影响[3-5]。业已证明,TDCC模型结合微阵列和生物信息学对于药物发现和筛选具有潜在的应用前景[6-8]。
1 TDCC诱导的基因表达和药物效应
候选药物在靶细胞中诱导的损伤程度是药物研发的价值体现,而安全性检测为副作用的发现提供了可能,是药物筛选的基础。与单层细胞培养相比,TDCC会诱导细胞基因和蛋白的差异表达,对识别新的药物靶标更具实际意义[9]。
Li等[10]对人神经母细胞瘤细胞SH-SY5Y进行了3D细胞培养,使用微阵列和RT-PCR分析了1766个基因的表达变化,发现不同基质特性诱导的TDCC可发生特征性变化,并强调了该研究可直接应用于药物剂量、代谢途径、药效等的检测,为个体化精准医疗提供最佳治疗结果。另一项关于TDCC诱导的基因表达差异的综合研究是使用了对血管平滑肌细胞的9600个基因的微阵列分析。显示在3D培养物(也称为球体)中超过77种与药物重新定位的相关基因发生过表达。Peyton团队[12]将TDCC技术引入平滑肌细胞的培养,结果显示TDCC中细胞外基质的力学特性可调节RhoA表达和活化,对细胞增殖具有显着影响,有助于改善抗增殖药物的使用。
Wang等[13]使用胶原蛋白作为TDCC生长基质培养嗅鞘细胞(OECs)已显示获得与体内细胞相似的包括形态学、凋亡、增殖等在内与自然微环境生存相关的若干特性。Debeb团队的研究[14]表明应用TDCC技术培养的人类胚胎肾细胞(293T细胞)可用于提高药物测试的效用,对药物靶向具有启示意义,包括基因TA1,RhoC,N-钙黏素(N-cathedrin),vimentin,Notch1,β-catenin,zeb1,slug和snail都存在过表达,有望成为新的药物靶标。无独有偶,将人恶性胶质瘤细胞作为3D培养物生长时,具有DNA修复作用的O6-甲基鸟嘌呤DNA甲基转移酶(MGMT)和谷胱甘肽S-转移酶(GST)显示出差异表达,3D较2D培养更能充分证明MGMT和GST表达不能预测成胶质细胞瘤细胞对烷化剂的敏感性,而烷基化剂与GST抑制剂的组合揭示了加和效应,进一步提出了在胶质母细胞瘤治疗中应考虑抑制GST以获得更好的有效性[15]。人卵巢癌细胞SKOV3在微流体芯片上作为3D工程组织培养时,具有上皮-间质转化(Epithelial-MesenchymalTransition,EMT)能力,这些细胞获得了间充质成纤维细胞的形态,表达了纤连蛋白和N-cadherin的下调,具有低氧特性,并表达了上皮肿瘤标志物波形蛋白和CD362/EpCAM,这些不同的表达可用于探究靶向细胞凋亡和转移的药物[16]。Ghosh团队通过寡核苷酸微阵列分析在多甲基丙烯酸甲酯包被的平板上生长为多细胞球状体的黑色素瘤细胞,发现超过20,000个基因的表达,包括IL-8、CXCL1、CXCL2、CXCL3、ICCL20和ANG等基因显着过表达,而CD49d和FGF基因的表达减少,这些结果提示研发肿瘤转移、血管生成和癌症进展的靶向药物成为可能[17]。Debnath和Brugge的研究[18]为形态建模提供了管腔形成、细胞极性和细胞侵入等性质的重要特征,有助于发现3D培养中基质金属蛋白酶(MMP)的过表达和受体酪氨酸激酶(RTKs)、集落刺激因子1(CSF1)、表皮生长因子受体(EGFR)的功能以及导致EMT的途径及其与肿瘤发生和发展相关的机制,为将3D细胞培养用于更现实相关的药物研发是有利的提供有力的理论依据。这项研究还确定了新的分子在肿瘤进展中的作用,从而提出精准治疗的潜在靶标。
2 高新技术助力3D培养和药物代谢
TDCC技术能更加切合体内实际地了解药物在体外的代谢。早在1994年,Boxberger团队[19]就表明,当使用藻酸盐对人类膀胱癌细胞RT112进行3D多细胞球体培养时,能够形成良好的内质网和高尔基体,从而增强细胞发育、功能反应以及体外代谢活动。Lan等[20]研究组采用藻酸盐构建三维支架,测定单层和3D培养物中包封细胞的I期/II期细胞活力和代谢特征,使用扫描电子显微镜(SEM)和激光扫描共聚焦显微镜(LSCM)评估了用肝癌细胞HepG2包裹的超无菌藻酸盐水凝胶在高通量药物筛选中的应用。结果 包裹细胞的增殖速率保持稳定,14天后仍具有>80%的高细胞活力,并产生CYP1A1和CYP3A4肝特异性酶,表明细胞的存活力和功能性良好,且能持续保持II期细胞的谷胱甘肽活性。Labonia团队[21]用3D打印流体装置新型体外平台来评估药物的渗透和代谢。其允许三维细胞培养物进行动态给药,用MALDI成像质谱法(IMS)检查化疗药物伊立替康对结肠癌HCT116球状体的渗透。还检测到伊立替康的活性代谢物SN-38经24小时的治疗后,被浓缩到球状体细胞分裂活跃区(即外围),表明这种独特的体外平台是评估3D细胞培养物中药物渗透和代谢的有效手段。由于其成本效益和高通量,该创新系统可对候选药物的临床前评估产生重大转变性影响。Feng等[22]利用聚己内酯(PCL)和羟基磷灰石(HAp)制成具有生物相容性,且平均孔径167μm的近场静电纺丝(NFES)复合支架,有效提高细胞的增殖和分化,并可根据PCL与HAp的比例控制降解速率,有效解决了3D系统不易分离细胞的缺陷。Choi团队[23]研究发现TDCC技术培养的肝细胞样细胞(HLCs)药物代谢酶和肝转运蛋白的基因表达显着高于在2D培养的HLCs。此外,3D培养的细胞显现特异性功能,包括白蛋白分泌和胆小管形成增加。特别地,3D球形培养物增加了编码肝酯酶的CES1和BCHE的表达。通过胆碱酯酶活性测定得知HLC对奥司他韦的易感性增加,证实了这些肝酯酶的活性增强。多项研究证实,3D球形培养可增强细胞的成熟和药物代谢,有助于优化药物筛选及毒性检测。
3 改變药物对3D细胞培养的敏感性
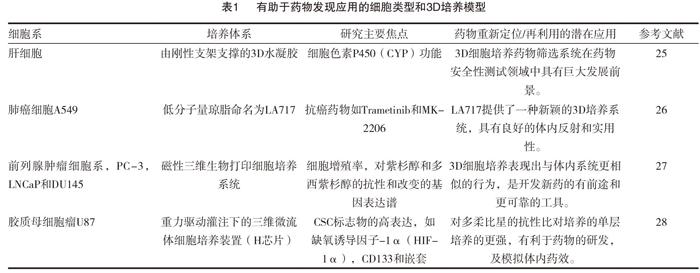
TDCC技术给药效研究领域带来了福音。它的出现已经极大地改变了药物诱导的细胞毒性,基因毒性,抗增殖和类似作用的典型“剂量反应”的观点。Castillo等[24]利用TDCC对60个肺癌细胞球状体进行Gefitinib的敏感性探究,发现EGFR与hedgehog信号通路的G蛋白偶联受体SMO是其敏感性相关的基因,并证实了吉非替尼与SMO抑制剂Cyclopamine和GDC0449具有潜在的协同作用。3D细胞培养物用于直接测试不同终点或化合物对药物诱导的调节效应,大多数都针对不同终点的药物测试,具有显著基因表达变化,且可用于药物发现的3D细胞培养研究枚举于表1[25-28]。
4 结论
细胞培养是药物研发、干细胞和肿瘤研究领域不可或缺的实验对象。三维细胞培养已成为药物研发的宝贵工具,为细胞的体外药物研发模拟体内微环境,较2D培养更接近体内真实情况,有助于弥合体外和体内系统之间的差距,并可减少在早期发现阶段使用动物的实验次数,以减少药效等方面的误差。在诸如“组学”工具,纳米技术和生物打印等高新领域的进步与融合,势必增强3D细胞培养在药物研发中的实用性。近年来,研究者们已经探索了自动化,微流体、芯片及NASA研发改进的微重力旋转三维培养体系,尽管显现出较2D培养的优越性,然而,大多数3D培养物利用凝胶基质,但由于其固体和不透明性以及细胞暴露于外源信号的不一致性而限制了应用。在没有凝胶基质的3D培养中,细胞倾向于彼此粘附并在中心形成具有坏死区的团块,使得它们不易于分析,因此,TDCC在纳入药物研发、个体化精准诊疗等领域的共识及标准前,还有很多荆棘与坎坷亟待攻关和解决。
[参考文献]
[1] Sanoh S,Ohta S.Contribution of chimeric mice with a humanized liver to the evaluation of pharmacology,toxicity and pharmacokinetics in drug discovery and development[J].Folia Pharmacologica Japonica,2018,151(5):213-220.
[2] Ahlqvist M,Bo L,Hayes M A,et al.Early human in vivo pharmacokinetic predictions in drug discovery[J].Drug Metabolism&Pharmacokinetics,2018,33(1):S43.
[3] Rijal G,Li W.3D Scaolds in breast cancer research[J]. Biomaterials,2016,37(81):135-156
[4] Hoarau-Ve?chot J,Rafii A,Touboul C,et al.Halfway between 2D and Animal Models:Are 3D Cultures the Ideal Tool to Study Cancer-Microenvironment Interactions?[J].International Journal of Molecular Sciences,2018,19(1):181.
[5] Lv D,Hu Z,Lu L,et al.Three-dimensional cell culture: A powerful tool in tumor research and drug discovery (Review)[J].Oncology Letters,2017,36(14): 6999-7010.
[6] Meli L,Jordan E T,Clark D S,et al.Influence of a Three- Dimensional,Microarray Environment on Human Cell Culture in Drug Screening Systems[J].Biomaterials,2012,33(35):9087-9096.
[7] Florczyk S J,Simon M,Juba D,et al.A Bioinformatics 3D Cellular Morphotyping Strategy for Assessing Biomaterial Scaffold Niches[J].Acs Biomaterials Science&Engineering,2017,3(10):2302-2313.
[8] Zhang B,Li Y,Wang G,et al.Fabrication of agarose concave petridish for 3D-culture microarray method for spheroids formation of hepatic cells[J].Journal of Materials Science Materials in Medicine,2018,29(5):49.
[9] Soares C P,Midlej V,Benchimol M,et al.2D and 3D- organized cardiac cells shows differences in cellular morphology,adhesion junctions,presence of myofibrils and protein expression[J].Plos One,2012,7(5):65.
[10] Li G N,Livi L L,Gourd C M,et al.Genomic and morphological changes of neuroblastoma cells in response to three-dimensional matrices[J].Tissue Engineering Part A,2007,13(5):1035-1047.
[11] Li S,Lao J,Chen BP,et al.Genomic analysis of smooth muscle cells in 3-dimensional collagen matrix[J].Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology,2003,17(1):97.
[12] Peyton S R,Kim P D,Ghajar C M,et al.The Effects of Matrix Stiffness and RhoA on the Phenotypic Plasticity of Smooth Muscle Cells in a 3-D Biosynthetic Hydrogel System[J].Biomaterials,2008,29(17):2597.
[13] Wang B,Zhao Y,Lin H,et al.Phenotypical analysis of adult rat olfactory ensheathing cells on 3-D collagen scaffolds[J].Neuroscience Letters,2006,401(1–2): 65-70.
[14] Debeb B G,Zhang X,Krishnamurthy S,et al. Characterizing cancer cells with cancer stem cell- like features in 293T human embryonic kidney cells[J]. Molecular Cancer,9,2010,9(1):180.
[15] Juillerat-Jeanneret L,Bernasconi CC,Bricod C,et al.Heterogeneity of human glioblastoma:glutathione- S-transferase and methylguanine-methyltransferase.[J]. Cancer Investigation,2008,26(6):597-609.
[16] ChingTe Kuo,ChiLing Chiang,Ruby YunJu Huang,et al.Configurable 2D and 3D spheroid tissue cultures on bioengineered surfaces with acquisition of epithelial|[ndash]|mesenchymal transition characteristics[J].Npg Asia Material,2012,50(4):27.
[17] Ghosh S,Spagnoli G C,Martin I,et al. Three‐dimensional culture of melanoma cells profoundly affects gene expression profile:A high density oligonucleotide array study[J].Journal of Cellular Physiology,2005,204(2):522-531.
[18] Debnath J,Brugge J S.Modelling glandular epithelial cancers in three-dimensional cultures[J].Nature Reviews Cancer,2005,5(9):675-88.
[19] Boxberger H J,Meyer T F.A new method for the 3‐D in vitro growth of human RT112bladder carcinoma cells using the alginate culture technique[J].Biology of the Cell,
1994,82(2-3):109-119.
[20] Lan S F,Safiejko-Mroczka B,Starly B.Long-term cultivation of HepG2 liver cells encapsulated in alginate hydrogels:a study of cell viability,morphology and drug metabolism[J].Toxicology in Vitro,2010,24(4): 1314-1323.
[21] Labonia G J,Lockwood S Y,Heller A A,et al.Drug penetration and metabolism in 3-dimensional cell cultures treated in a 3D printed fluidic device:Assessment of irinotecan via MALDI imaging mass spectrometry[J]. Proteomics,2016,16(11-12):1814-1821.
[22] He F L,Li D W,He J,et al.A novel layer-structured scaffold with large pore sizes suitable for 3D cell culture prepared by near-field electrospinning.[J].Materials Science&Engineering C Materials for Biological Applications,2018,77(86):18.
[23] Choi Y J,Kim H,Kim J W,et al.Hepatic esterase activity is increased in hepatocyte-like cells derived from human embryonic stem cells using a 3D culture system[J]. Biotechnology Letters,2018,40(2):1-9.
[24] Castillo G,Jiang X.Abstract 5447:Association of the hedgehog signal pathway to Gefitinib sensitivity in a 3D cancer cell lines screening[J].Cancer Research,2015,75(12):5852-5862.
[25] Shoemaker J T,Vukasinovic J.Abstract 4080:Cytochrome P450 enzyme activity is enhanced in hepatocytes grown using a perfused 3D cell culture drug screening system[J]. Cancer Research,2017,77(13):4080.
[26] Abefukasawa N,Otsuka K,Aihara A,et al.Novel 3D Liquid Cell Culture Method for Anchorage-independent Cell Growth,Cell Imaging and Automated Drug Screening[J].Scientific Reports,2018,8(1):3627.
[27] Souza A G,Silva I,Camposfernandez E,et al.Comparative Assay of 2D and 3D Cell Culture Models:roliferation,Gene Expression and Anticancer Drug Response.[J]. Current Pharmaceutical Design,2018,24(9):17-18.
[28] Han J,Oh S,Hoang HH,et al.Recapitulation of cancer stem cell niches in glioblastoma on 3D microfluidic cell culture devices under gravity-driven perfusion[J].Journal of Industrial & Engineering Chemistry,2018,100(62):352-361.
