不同干燥方式对杜仲雄花成分含量的影响
2019-06-11魏媛媛温晓李伟业于华忠
魏媛媛 温晓 李伟业 于华忠

摘要[目的]研究不同干燥方式对杜仲雄花总黄酮、绿原酸、京尼平苷等含量的影响,提高杜仲雄花有效成分的利用率。[方法]分别采用炒制、热风、真空、冷冻、晒干、阴干的方式对杜仲雄花鲜叶进行干燥,通过感官评价、高效液相色谱法和紫外分光光度计法对杜仲雄花成分含量进行评价。[结果]真空干燥处理的杜仲雄花总黄酮含量和绿原酸含量最高,冷冻干燥处理的杜仲雄花桃叶珊瑚苷和京尼平苷含量最高,炒制干燥处理的杜仲雄花总黄酮、绿原酸和京尼平苷含量均高于热风干燥处理,但热风干燥处理的杜仲雄花桃叶珊瑚苷含量高于炒制干燥处理。[结论]真空干燥和冷冻干燥处理的杜仲雄花无论外观还是成分含量效果均最佳,晒干和阴干效果最差,但冷冻干燥成本高、耗时长,因此建议采用真空干燥方式。
关键词杜仲雄花;炒制干燥;真空干燥;冷冻干燥;热风干燥
中图分类号TS272文献标识码A
文章編号0517-6611(2019)03-0163-03
doi:10.3969/j.issn.0517-6611.2019.03.051
杜仲(Eucommia uimoides Oliv)为杜仲科杜仲属植物,杜仲雄花茶是以花期只有3~5 d的极其珍贵的纯杜仲雄花花蕊(杜仲雄树生殖器)为原料,通过杀青、烘干、复火工序等加工而成。杜仲是雌雄异株植物,其中雄株占40%~60%[1],杜仲雄花中富含与叶、皮类似的有效成分[2],即绿原酸、京尼平苷、桃叶珊瑚苷等;绿原酸为苯丙素类,具有抗菌活性;京尼平苷属环烯醚萜类,具有抗肿瘤活性[3-4]。桃叶珊瑚苷的苷元及其多聚体具有抗菌作用,是一种抗菌素[5]。杜仲雄花目前食用方式主要以杜仲雄花茶为主,但杜仲雄花茶不仅在干燥和杀青工艺中使得营养成分和活性成分流失,还停滞于其茶汤感官和口感的不理想状态[6]。董娟娥等[7]以感官评价和功能性成分含量检测相结合,研究了微波工艺与传统炒制、热风干燥3种干燥方法对杜仲雄花茶品质的影响,结果表明微波干燥方法效率高,可最大程度地保持杜仲雄花中的功能性成分,干燥的杜仲雄花茶的感官品质佳,可作为生产杜仲雄花茶的首选方法。该研究选取原料为经过加工后的杜仲雄花茶,在一定程度上功能性成分已经被破坏;仅选择3种干燥方法进行评价,不能全面地为生产者提供参考依据;雄花干燥程度评价不规范,如炒制干燥至有香味出锅。笔者以杜仲雄花鲜花为原料,采用炒制、真空、冷冻等6种干燥方法,通过对杜仲雄花外观性质,总黄酮含量,桃叶珊瑚苷、绿原酸和京尼平苷含量的测定评价,分析了杜仲雄花的最佳干燥方法,旨在为杜仲雄花的保存和杜仲雄花茶的生产提供依据。
1材料与方法
1.1材料与仪器
1.1.1材料。杜仲雄花鲜花,于2018年3月下旬采自湖南省张家界市慈利县,去除鲜叶和桔梗密封袋储存于-10 ℃超低温冷冻室,保存、备用。
1.1.2主要仪器与设备。Thermo Evolution 220 型紫外可见分光光度计;Agilent 1260高效液相色谱仪(美国Agilent公司);XD-5200DT 型超声波清洗仪(南京先欧仪器制造有限公司);Hei-VAP value 旋转蒸发仪 ;AL204 型电子分析天平 (梅特勒-托利多仪器上海有限公司);AEL-40SM 型半微量天平 (Shimadzu 1991)。水浴锅(HWS-24);Mide HEGON电磁炉;BIOCOOL Vacuum Freeze Dryer-Lab Series 冷冻干燥机(北京博医康实验仪器有限公司);GZX-9146 MBE数显鼓风干燥箱(上海博讯实业有限公司医疗设备厂);DZF-6050 真空干燥箱;HB43-S Halogen METTLER TOLEDO水分测定仪。
1.1.3主要试剂。芦丁、桃叶珊瑚苷、京尼平苷、绿原酸对照品来自中国生物制品鉴定所;乙腈、甲醇为色谱纯,乙腈、磷酸溶液、超纯水、分析纯乙醇等均购自湖南省张家界市武林化工。
1.2试验方法
1.2.1杜仲雄花干燥方法。
1.2.1.1炒制干燥。
将冷冻保存的杜仲雄花鲜花称取36 g,薄层均匀平摊放入半径30 cm的炒锅中。将炒锅置于家用美的电磁炉上,分别在300 W/80 ℃、500 W/100 ℃、800 W/120 ℃和1 000 W/140 ℃4个条件下进行炒制。在加热过程中不停搅动,炒至水分含量在7%以下时出锅,进行感官评价和功能性成分检测。
1.2.1.2热风干燥。
将冷冻保存的杜仲雄花鲜花称取36 g,薄层均匀平摊放在半径15 cm的不锈钢圆盘中,然后将不锈钢圆盘置于鼓风干燥箱的中部,分别设置数显鼓风干燥箱温度在40、60、80、100、120 ℃ 5个温度条件下间隔搅拌,将杜仲雄花鲜花干燥至水分低于7%,对处理后的样品进行感官评价和功能性成分检测。
1.2.1.3真空干燥。
将冷冻保存的杜仲雄花鲜花称取36 g,薄层均匀平摊放在半径15 cm的不锈钢圆盘中,置于真空干燥箱内,在真空度为-0.1 MPa 的条件下分别于 30、40、50、60 ℃ 4个温度条件下对杜仲雄花鲜花进行干燥,间隔搅拌,直至水分低于7%,对处理后的样品进行感官评价和功能性成分检测。
1.2.1.4冷冻干燥。
将冷冻保存的杜仲雄花鲜花称取36 g,薄层均匀平摊放在半径15 cm的不锈钢圆盘中,置于冷冻干燥机内,冷凝器温度设置为-50 ℃,干燥至水分低于7%,对处理后的样品进行感官评价和功能性成分检测。
1.2.1.5晒干。
将冷冻保存的杜仲雄花鲜花称取36 g,薄层均匀平摊放在半径15 cm的不锈钢圆盘中,置于室外阳光下 36 ℃左右,间隔搅拌,摊晾至水分低于7%,对处理后的样品进行功能性成分检测。
1.2.1.6阴干。
将冷冻保存的杜仲雄花鲜花称取36 g,薄层均匀平摊放在半径15 cm的不锈钢圆盘中,置于室内27 ℃左右,间隔搅拌,摊晾至水分低于7%,对处理后的样品进行功能性成分检测[8]。
1.2.1.7数据处理。
所有试验3组平行,取平均值作为最终试验数据。使用SPSS 24.0统计软件对其进行显著性分析(P<0.05),用 Excel软件绘图。
1.2.2杜仲雄花成分含量的测定。
1.2.2.1总黄酮含量的测定。采用硝酸铝-亚硝酸钠-氢氧化钠显色法测定总黄酮含量。
取芦丁对照品 12 mg,精密称定,置于100 mL容量瓶中;加入甲醇适量,置于40 ℃水浴上微热使其溶解;放冷至室温,加甲醇至刻度,摇匀,即得到芦丁对照品母液。(每毫升中含芦丁0.12 mg)
取干燥后的杜仲雄花粉末0.5 g左右,置于50 mL錐形瓶中,加入甲醇30 mL,超声提取40 min,过滤;滤渣再次加入甲醇30 mL,超声提取40 min,过滤后合并2次滤液,定容至20 mL容量瓶,即得。
精密量取芦丁对照品母液0.5、1.0、2.0、3.0、4.0、5.0 mL,分别置于25 mL容量瓶中,各加水至6 mL。采用亚硝酸钠-硝酸铝-氢氧化钠显色法显色,以相应空白试剂为空白,同法显色,在460~570 nm处跑基线,取2 mL显色后的溶液扫描,发现在508 nm处有最大吸收波长[9]。
1.2.2.2活性成分含量的测定。
分别精密称取桃叶珊瑚苷对照品8.02 mg、绿原酸对照品7.88 mg、京尼平苷对照品4.33 mg,置于同一棕色容量瓶(5 mL)中,超纯水定容,摇匀,即得。
取干燥后的杜仲雄花样品,研细,过四号筛,取约 0.5 g,精密称定,置于25 mL具塞锥形瓶中,加入甲醇溶液30 mL,密塞,超声处理40 min,过滤得到滤液,向装有滤渣的锥形瓶中再次加入甲醇溶液30 mL,同样处理方法得到滤液并合并2次滤液浓缩,以超纯水定容至25 mL容量瓶中,摇匀,再经0.45 μm微孔滤膜滤过,滤液即为供试品溶液。
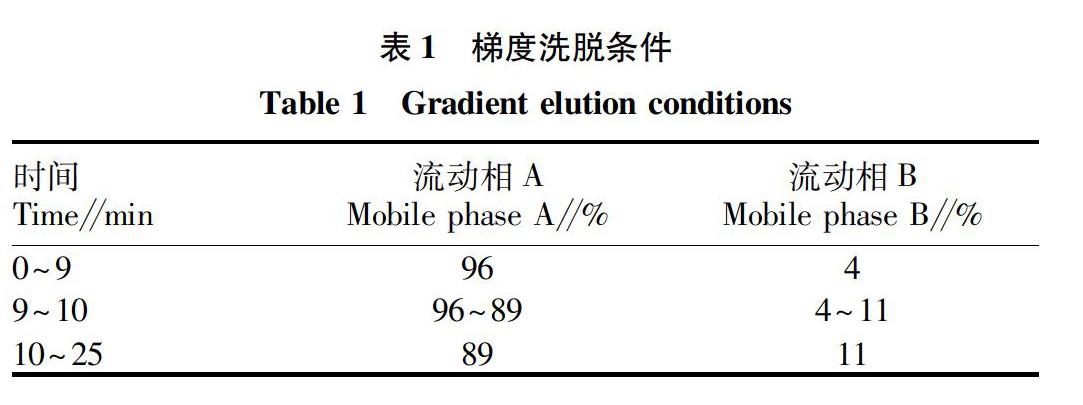
Thermal Hypersil BDS C18 色谱柱(4.6 mm×250 mm,5 μm );以0.3%磷酸溶液为流动相A,乙腈为流动相B,按表1中的条件进行梯度洗脱,体积流量1.0 mL/min;柱温26 ℃;多波长检测:206、238、327 nm;检测时间为25 min,进样量为20 μL[10]。
2结果与分析
2.1炒制干燥
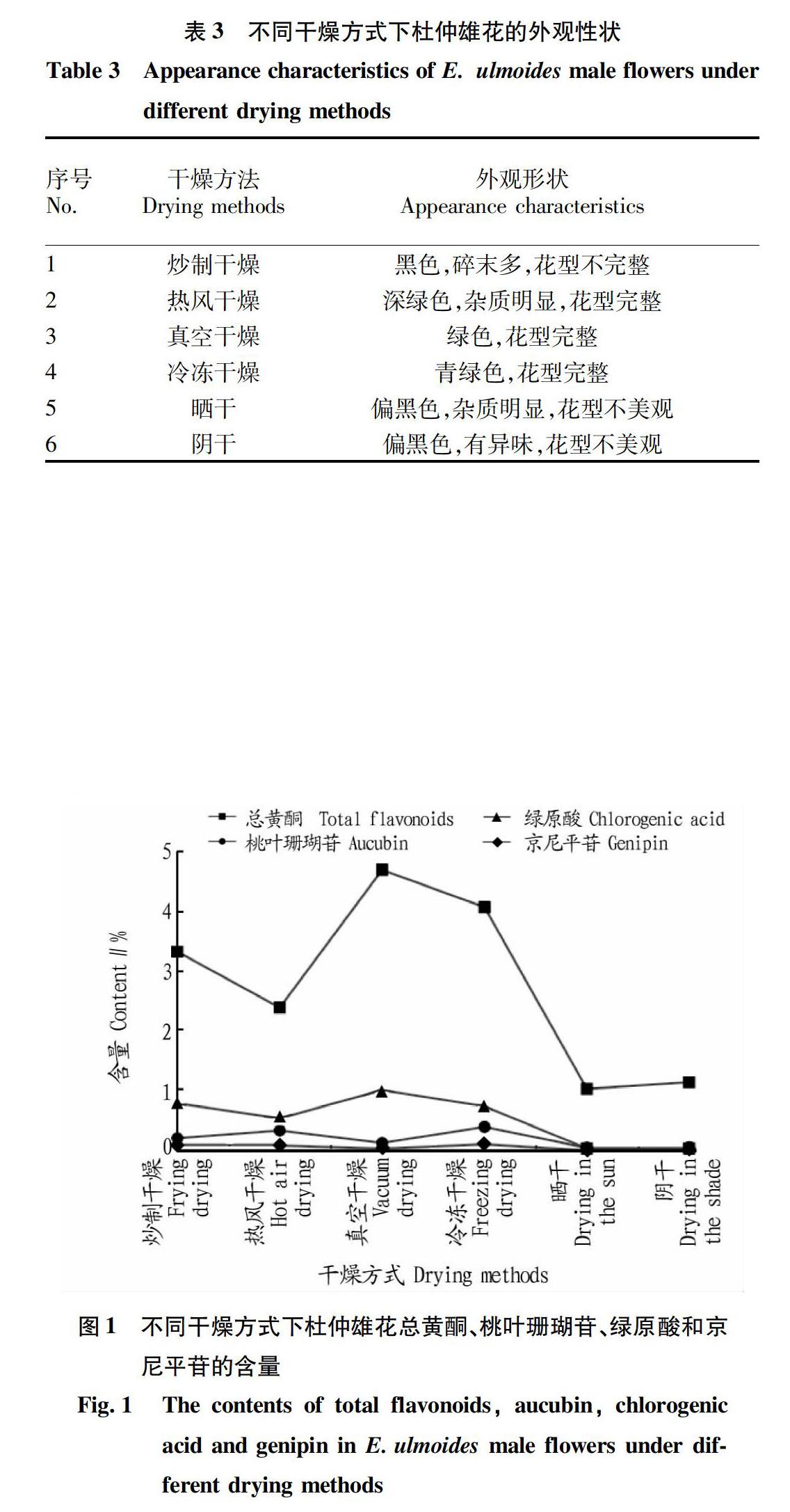
杜仲雄花在炒制条件下总黄酮、桃叶珊瑚苷、绿原酸和京尼平苷含量见表2,外观性状见表3。由表2~3可知,采用传统炒制干燥方式,炒制干燥温度为80 ℃,即电磁炉功率300 W时,杜仲雄花的4种成分总黄酮、桃叶珊瑚苷、绿原酸、京尼平苷的含量均达到最大值,同时感官品质相对较佳;杜仲雄花中含环烯醚萜类成分,炒制过程中易被破坏,传统炒制本来操作不可控因素多,翻炒不均匀,导致外观形状断裂多,外观品质较差。炒制温度高于140 ℃,雄花易焦黑,各成分含量也明显下降。炒制干燥的杜仲雄花香气十足但颜色泛黑,杂质较多,冲泡茶汤有明显的焦糊味。
2.2热风干燥
热风干燥条件下杜仲雄花总黄酮、桃叶珊瑚苷等成分含量变化见表2,外观性状见表3。热风干燥是在烘箱吹入热风使空气流动加快的干燥方法。热风以热空气为干燥介质,自然或强制地对流循环的方式与被干燥物质进行湿热交换,从而达到降低水分含量的效果。由表2、3可知,当热风干燥温度为120 ℃时,杜仲雄花4种成分含量相对较高;同时,热风干燥的杜仲雄花呈深绿色,花型基本完整无破损。40~120 ℃下,杜仲雄花总黄酮、绿原酸、桃叶珊瑚苷含量随温度的升高而明显升高,当温度高于120 ℃时在干燥过程中杜仲雄花易燃,无法测定。
2.3真空干燥
真空干燥条件下杜仲雄花总黄酮、桃叶珊瑚苷等成分含量变化见表2,外观性状见表3。
真空干燥的原理是用真空系统抽真空的同时,对被干燥物料不断加热,使物料内部的水分通过压力差或浓度扩散差到表面,水分子在物料表面获得足够的动能,在克服分子间的相互吸引力后,逃逸到真空室的低压空间,从而被真空泵抽走的过程。真空干燥的优势是干燥温度控制较低,适于富含环烯醚萜类类似成分样品的测定。由表2、3可知,当真空干燥温度为40 ℃时,各成分含量较高。真空干燥后的杜仲雄花外观呈墨绿色,花型完整,无破碎,可见杂质少,花粉含量明显升高。在温度梯度变化下,其活性成分(包括桃叶珊瑚苷和京尼平苷)含量变化微小。
2.4冷冻干燥
冷冻干燥条件下杜仲雄花总黄酮、桃叶珊瑚苷等成分含量变化见表2,外观性状见表3。
冷冻干燥是先将湿物料在共晶点(三晶点)温度以下冻结,使水分变成固态的冰,然后在适当的真空度下使冰直接升华为水蒸气,再用真空系统中的冷凝器将水蒸气冷凝,从而获得干燥制品的技术。由表2、3可知,冷冻干燥技术使杜仲雄花成分得到了最大化保留,无机械损失,干燥条件基本与活性成分贮存条件相应,干燥后的杜仲雄花呈青绿色,口感优于杜仲鲜花,但冷冻干燥耗时长,成本过高,一般企业不会采用。
2.5晒干和阴干
晒干和阴干2种干燥方式下杜仲雄花总黄酮、桃叶珊瑚苷等成分含量见表2,外观性状见表3。
传统晒干和阴干这2种干燥方式,条件无法人为控制,只能适应天气变化,北方夏天温度高的干燥地区晒干和阴干的的杜仲雄花外观性状优于南方潮湿多雨地区,但若是干燥大量原料,天气变化会影响产品收益,造成天灾性损失。由表2、3可知,经晒干和阴干的杜仲雄花总黄酮、绿原酸等成分含量变化较大,外观偏黑,花型不美观。
選取杜仲雄花不同干燥方式下的最优条件进行各成分含量对比,结果见图1。从图1可以看出,真空干燥和冷冻干燥这2种干燥方式对杜仲雄花成分含量的影响较小,且其外观性状也最佳。炒制干燥较热风干燥对杜仲雄花成分含量的影响更小,但炒制干燥的杜仲雄花外观性状较差,热风干燥的杜仲雄花外观性状较好;晒干和阴干2种干燥方式无论成分含量还是外观性状均较差。
3结论与讨论
(1)从外观性状来看,真空干燥和冷冻干燥处理的杜仲雄花效果最佳,其次是热风干燥;晒干和阴干处理的杜仲雄花效果较差;炒制干燥的杜仲雄花花型最不完整,碎末太多,处理效果最差。
(2)从外观性状和4种成分含量来看,炒制干燥在80~140 ℃下炒制时,80 ℃炒制的杜仲雄花效果较佳;热风干燥在40~120 ℃下干燥时,120 ℃干燥的杜仲雄花效果相对较佳;真空干燥在30~60 ℃下干燥时,40 ℃干燥的杜仲雄花效果相对较佳。
(3)从杜仲雄花不同干燥方式对成分含量影响来看,真空干燥处理的杜仲雄花总黄酮含量和绿原酸含量最高,冷冻处理的杜仲雄花总黄酮、绿原酸含量次之;冷冻干燥处理的的杜仲雄花桃叶珊瑚苷和京尼平苷含量最高,真空干燥处理次之。炒制干燥处理的杜仲雄花总黄酮、绿原酸和京尼平苷含量均高于热风干燥处理,但热风干燥处理的杜仲雄花桃叶珊瑚苷含量高于炒制干燥处理;晒干和阴干处理的杜仲雄花总黄酮、桃叶珊瑚苷、绿原酸和京尼平苷含量均最低。
(4)总体来看,真空干燥和冷冻干燥处理的杜仲雄花无论从外观还是成分含量效果最佳,晒干和阴干效果最差,但冷冻干燥耗时长,代价太高,可进行少量珍贵原料的干燥,一般不建议采用。因此,杜仲雄花的最佳干燥方式为真空干燥方式。
参考文献
[1] 张康健,董娟娥,马柏林,等.杜仲次生代谢物部位差异性的研究[J].林业科学,2002,38(6):12-16.
[2] 杜红岩.杜仲活性成分与药理研究的新进展[J].经济林研究,2003,21(2):58-61,82.
[3] 董娟娥,梁宗锁,张康健,等.杜仲雄花中次生代谢物合成积累的动态变化[J].植物资源与环境学报,2005,14(4):7-10.
[4] 李钦,张木升,杜红岩.杜仲雄花茶化学成分及药理作用研究进展[J].河南大学学报(医学版),2011,30(1):6-7,44.
[5] 马希汉,张康健,王蓝,等.富含生理活性物质的杜仲叶提取物的研究[J].西北林学院学报,1997,12(3):86-89.
[6] 魏媛媛,于华忠,温晓.破壁技术及其在杜仲雄花茶中的应用进展[J].贵州农业科学,2018,46(10):109-111.
[7] 董娟娥,付卓锐,马希汉,等.不同干燥方法对杜仲雄花茶品质的影响[J].农业机械学报, 2011,42(8):131-137.
[8] 李世传,熊建华,罗秋水,等.不同干燥方法对金银花叶成分和抑菌效果的影响[J].中国食品学报, 2012, 12(12):78-83.
[9] 杜庆鑫,魏艳秀,刘攀峰,等.分光光度法测定杜仲雄花和叶中的总黄酮[J].中南林业科技大学学报, 2017, 37(5):96-100.
[10] 郭洋静,丁艳霞,许兰波,等. HPLC法同时测定杜仲雄花中5种活性成分[J].中成药, 2014, 36(10):2131-2134.
