桃红四物汤对脑微血管内皮细胞-PC12细胞共培养体系缺糖缺氧再灌注损伤模型的保护作用
2019-06-11陈芳芳彭代银汪蒙蒙胡寿山夏文文
陈芳芳,韩 岚,彭代银,汪蒙蒙,胡寿山,夏文文
(安徽中医药大学药学院 安徽省中药复方重点实验室,安徽 合肥 230012)
桃红四物汤(Tao Hong Si Wu Decoction, THSWD)出自《医宗金鉴》,近年来越来越多的研究表明THSWD对脑损伤模型具有显著的神经保护作用[1-3]。课题组前期研究表明,THSWD治疗显著减少了由缺糖缺氧再灌注(oxygen-glucose deprivation/recovery, OGD/R)损伤诱导的细胞死亡。THSWD发挥神经保护作用,其机制可能与促进脑血管生长和抑制细胞凋亡有关[4]。细胞疗法具有潜在的多效性,通过不同的方式对微环境作出反应从而发挥作用。文献证明这种由氧和葡萄糖双重耗尽导致的神经细胞损伤模型可以更好地模拟临时动脉闭塞期间发生的损伤[5]。有研究报道脑微血管内皮细胞(brain microvascular endothelial cells, BMECs)在神经细胞损伤中起关键作用[6]。基于PC12细胞的神经细胞特性,也被通常用于神经学研究[7]。因此本研究建立了BMECs和PC12细胞共培养模型,进一步研究THSWD对脑缺血再灌注损伤模型的氧化应激保护作用,为THSWD的临床研究提供更多理论依据和指导。
1 材料
1.1 细胞株 PC12细胞株和BMECs均购自于赛齐(上海)生物工程有限公司。
1.2 材料与试剂 桃仁(批号 1702181)、红花(批号 17072135)、川芎(批号 17010335)、熟地黄(批号 1705312)、当归(批号 1611085)和白芍(批号 17110114)均购自安徽普仁中药饮片有限公司,并经安徽中医药大学中药资源教研室鉴定;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒:上海碧云天生物技术有限公司;transwell小室(孔径:0.4 μm):美国Corning公司;Annexin Ⅴ-FITC/PI凋亡试剂盒:上海BestBio贝博生物;二氢罗丹明(dihydrorhodamine,DHR):美国Sigma公司;β-actin:北京中山金桥生物技术有限公司;蛋白标准品Marker:美国Sigma公司;小鼠单克隆抗体缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)、兔多克隆抗体Bcl-2、兔单克隆抗体Bax:美国Abcam公司;山羊抗鼠IgG二抗:武汉博士德生物工程有限公司;一抗稀释液:江苏碧云天生物技术研究所。
1.3 主要仪器 MCO-175型CO2培养箱:日本SANYO公司;Proox C21型三气培养箱:美国Biospherix公司;MSS全波长酶标仪:美国Thermo公司。
2 方法
2.1 THSWD药液的制备 参照第7版《药剂学》[8]中THSWD的配伍比例(桃仁、红花、熟地黄、当归、白芍、川芎的质量比为3∶2∶4∶3∶3∶2),加入上述中药饮片总质量10倍的75%乙醇冷凝回流提取2 h,过滤,滤渣加入上述中药饮片总质量8倍的75%乙醇冷凝回流提取2 h后过滤;将两次滤液合并,旋转蒸发浓缩成1.0 g/mL的浓缩液备用。
2.2 THSWD对BMECs和PC12细胞安全浓度的筛选 取对数生长期的BMECs和PC12细胞分别用胰酶消化并计数。对于BMECs和PC12组THSWD浓度设置为0、0.02、0.05、0.1、0.2、0.4、0.8、1.6 mg/mL。培养箱中培养24 h,每孔加5 mg/mL的MTT 20 μL,37 ℃、5% CO2培养箱孵育4 h,弃上清,用150 μL DMSO溶解蓝紫色甲瓒,室温避光振荡10 min。计算细胞存活率(缺糖缺氧再灌注组OD值/空白对照组OD值×100%)。
2.3 BMECs和PC12细胞OGD/R时间筛选 取对数生长期的BMECs和PC12细胞,分别用胰酶消化并计数。对于BMECs和PC12 OGD/R组设置为缺糖缺氧0、2、4、6、8、12 h,缺糖缺氧条件为95%高纯N2、5% CO2,复糖复氧24 h,MTT法检测细胞存活率。
2.4 BMECs和PC12共培养模型建立 借助Transwell小室建立共培养体系,无菌条件下,将BMECs(1×106/mL)接种于6孔板底部,另取空白孔放上Transwell小室,将PC12(1×106/mL)接种在Transwell小室中,待两种细胞均贴壁生长后,吸弃原培养基,将Transwell小室移到种有BMECs的孔中,建立起共培养体系。
2.5 实验分组和给药 对照组:无血清高糖培养基在正常CO2培养箱中培养;OGD/R组:无血清无糖培养基在缺氧小室中先培养4 h,再更换为无血清高糖培养基在正常CO2培养箱培养24 h;THSWD低、中、高剂量组:终浓度为0.2、0.4、0.8 mg/mL的THSWD无血清高糖培养基分别预处理BMECs 24 h,吸去培养液,共培养体系用无血清无糖培养基在缺氧小室中先培养4 h,再更换为无血清高糖培养基在正常CO2培养箱培养24 h。
2.6 指标检测
2.6.1 细胞活力及形态检测 取对数生长期的BMECs和PC12细胞。另取空白孔放上Transwell小室,将PC12(1×106/mL)接种在Transwell小室中,待细胞贴壁生长至80%左右,吸弃原培养基,将Transwell小室移至种有BMECs的孔中,建立起共培养体系,进行分组干预。细胞处理完成后,倒置显微镜下观察细胞形态变化,并拍照。然后每孔加入5 mg/mL MTT 280 μL,反应4 h后,吸去上清,再加DMSO溶解甲瓒结晶,在490 nm波长下检测,每组设3个复孔。
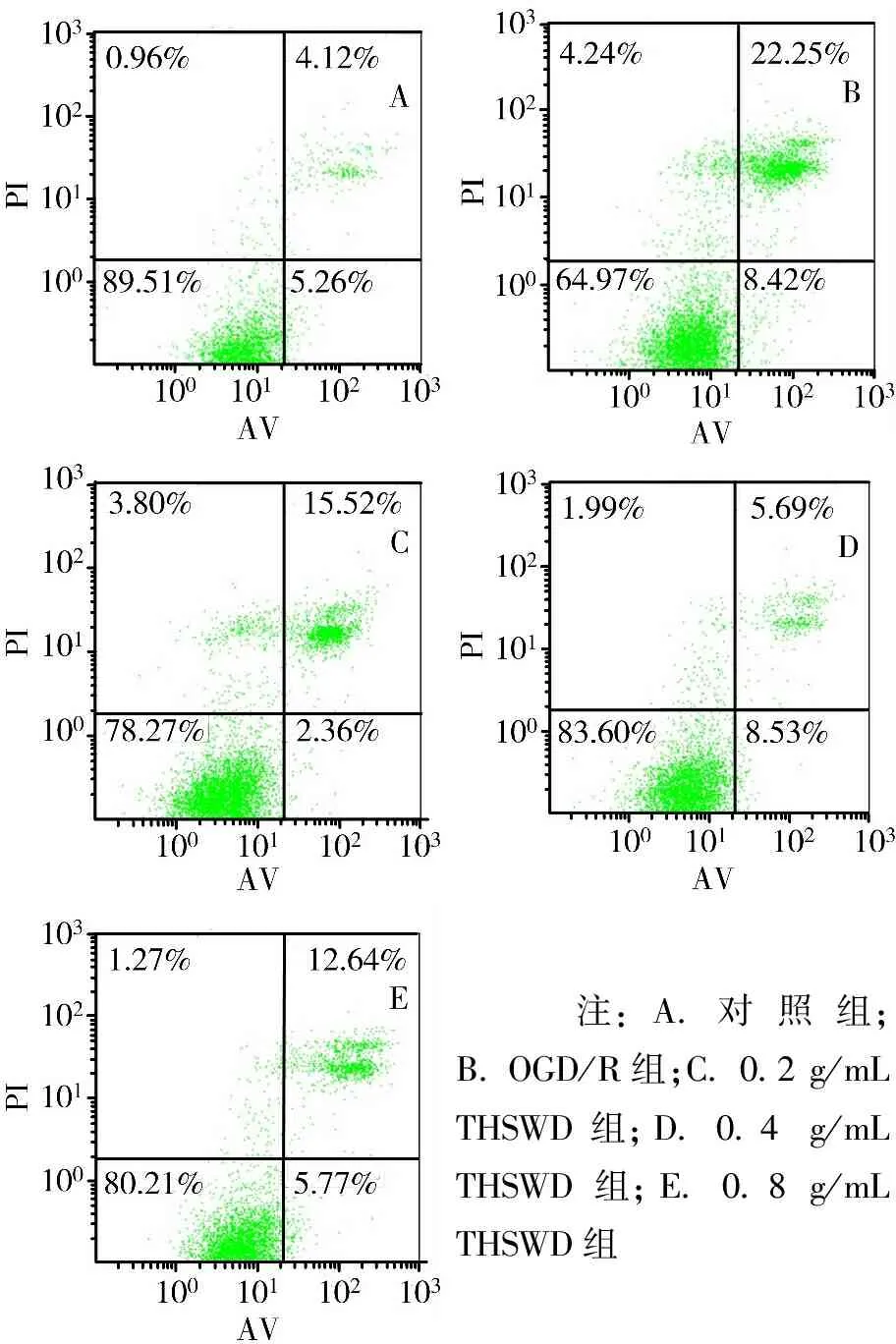
2.6.2 Annexin Ⅴ-FITC/PI双染法测定OGD/R诱导的共培养体系中PC12细胞凋亡率 细胞处理完成后,用不含EDTA的胰酶消化Transwell小室内PC12细胞,离心,取上清。加入400 μL 1×Annexin Ⅴ结合液悬浮细胞,5 μL Annexin-FITC染色液,轻轻混匀后避光保存15 min,温度为2~8 ℃。然后加入10 μL PI染色液避光孵育5 min,温度为2~8 ℃,流式细胞仪检测,每组设3个复孔。
2.6.3 DHR检测OGD/R诱导的共培养体系中PC12细胞内活性氧(reactive oxygen species,ROS)水平 细胞处理完成后,吸去Transwell内原培养基,用不含血清的培养基清洗2次,加入5 μmol/L的DHR溶液1 mL,避光孵育1 h,然后用胰酶消化细胞并离心收集,1 000 r/min离心5 min,离心后PBS吹打,用PBS重悬制成细胞悬液。处理完后用流式细胞仪检测,每组设3个复孔。结果用平均荧光强度(mean fluorescent intensity ,MFI)值表示。
在使用时,通过设置横杆2,当需要清理白板1的版面时,通过移动横杆2到适当的位置,下压把手16,带动横杆2向下运动,可使圆筒擦8和方擦15与白板1接触,通过设置圆筒擦8两侧的方擦15,可三重清理白板1的表面,从而达到清理白板1表面更加干净的目的,通过设置固定块3和滑块4,使横杆2的移动更加稳定、快速和方便,通过设置固定杆9底部的滚轮11与滚槽10,不仅可支撑横杆2,且使横杆2的移动更加稳定,且通过设置限位弹簧7,在不需要清理时,圆筒擦8与白板1不接触。
2.6.4 OGD/R诱导的共培养体系中PC12细胞内MDA含量及SOD、GSH-Px活性检测 细胞处理完成后,按照试剂盒说明书测定其中MDA含量、SOD及GSH-Px活力。
2.6.5 Western blot法检测OGD/R诱导的共培养体系中PC12细胞内Bax、Bcl-2及HIF-1α蛋白表达水平 细胞处理完成后,弃去培养液,用细胞刮轻轻刮下Transwell内细胞并收集。1 500 r/min离心5 min,去上清,加入含PMSF的蛋白裂解液150 μL,在冰上裂解30 min后,4 ℃、15 000 r/min离心15 min。取10 μL作蛋白定量,其余蛋白溶液加入上样缓冲液,沸水煮5 min,-20 ℃冰箱保存。之后电泳,转膜,室温下封闭,4 ℃孵育过夜,加二抗孵育,摇床振摇洗膜4次。
3 结果
3.1 THSWD安全浓度及缺糖缺氧再灌注时间的筛选
3.1.1 THSWD对BMECs和PC12细胞安全浓度的筛选 采用MTT法检测THSWD对正常培养的BMECs细胞的作用。结果表明,在一定浓度范围内THSWD可以促进BMECs的增殖,其中0.2、0.4 mg/mL THSWD对BMECs细胞增殖的促进作用最明显,而0.2、0.4、0.8 mg/mL THSWD对PC12细胞增殖的促进作用最为明显。见表1。
3.1.2 BMECs和PC12细胞OGD/R时间筛选 结果表明,OGD/R时间对BMECs增殖的抑制作用在缺糖缺氧4、6、8 h时明显,复糖复氧24 h后,OD值分别为(0.308±0.037)、(0.200±0.020)和(0.158±0.065)。而对PC12细胞增殖的抑制作用最大,在缺糖缺氧4、6、8 h和复糖复氧24 h的OD值依次是(0.168±0.037)、(0.120±0.019)、(0.110±0.046)。因此,OGD/R诱导的BMECs和PC12共培养体系损伤的最佳时间为缺糖缺氧4 h,复糖复氧24 h。

表1 MTT法检测THSWD对BMECs和PC12细胞存活率的影响
3.2 THSWD对OGD/R诱导的共培养体系中PC12细胞活力的影响 与对照组比较,OGD/R组OD值显著降低(P<0.05)。与OGD/R组比较,0.2、0.4、0.8 mg/mL THSWD组OD值均显著增高(P<0.05)。见图1。
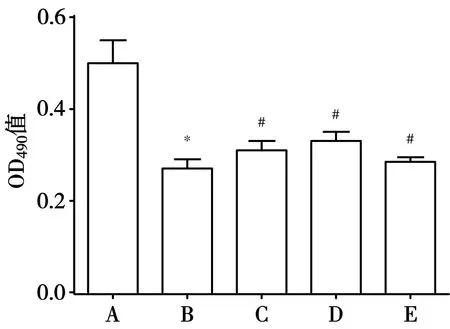
注:A.对照组;B. OGD/R组;C. 0.2 g/mL THSWD组;D. 0.4 g/mL THSWD组;E. 0.8 g/mL THSWD组;与对照组比较,*P<0.05;与OGD/R组比较,#P<0.05
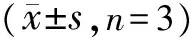
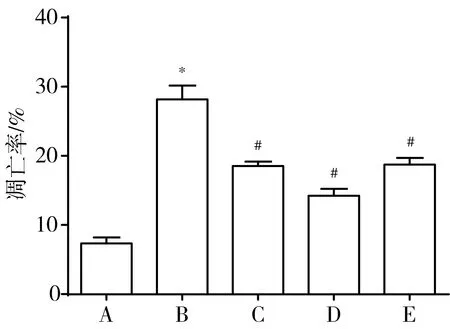
3.4 THSWD对OGD/R诱导的共培养体系中PC12细胞凋亡率的影响 与对照组比较,OGD/R组PC12细胞凋亡率显著增加(P<0.05);与OGD/R组比较,0.2、0.4、0.8 mg/mL THSWD组PC12细胞凋亡率均显著下降(P<0.05)。见图3、图4。
3.5 THSWD对OGD/R诱导的共培养体系中PC12细胞ROS的影响 与对照组比较,OGD/R组PC12细胞内ROS水平显著升高(P<0.05);与OGD/R组比较,0.2、0.4、0.8 mg/mL THSWD组共培养体系中PC12细胞ROS水平均显著降低(P<0.05)。见图5。
注:A.对照组;B. OGD/R组;C. 0.2 g/mL THSWD组;D. 0.4 g/mL THSWD组;E. 0.8 g/mL THSWD组
图2倒置显微镜下观察THSWD对OGD/R诱导的
共培养体系中PC12细胞形态的影响(10×10倍)
注:A.对照组;B. OGD/R组;C. 0.2 g/mL THSWD组;D. 0.4 g/mL THSWD组;E. 0.8 g/mL THSWD组
图3流式细胞仪检测各组共培养体系中PC12细胞凋亡率
3.6 THSWD对OGD/R诱导的共培养体系中PC12中MDA含量及SOD、GSH-Px活性的影响 与对照组比较,OGD/R组PC12细胞中MDA含量显著升高(P<0.05),SOD和GSH-Px活性显著降低(P<0.05);与OGD/R组比较,0.2、0.4 mg/mL THSWD组MDA含量显著降低(P<0.05),SOD和GSH-Px活性显著升高(P<0.05)。0.8 mg/mL THSWD组GSH-Px活性也显著升高(P<0.05)。见图6。
注:A.对照组;B.OGD/R组;C. 0.2 g/mL THSWD组;D. 0.4 g/mL THSWD组;E. 0.8 g/mL THSWD组;与对照组比较,*P<0.05;与OGD/R组比较,#P<0.05
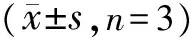
注:A.对照组;B.OGD/R组;C. 0.2 g/mL THSWD组;D. 0.4 g/mL THSWD组;E. 0.8 g/mL THSWD组;与对照组比较,*P<0.05;与OGD/R组比较,#P<0.05
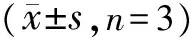
3.7 THSWD对OGD/R诱导的共培养体系PC12细胞中Bcl-2、Bax和HIF-1α蛋白表达的影响 与对照组比较,OGD/R组HIF-1α蛋白表达水平显著增加(P<0.05);与OGD/R组比较,0.2、0.4 mg/mL THSWD组HIF-1α蛋白表达水平均显著升高(P<0.05);与对照组比较,OGD/R组Bax蛋白表达水平显著增加(P<0.05),Bcl-2蛋白表达水平显著减少(P<0.05),Bcl-2/Bax比值显著下调(P<0.05);与模型组比较,0.2、0.4 mg/mL THSWD组Bax蛋白表达水平显著降低(P<0.05),Bcl-2蛋白表达水平显著增加(P<0.05),Bcl-2/Bax比值显著上调(P<0.05),0.8 mg/mL THSWD组Bcl-2蛋白表达水平显著升高(P<0.05)。见图7、图8。
注:A.对照组;B.OGD/R组;C. 0.2 g/mL THSWD组;D. 0.4 g/mL THSWD组;E. 0.8 g/mL THSWD组;与对照组比较,*P<0.05;与OGD/R组比较,#P<0.05


注:A.对照组;B. OGD/R组;C. 0.2 g/mL THSWD组;D. 0.4 g/mL THSWD组;E. 0.8 g/mL THSWD组
图7Westernblot法检测各组共培养体系PC12细胞中Bcl-2、Bax和HIF-1α蛋白表达水平
4 讨论
缺血/再灌注损伤具有高病死率和高致残率。由于氧气的高消耗,氧化还原稳态在大脑中起重要作用[9]。许多临床和实验研究观察表明氧化应激在发病机制和发展中的作用。研究发现,ROS和MDA的含量以及SOD和GSH-Px的活性在缺血再灌注损伤中起着非常重要的作用。过量的细胞内ROS可能会影响细胞内的氧化还原平衡[10],ROS导致分子受损,这有助于直接与DNA、蛋白质和脂质发生反应。MDA水平升高也与自由基损伤有关。SOD和GSH-Px是抗氧化应激生理防御的一部分[11]。

注:A.对照组;B.OGD/R组;C. 0.2 g/mL THSWD组;D. 0.4 g/mL THSWD组;E. 0.8 g/mL THSWD组;与对照组比较,*P<0.05;与OGD/R组比较,#P<0.05
在课题组前期研究中,已经证明THSWD治疗可显着改善OGD/R损伤,降低MDA和ROS水平,并促进SOD和GSH-Px的活性。
在缺血性脑卒中的生物学过程中,HIF-1α在细胞凋亡过程中发挥着重要的作用,与Bax蛋白的表达之间存在负相关关系,而与Bcl-2蛋白的表达之间存在正相关关系,从而可以起到抑制细胞凋亡的作用[12]。Bax/Bcl-2比值代表了细胞凋亡和增殖之间的平衡[13]。本研究表明,THSWD通过上调HIF-1α和Bcl-2表达水平和下调Bax表达水平保护PC12细胞免受OGD/R诱导的损伤。
神经血管单元构成复杂的通讯网络[14]。据报道,BMECs分泌许多与OGD/R相关的细胞因子。动物实验和临床试验证实BMECs对神经细胞损伤和神经退行性疾病的保护作用。研究发现,当与间充质干细胞(mesenchymal stem cells,MSCs)共培养时,内源性IL-6可减少细胞凋亡并保护OGD损伤的PC12细胞[15]。与MSC共培养可以保护PC12免受缺氧诱导的损伤,这可能与MSC中促红细胞生成素基因表达增加有关[16]。研究表明,THSWD中羟基红花黄色素A和阿魏酸对OGD/R模型中BMECs具有保护作用[17-18]。
氧化应激在脑缺血/再灌注损伤发病机制中的作用日益受到重视。THSWD作为活血化瘀的经典方,具有保护内皮损伤、抗氧化、抗血小板活化等作用[19-21]。课题组前期相关研究已经表明,THSWD对拟缺血损伤人BMECs具有保护作用,其机制与增强细胞抗氧化能力有关[22]。总之,本研究结果表明,THSWD在BMECs-PC12共培养体系中被证实具有抗氧化作用。THSWD可显著增强共培养体系中PC12细胞的活性,增强PC12细胞抗氧化和清除氧自由基的能力,改善细胞损伤,抑制细胞凋亡。
