犬小孢子菌、石膏样小孢子菌、须毛癣菌多重PCR检测方法的建立及初步应用
2019-06-11欧阳伟王晶宇姚凌云吴世妍王晓丽潘群兴夏兴霞诸玉梅刘国芳王永山
钱 晶,欧阳伟,王晶宇,姚凌云,吴世妍,王晓丽,潘群兴,夏兴霞,诸玉梅,刘 军,刘国芳,王永山
(1.江苏省农业科学院兽医研究所 农业部兽用生物制品工程重点实验室,南京 210014;2.南京大学医学院附属鼓楼医院,南京210008;3. 江苏农林职业技术学院畜牧兽医学院,镇江212400)
随着社会的进步、经济发展和人们生活水平的提高,宠物饲养量在全国快速增加,目前我国宠物犬约有1.5亿只,宠物猫约有3000万只[1]。浅表皮肤真菌病是宠物犬、猫临床上的常见皮肤癣菌病,表现为皮肤出现明显化脓性渗出、结痂、溃疡、斑块化脱毛、角质化、毛囊炎及各种癣等,主要由犬小孢子菌(Microsporum canis,Mc)、石膏样小孢子菌(Microsporum gypseum,Mg)和须毛癣菌(Trichophyton mentagrophytes,Tm)单独或混合感染引起[2]。犬小孢子菌感染在犬皮肤真菌病中占50%~70%,在猫皮肤真菌病中高达90%以上[3-4]。石膏样小孢子菌属嗜土壤菌,宠物容易从污染土壤或草丛中携带,经常造成面部或四肢的脓疱,并伴随角质化病灶[5]。须毛癣菌,又名石膏样毛癣菌,常以复合体形式引发皮肤癣病。同时,犬小孢子菌、石膏样小孢子菌和须毛癣菌属于重要的人兽共患病原菌,可引起人感染皮肤癣菌病[6],对公共卫生安全造成了较大威胁。
目前,真菌分型鉴定通常采用分离培养及菌落表型特征分析[7],但是分离培养时间周期长,人为误差大,对于混合真菌样品难以区分,很难对疑似菌进行准确鉴别。近年来,分子生物学检测技术发展迅速,在一定程度上为真菌种属鉴别以及基因分型提供了有力支撑[8],包括线粒体DNA限制性片段长度多态性分析[9]、随机扩增多态性分析[10]以及基于PCR的限制性片段长度多态性分析[11]和随机引物法[12]等,但这些方法存在培养物纯度难以达到要求,操作步骤繁琐等缺点。在实践应用中,采用快速、便捷的检测手段对皮肤浅表真菌病的筛查与鉴定具有重要的指导意义。PCR的应用使真菌鉴定更加便捷、特异和灵敏,其中多重PCR通过多对引物同时扩增多个核酸条带,可达到同时鉴定区分混合真菌的目的。
PCR扩增的目的基因是明确物种的关键因素,真菌rRNA为串联重复序列,包括保守性强的28S、18S、5.8S、5S和可变性高的内转录间隔区(internal transcribed spacer,ITS)和非转录间隔区(nontranscribed spacer,NTS),其中ITS是目前公认的真菌种间和种内基因分型的最可靠靶基因[13-14]。本研究根据犬小孢子菌、石膏样小孢子菌、须毛癣菌ITS的序列差异设计4条引物,通过条件优化,建立一种可同时检测这3种病原真菌的多重PCR方法,为宠物浅表真菌病的快速诊断提供有效手段。
1 材料与方法
1.1 菌种 犬小孢子菌(ATCC 36299)、石膏样小孢子菌(ATCC 24103)、须毛癣菌(ATCC 28185)购自美国标准物质保藏中心;金黄色葡萄球菌、大肠杆菌、酿酒酵母菌和沙门氏菌由本实验室保存。
1.2 主要试剂与培养基 PCR酶及缓冲液(RR53A)购自宝生物公司,DNA缓冲液(400 mmol/L Tris-HCl、60 mmol/L EDTA、150 mmol/L NaCl、1%SDS,pH 8.0)、醋酸钾(5 mol/L,pH 4.8)为本实验室自行配制;沙氏葡萄糖琼脂培养基115℃灭菌15 min;其他试剂均为国产分析纯。
1.3 引物设计 通过查阅文献,基于GenBank中犬小孢子菌、石膏样小孢子菌、须毛癣菌ITS序列差异,应用Primer Premier 5.0软件设计4条引物,其中包含1条通用上游引物和3条特异性下游引物,引物序列见表1。
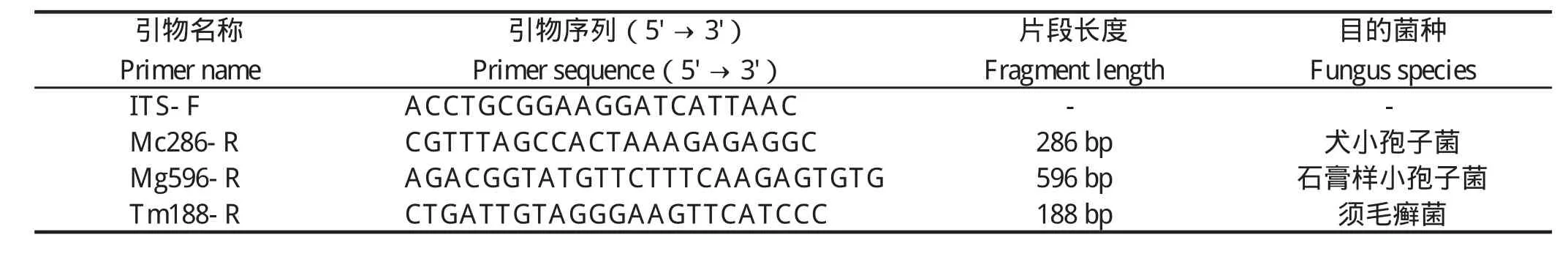
表1 引物序列Table 1 The primer sequences
1.4 真菌基因组DNA的提取 将真菌接种至沙氏葡萄糖培养基中,室温培养7 d后收集菌体并研磨处理,沉淀用500 μL DNA缓冲液重悬,室温静置10 min;加入150 μL 醋酸钾充分混匀,10 000×g离心5 min去除蛋白沉淀,上清转移至新1.5 mL离心管;加入等体积异丙醇,颠倒混匀,10 000×g离心5 min,弃上清;加入700 μL 70%乙醇,10 000×g离心5 min,弃上清;沉淀在室温下晾干,加入30 μL蒸馏水溶解核酸。
1.5 多重PCR反应体系的建立 PCR反应体系:ExTaqMix(2×)12.5μL、4条引物(5 μmol/L)各1 μL、模板2 μL,补足ddH2O至25 μL。PCR反应条件:94℃预变性5 min;94℃变性30 s,52℃~62℃退火30 s,72℃延伸30 s,35个循环;72℃再延伸10 min。
1.6 特异性检测 按照优化的多重PCR反应体系与条件对犬小孢子菌、石膏样小孢子菌、须毛癣菌、金黄色葡萄球菌、大肠杆菌、酿酒酵母菌、沙门氏菌基因组DNA进行扩增,验证多重PCR反应的特异性。
1.7 灵敏性检测 将3株真菌DNA模板进行10倍系列稀释,犬小孢子菌模板浓度为12.6×100~12.6×10-6μg/μL;石膏样小孢子菌模板浓度为8.8×100~8.8×10-6μg/μL;须毛癣菌模板浓度为13.6×100~13.6×10-6μg/μL,以不同稀释倍数的模板进行多重PCR扩增,测定其灵敏性。
1.8 重复性检测 根据建立的多重PCR分别对犬小孢子菌、石膏样小孢子菌、须毛癣菌基因组DNA进行检测,各重复5次检验其重复性和稳定性。
1.9 人工模拟样品的检测 将3种真菌菌株进行单独和混合处理,然后提取相应基因组DNA进行PCR检测。
1.10 临床样品的收集与检测
1.10.1 临床样品的收集 27份人临床皮屑样品由南京大学医学院附属鼓楼医院皮肤科刘军博士提供,43份宠物犬、猫毛发样品由江苏农林职业技术学院畜牧兽医学院刘国芳博士提供。
1.10.2 临床样品的检测 临床样品基因组DNA的提取参照方法1.4,并用建立的多重PCR方法对临床样品进行检测,与常规真菌分离培养法[15]进行比较。
2 结果
2.1 多重PCR反应条件的确定 PCR反应参数中,引物的退火温度起到关键性作用。在多重PCR 25 μL反应体系中,有效退火温度为56℃~62℃,见图1。确定的多重PCR反应条件:94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,35个循环;72℃再延伸10 min。
2.2 多重PCR反应的特异性检测 所建立的多重PCR方法对犬小孢子菌、石膏样小孢子菌、须毛癣菌均能扩增出预期的目的条带,相互间无交叉反应,并且对金黄色葡萄球菌、大肠杆菌、酿酒酵母菌、沙门氏菌基因组DNA的检测结果均为阴性,表明该多重PCR方法特异性良好(图2)。
2.3 多重PCR反应的灵敏性检测 所建立的多重PCR方法扩增Mc的检测灵敏度为12.6 pg/μL,Mg的检测灵敏度为8.8 pg/μL,Tm的检测灵敏度为13.6 pg/μL,见图3。
2.4 多重PCR反应的重复性检验 应用建立的多重PCR方法分别对Mc、Mg和Tm基因组DNA重复检测5次,结果均能扩增出目的条带,见图4,表明该方法检测结果稳定,重复性好。
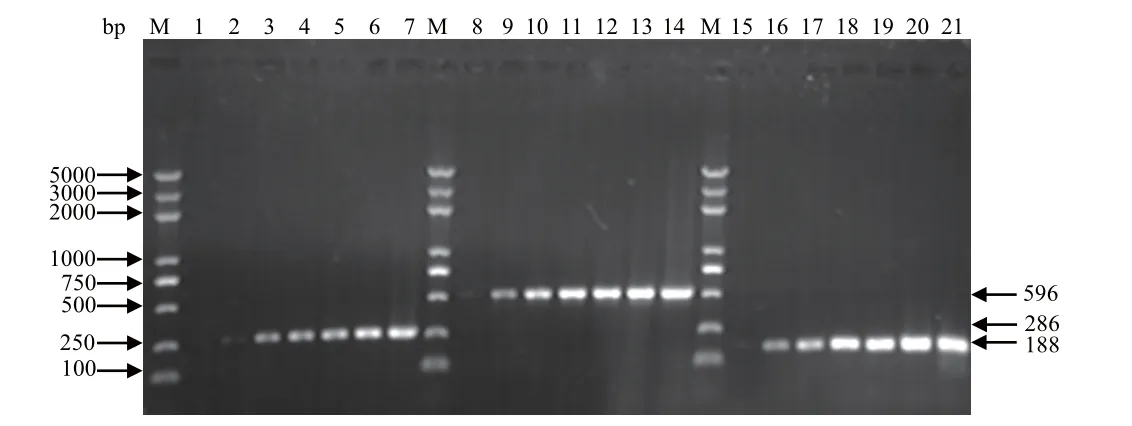
图1 不同退火温度对PCR反应的影响Fig.1 Effect of different annealing temperature on PCR reaction

图2 多重PCR特异性检测Fig.2 Specifi c test of multiplex PCR

图3 多重PCR灵敏度检测Fig.3 Sensitivity test of multiplex PCR

图4 多重PCR重复性检测Fig.4 Repeatability test of multiplex PCR
2.5 人工模拟样品的检测 应用建立的多重PCR方法对人工模拟样品进行检测,3种真菌单独或混合提取的基因组DNA均可扩增出与预期的条带,见图5。
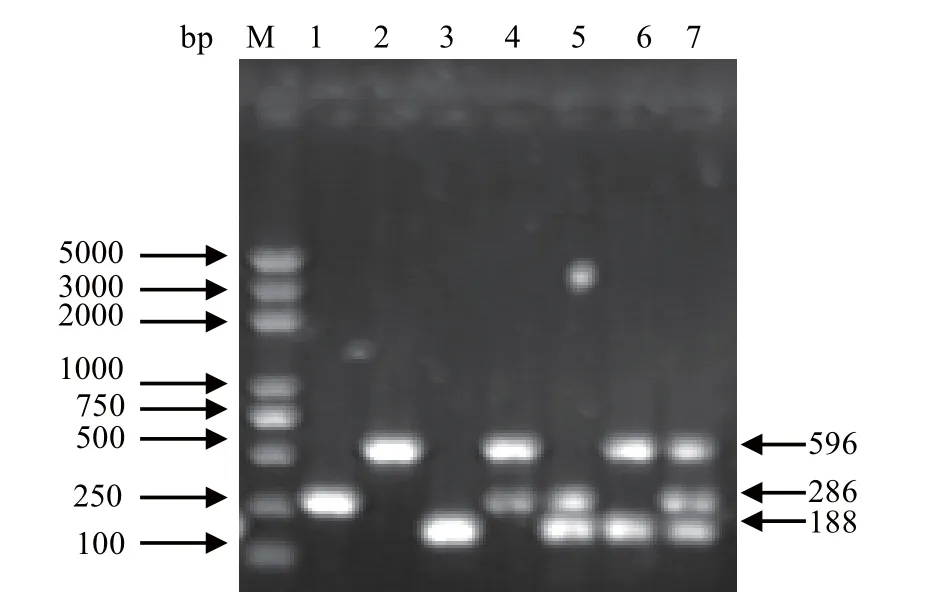
图5 多重PCR检测模拟样品Fig.5 Detection of simulated samples by multiplex PCR
2.6 临床样品的检测 用建立的多重PCR方法对27份人临床样品进行检测,结果显示人皮屑样品中阳性检出率为74.07%(20/27),其中Mc检出率为59.26%(16/27),Mg检出率为29.63%(8/27),Tm检出率为7.41%(2/27);对43份宠物犬、猫毛发样品进行检测,结果显示宠物毛发样品中阳性检出率为83.72%(36/43),其中Mc检出率为69.77%(30/43),Mg检出率为58.14%(25/43),Tm检出率为11.63%(5/43)。采用常规真菌分离培养法从阳性样品中获得10株致病性真菌,分离率仅为17.86%(10/56),表明该多重PCR的灵敏性高于常规方法。
采用多重PCR检测分离获得的10株真菌,1株分离株扩增后出现2个特异性条带,说明该样品同时存在Mc和Mg感染,而常规方法的鉴定结果仅为Mg感染;其余9个样品的种属鉴定比对结果均一致,见图6和表2,可见,多重PCR的敏感性优于常规分离培养鉴定方法。

图6 多重PCR检测临床分离株Fig.6 Detection of clinical isolates by multiplex PCR
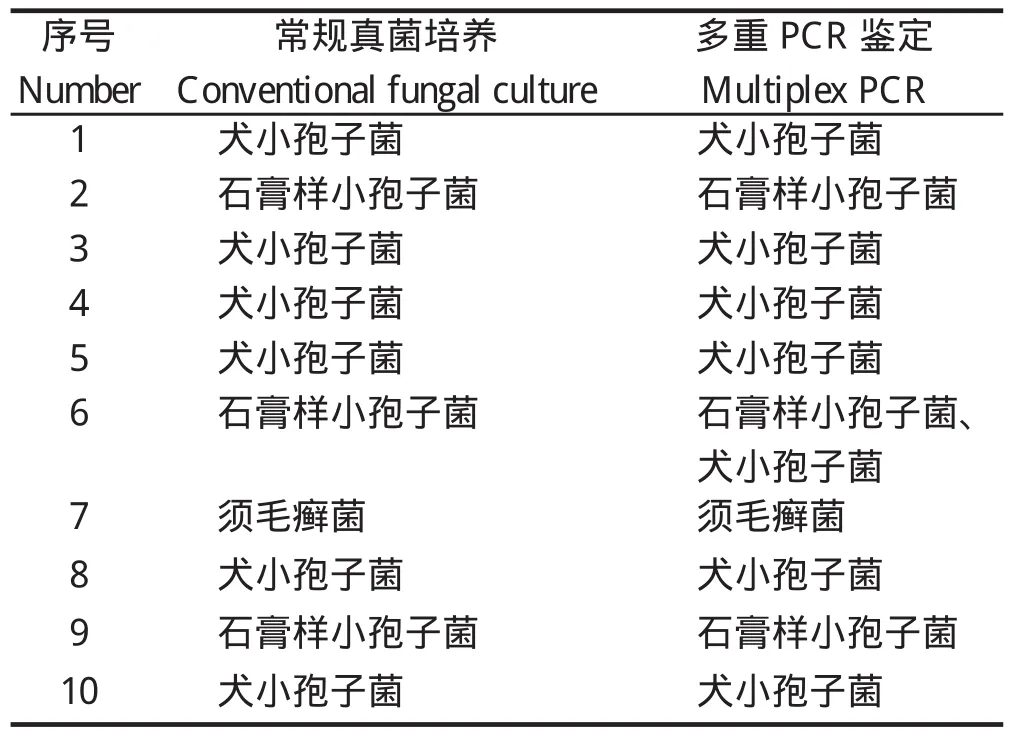
表2 多重PCR与真菌培养鉴定结果比较Table 2 Comparison of multiplex PCR and conventional fungal culture identifi cation
3 讨论
宠物皮肤病一年四季均可发生,根据发病原因可大致分为真菌性、细菌性、寄生虫性、病毒性、皮肤过敏性、自身免疫性、内分泌性和代谢性皮肤病等[16-17]。目前,宠物犬猫皮肤真菌病较为常见,以幼龄犬猫、免疫力低下和长毛的犬猫发病率最高。感染的犬猫经常抓挠致使皮肤破溃,从而在病灶部位反复感染。浅表真菌也会导致机体免疫机能的下降,进而加剧寄生虫或细菌等病原的感染,这给宠物的生活质量和观赏性造成了严重的影响[3,18-19]。同时,犬小孢子菌、石膏样小孢子菌、须毛癣菌均可在动物与人类之间发生接触性传播,对公共卫生造成危害[6]。付相钰等[20]从家养宠物检测出的致病癣菌与头癣患者种类相同,证实家养宠物是人类头癣的主要传染源。本研究中人临床样品真菌检出率(74.07%)与宠物临床样品检出率(83.72%)均处于较高水平,推测这些致病性真菌在人与宠物中处于较高流行态势。其中犬小孢子菌检出率最高,其次为石膏样小孢子菌和须毛癣菌,这与皮肤浅表真菌病感染病原种类结构相符[3,18-20]。
目前,临床上诊断皮肤真菌病仍采用伍氏灯照射、显微镜检测、皮肤组织病理学检查和真菌培养等[21-22],这些检测方法存在一定的局限性。例如,真菌分离培养方法操作繁琐,培养周期长,分离率低。本研究中真菌培养的分离率仅为17.86%(10/56),且该方法依赖主观判断,常出现假阳性或假阴性。另外,犬小孢子菌、石膏样小孢子菌、须毛癣菌等真菌生长特性和表型具有相似性,并且这3种致病性真菌的混合感染现象较为常见,通过常规鉴定手段难以区分。同时,真菌感染早期基本无明显症状,常规检测方法难以及时诊断。PCR检测技术具有快速简便,特异性强,灵敏度高,重复性好的特点,已成为鉴别诊断多种病原物种的重要手段,在此基础上改进并发展的多重PCR方法在混合感染的鉴别诊断上具有独特的优势。
本研究基于真菌ITS的序列差异,通过筛选特定位点引物序列扩增出大小不一的目的条带,既具有种属特异性又满足种间特异性。建立的多重PCR方法特异性强,不仅对人工模拟的单独或混合样品检测准确,而且从临床样品中扩增出多个目的条带,说明样品中存在混合感染,而这种混合感染现象在临床上也较为多见[22]。同时本研究建立的多重PCR灵敏性高,检测下限可达pg级别,检出率显著高于常规真菌培养法。
综上所述,本研究根据犬小孢子菌、石膏样小孢子菌、须毛癣菌ITS序列差异所建立的多重PCR方法能同时检测3种致病性真菌,操作简便,灵敏性高,特异性强,弥补了常规检测方法的局限性,这对致病性真菌早期潜伏、隐性感染、混合感染的诊断以及配套治疗十分重要,为宠物犬猫皮肤真菌病的快速诊断及防治提供了新策略。
